宁夏地区牛源产与非产ESBLs大肠埃希氏菌耐药性差异比较
2022-04-11高海慧黎玉琼扈宁霞王培柱吴学青康晓冬
高海慧,黎玉琼,汪 洁,扈宁霞,王培柱,吴学青,康晓冬*
(1.宁夏农林科学院动物科学研究所,银川 750002;2.陕西榆林市绥德县名州区农牧业综合服务站,绥德 718000;3.宁夏吴忠市利通区扁担沟镇畜牧兽医工作站,吴忠 751100)
大肠埃希氏菌(Escherichiacoli,E.coli)为条件性致病菌,在一定条件下可单独感染或者同其他致病菌混合感染引起发病。大肠埃希氏菌的血清型复杂,毒力基因种类多且经常同时携带多种毒力基因,防控和治疗任务艰巨。目前,在奶牛肉牛养殖中,抗生素是治疗该病的首选药物,宁夏回族自治区牛对阿米卡星敏感性最高[1]。超广谱β-内酰胺酶(extend spectrum β-lactamase,ESBLs)是一种可以为大肠埃希氏菌提供多种β-内酰胺类抗菌药物的水解酶[2],可以通过转化、转导和接合等形式在细菌中传播扩散耐药基因,是细菌对β-内酰胺类抗菌药物的主要耐药机制[3]。国际上研究认为ESBLs是较为活跃的β-内酰胺酶,尤其是在肠杆菌科细菌中起到较为重要的作用[4]。不同国家、地区兽医用药习惯、剂量不同,使得不同国家、地区基因型和基因亚型也存在差异。奶牛和肉牛是我区畜牧业重要的支柱产业,肉牛又是南部山区脱贫攻坚的主力军,本研究开展牛源产ESBLs大肠埃希氏菌筛选、耐药性比较,为牛源产ESBLs大肠埃希氏菌在我区感染和流行提供资料。
1 材料与方法
1.1 材料
1.1.1 样本 于2017年10月至2020年10月采集宁夏地区规模化牛场健康源肛拭子120份,腹泻源牛肛拭子157株,离心管收集,冰袋运输。
1.1.2 药品 ESBLs测定盒[头孢他定(CAZ)、头孢噻肟(CTX)、头孢他定/克拉维酸(CAZ/clav))、头孢噻肟/克拉维酸(CTX/clav)],本着经济、有效、广谱、安全的原则,选用临床常用抗菌药物21种,具体如下:头孢拉定(先锋VI,30 μg/片,批号200513),头孢呋辛(30 μg/片,批号200525),链霉素(10 μg/片,批号200524),复方新诺明(23.78 μg SMZ/1.25 μg TM/片,200508),红霉素(15 μg/片,批号200520),卡那霉素(30 μg/片,批号200513),哌拉西林(100 μg/片,批号200607),头孢氨苄(头胞力新,30 μg/片,批号200515),四环素(30 μg/片,批号200515),诺氟沙星(10 μg/片,批号200511),头孢噻肟(30 μg/片,批号200602),环丙沙星(5 μg/片,批号200517),头孢唑啉(30 μg/片,批号200603),庆大霉素(10 μg±2.5 μg/片,批号200513),头孢曲松(30 μg/片,批号200530),阿米卡星(30 μg±7.5 μg/片,批号200609),恩诺沙星(5 μg/片,批号200523),氧氟沙星(5 μg/片,批号200605),阿莫西林(10 μg/片,批号200517),氨苄西林(10 μg/片,批号200527),头孢他啶(30 μg/片,批号200529)等,杭州滨和微生物试剂有限公司产品。
1.1.3 主要试剂 麦康凯培养基MAC(批号161119)、伊红美蓝琼脂培养基(EMB)(批号161020)、MH 琼脂培养基 (批号161021),青岛海博生物技术有限公司产品;4.5 g/L NaCl溶液,法国梅里埃公司产品;细菌基因组DNA提取试剂盒、2×TaqPCR MasterMix、MarkerⅠ,天根生化科技(北京)有限公司产品。
1.1.4 主要仪器 全自动微生物鉴定系统(VITEK-2-Compact15),法国梅里埃公司产品;PCR仪,美国Bio-Rad公司产品;超净工作台(SW-CJ-1FD),苏净集团安泰公司产品;电子比浊仪(DensiCHEK Plus),美国 BioMerieux公司产品;电热恒温培养箱(PHP-9162),浙江托普仪器有限公司产品。
1.2 方法
1.2.1 大肠埃希氏菌的分离鉴定 将肛拭子于营养肉汤中37℃过夜培养,培养物接种于EMB、MAC,培养16 h~24 h,镜检纯化,VITEK 2 Compact进行菌种鉴定,挑选鉴定为阳性的大肠埃希氏菌进行16S rRNA鉴定[1],引物序列见表1。

表1 基因检测引物序列及大小Table 1 Primer sequences and fragment size of gene detection
1.2.2 大肠埃希氏菌ESBLs筛选 用麦氏比浊仪调整菌液浓度为0.5个麦氏单位,接种于MH平板上,均匀涂布,采用双纸片协同法,贴ESBLs测定盒中的CTX(30 μg)、CTX/CLA(30 μg/10 μg),CAZ(30 μg)、CAZ/CAL(30 μg/10 μg)两组于平板,37℃过夜培养,比较加入克拉维酸与不加克拉维酸的抑菌直径≥5 mm者判定为产ESBLs菌株。
1.2.3 耐药性试验 试验采用K-B法进行,确定大肠埃希氏菌的药物敏感性,结果按照临床实验室标准化委员会(CLSI)标准判定。
2 结果
2.1 大肠埃希氏菌的分离鉴定
277份肛拭子样本中分离到142株大肠埃希氏菌,阳性率51.26%,分离株在EMB上呈具有黑色金属光泽菌落,在MAC上呈圆形、突起光滑、湿润的粉色菌落,纯化菌株经VITEK 2 Compact鉴定为大肠埃希氏菌。
2.2 大肠埃希氏菌的16S rRNA鉴定
扩增2.1中鉴定株的16S rRNA基因,符合目的条带的部分产物送测序,经Blast比对确定为大肠埃希氏菌。
2.3 ESBLs检测结果
抑菌圈直径分析显示,腹泻源性74株大肠埃希氏菌有51株为产ESBLs菌株,23株为非产ESBLs菌株,阳性率为68.92%。非腹泻源68株大肠埃希氏菌有35株为产ESBLs菌株,33株为非产ESBLs菌株,阳性率为51.47%。
2.4 药敏试验结果
2.4.1 74株腹泻源大肠埃希氏菌药敏试验结果 74株腹泻源大肠埃希氏菌对试验药物多数呈耐药状态,对阿米卡星和头孢他啶较敏感,产ESBLs株耐药率普遍高于非产ESBLs株,产ESBLs与非产ESBLs株对阿米卡星耐药率分别为15.69%和4.35%,头孢他啶耐药率分别为11.76%和4.35%,差异不显著(P>0.5),对其他药物耐药率高,差异不显著(P>0.5),具体见表2和表3。
2.4.2 68株健康源大肠埃希氏菌药敏试验结果 68株健康源大肠埃希氏菌耐药率整体低于腹泻源大肠埃希氏菌,对阿米卡星和头孢呋辛较敏感,产ESBLs株耐药率均高于非产ESBLs株,产ESBLs与非产ESBLs株对头孢氨苄耐药率分别为81.82%和17.14%,差异显著(P<0.05);对头孢呋辛耐药率分别为21.21%和0,对卡那霉素分别为63.64%和20.00%,对红霉素分别为63.64%和14.29%,对其他药物均耐药率较高,但差异不显著(P>0.05),具体见表2和表3。
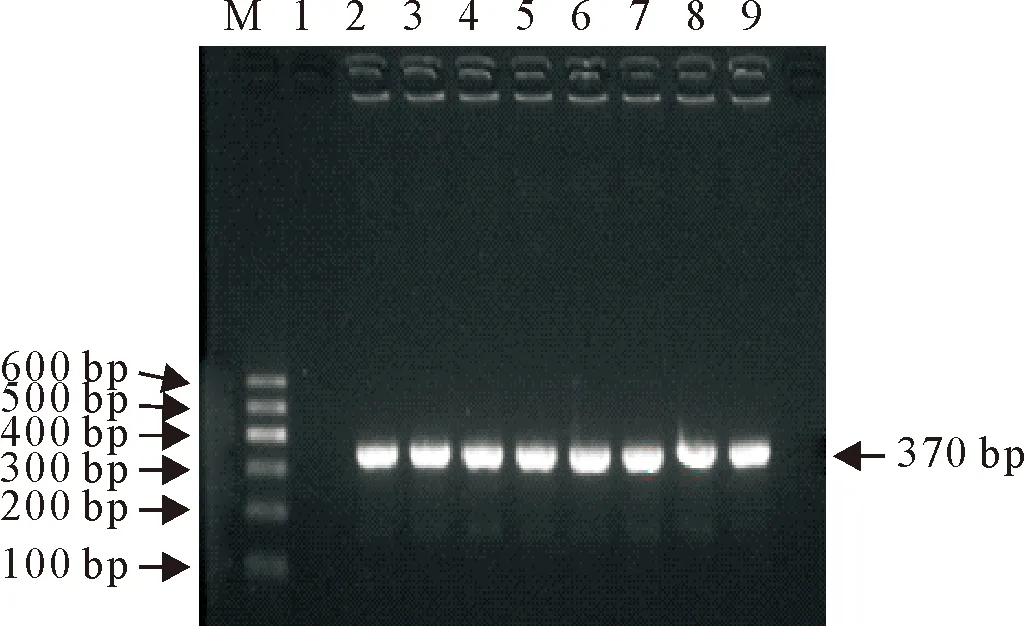
M.DNA MarkerⅠ;1.阴性对照;2~8.分离株PCR产物M.DNA MarkerⅠ;1.Negative control;2-8.PCR products of isolates图1 16S rRNA PCR扩增结果Fig.1 PCR amplification results of 16S rRNA

表2 产ESBLs大肠埃希氏菌药敏试验结果Table 2 Results of drug susceptibility test of Escherichia coli producing ESBLs strains

表3 非产ESBLs大肠埃希氏菌药敏试验结果Table 3 Results of drug susceptibility test of Escherichia coli non-producing ESBLs strains
2.4.3 产ESBLs与非产ESBLs株药敏试验结果 产ESBLs株对头孢他啶耐药率中,腹泻源性大肠埃希氏菌极显著低于健康源大肠埃希氏菌(P<0.01),非产ESBLs株对头孢氨苄、红霉素耐药率中,腹泻源性大肠埃希氏菌显著高于健康源大肠埃希氏菌(P<0.05),对头孢呋辛耐药率中,腹泻源性大肠埃希氏菌极显著高于健康源大肠埃希氏菌(P<0.01)。
2.5 多重耐药结果
10重耐药以上产ESBLs大肠埃希氏菌中,腹泻源极显著高于健康源(P<0.01),腹泻源多重耐药为10耐及以上,1株为全部耐药,健康源多重耐药为2耐及以上,无全部耐药。非产ESBLs大肠埃希氏菌中,腹泻源5株为19重耐药,健康源无19重耐药,健康源中3株不存在耐药情况,1株为非耐药株。产ESBLs大肠埃希氏菌多重耐药率高于非产ESBLs大肠埃希氏菌,但差异不显著(P>0.05),具体见表4和表5。分离株多重耐药情况严重,腹泻源产ESBLs大肠埃希氏菌耐药情况最严重。
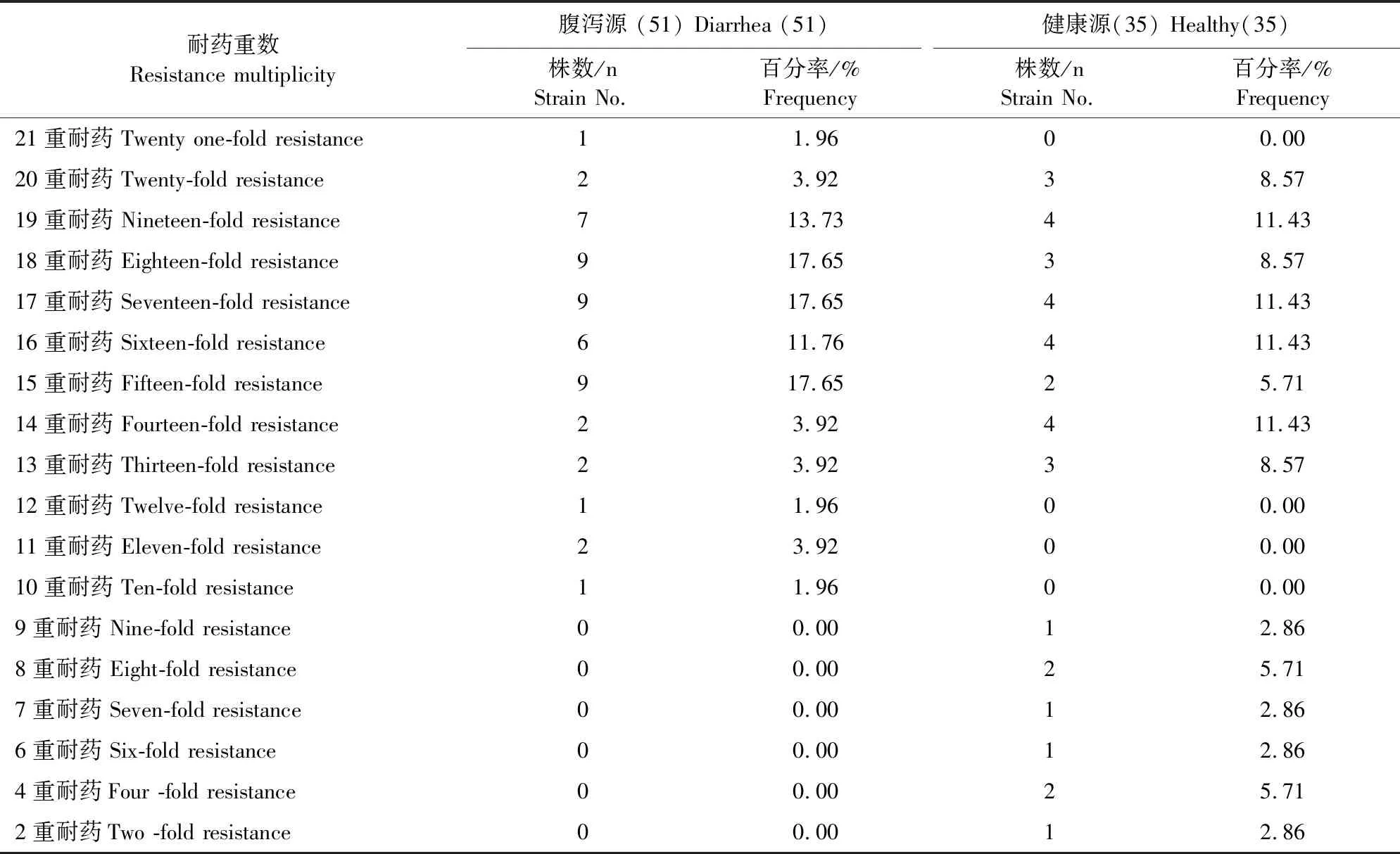
表4 产ESBLs大肠埃希氏菌多重耐药情况Table 4 Multiple drug resistance of Escherichia coli producing ESBLs strains

表5 非产ESBLs大肠埃希氏菌多重耐药情况Table 5 Multiple drug resistance of Escherichia coli non-producing ESBLs strains
3 讨论
大肠埃希氏菌是肠道正常菌群,维护肠道健康,使细菌耐药基因产生、传递、转移更加方便[5]。随着对抗生素的广泛使用,多重耐药菌及耐药基因急剧增长,对公共卫生安全构成威胁。ESBLs主要由肠杆菌科产生,由质粒介导,编码ESBLs酶的基因可通过转化、转导、接合、整合等途径扩散到细菌中,使大肠埃希氏菌对新型广谱 β-内酰胺类抗生素耐药性增加[6-7]。对分离自宁夏地区277株牛源大肠埃希氏菌进行ESBLs表型检测,腹泻源与健康源产ESBLs菌株阳性率分别为68.92%和51.47%,均高于四川省禽源大肠埃希氏菌产ESBLs菌株检出率(36.83%)[8],高于广东省食品动物(鸡、鸭、鹅和猪)中大肠埃希氏菌产ESBLs菌株的检出率(19.37%)[9],低于青岛鸡源大肠埃希氏菌产ESBLs菌株检出率(93.13%)[10],低于虎源大肠埃希氏菌产ESBLs菌株检出率(70.00%)[11]。不同畜种、来源、地区,大肠埃希氏菌产ESBLs菌株的流行分布存在差异,且宁夏地区牛源产ESBLs大肠埃希氏菌在宁夏地区牛养殖场中流行普遍,需要引起重视。
研究发现产ESBLs株、非产ESBLs株中腹泻源性、健康源大肠埃希氏菌药物敏感性存在差异。
产ESBLs株对头孢他啶耐药率中,腹泻源性大肠埃希氏菌极显著低于健康源大肠埃希氏菌(P<0.01)。非产ESBLs株对头孢呋辛耐药率中,腹泻源性大肠埃希氏菌极显著高于健康源大肠埃希氏菌(P<0.01),非产ESBLs株对头孢氨苄、红霉素耐药率中,腹泻源性大肠埃希氏菌显著高于健康源大肠埃希氏菌(P<0.05)。分离菌株长期处于多种抗生素的选择压力下,不同地区、不同管理模式均会影响药物敏感性,导致产ESBLs株、非产ESBLs、腹泻源、健康源大肠埃希氏菌耐药情况复杂。
本研究中腹泻源产ESBLs菌株的耐药性普遍高于非产ESBLs菌株,腹泻源产ESBLs株对其他药物耐药率均大于54.80%,非产ESBLs株对其他药物耐药率均大于47.80%,但差异不显著(P>0.05)。对阿米卡星、头孢他啶较敏感。史量全等[12]发现通辽地区牛腹泻大肠埃希氏菌对阿米卡星、哌拉西林、亚胺培南、美洛培能敏感,王理想[13]试验表明腹泻牛脏器源大肠埃希氏菌对左氧氟沙星、庆大霉素敏感。健康源产ESBLs菌株的耐药性明显高于非产ESBLs菌株,分离株对阿米卡星、头孢呋辛较敏感。对头孢氨苄耐药率分别为81.82%和17.14%,差异显著(P<0.05),其他药物均差异不显著(P>0.05)。坤清芳等[14]研究发现兔源产ESBLs大肠埃希氏菌对头孢他啶、阿米卡星、头孢西丁、头孢唑啉和诺氟沙星的耐药率显著高于非产ESBLs菌株。腹泻源与健康源产ESBLs株耐药率水平基本相当,腹泻源非产ESBLs株耐药率高于健康源非产ESBLs株。ESBLs是介导大肠埃希氏菌对β-内酰胺类药物耐药的主要因素[15],编码ESBLs酶的基因可以与其他非ESBLs酶耐药基因整合于同一质粒,将耐药基因进行传播[14,16],不同地区、不同畜种、不同养殖规模、不同生产管理条件都会影响耐药基因的表达。
产酶菌株对头孢噻肟等抗菌药物的耐药率均高于非产酶菌株[17],80.60% 的产ESBLs菌株表现多重耐药现象[18]。本研究中产ESBLs菌株多重耐药率高于非产ESBLs菌株,研究结果一致。本研究显示产ESBLs大肠埃希氏菌中,腹泻源多重耐药为10耐及以上,1株为全部耐药,健康源多重耐药10耐及以上占比77.14%,无全部耐药,腹泻源极显著高于健康源(P<0.01)。非产ESBLs大肠埃希氏菌中,腹泻源5株为19重耐药,健康源无19重耐药,3株为单重耐药,1株为非耐药。可能腹泻源性大肠埃希氏菌中部分为致病菌,毒力水平和耐药水平较高,分离株多重耐药现象普遍存在,腹泻源产ESBLs大肠埃希氏菌耐药情况最严重。药物的广泛应用及新抗菌药物的临床应用,使得大肠埃希氏菌产ESBLs酶株越来越多,多重耐药现象越来越复杂,应该引起更多的关注。
宁夏地区牛源产ESBLs大肠埃希氏菌检出率高,多重耐药现象严重,尤其是腹泻牛,提示宁夏地区牛场中产ESBLs菌株流行普遍。牛是耐药大肠埃希氏菌的重要宿主,ESBLs酶编码基因常常存在于质粒、转座子或整合子等可移动元件上,可以通过食用牛奶、牛肉等方式传递给人类,有重要公共卫生意义,应定期开展ESBLs水平监测,平时治疗时减少抗生素的使用。
