一起雏鸭大肠埃希氏菌感染病例的诊断
2022-12-07袁玮艺郑芳芳唐耀松林小枫童德文
袁玮艺,黄 凯,原 宇,郑芳芳,唐耀松,林小枫,童德文*,杜 谦*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西富强宏图牧业有限公司,陕西韩城 715412)
近年来,陕西省韩城市大规模引进北京鸭良种,建设了大型规模化北京鸭养殖场,但养殖数量的增加也伴随着疾病的发生和传播速度增加,给养殖企业带来了风险和损失。在规模化鸭养殖场中鸭大肠埃希氏菌(Escherichiacoli)和鸭疫里氏杆菌(Riemerellaanatipestifer,RA)是常见的致病病原[1]。E.coli主要威胁2周龄~6周龄雏鸭,感染可导致鸭突然发病,病死率高,常见败血型鸭大肠杆菌病,剖检可见由于渗出导致的心包炎、肝周炎、腹膜炎和气囊炎等,但其病变与RA感染导致的鸭传染性浆膜炎临床症状相似度较高,需要实验室分离病原菌鉴别[1-2]。2020年8月,陕西省韩城市某北京鸭养殖场发生一起雏鸭急性死亡疫情,为了能及时确定病因,以便于后续有针对性地防控养殖场流行的鸭病,对养殖场送检的病死雏鸭和病危雏鸭进行病理学检验和病原学检测,为本起雏鸭急性死亡疫情的诊断提供依据,为减少北京鸭养殖企业的损失提供帮助。
1 材料与方法
1.1 材料
1.1.1 病料来源 陕西省韩城市某北京鸭养殖场发生雏鸭急性死亡,送检5只病死雏鸭和5只病危雏鸭,剖检采集雏鸭肝脏、脾脏、肺脏、心脏和肾脏等组织,以及心包和腹腔渗出物。
1.1.2 实验动物 4周龄~6周龄的昆明系小鼠,购自成都达硕实验动物有限公司。
1.1.3 主要试剂 2×TaqMaster Mix(Dye plus)和反转录试剂盒,南京Vazyme公司产品;DNA标准DL 5 000,北京聚合美公司产品;巧克力培养基,广东环凯微生物科技有限公司产品;血琼脂平板、TSA和抗菌药物药敏纸片,湖南比克曼生物科技有限公司产品;TSB,北京陆桥技术股份有限公司产品;DNA提取液,北京索莱宝公司产品;TRIzol,美国Invitrogen公司产品。
1.1.4 主要仪器 台式高速冷冻离心机,安徽中科中佳科学仪器有限公司产品;PCR仪,Thermo公司产品;紫外凝胶成像系统,上海培清科技有限公司产品;电泳仪(DYY-7C),北京六一生物科技有限公司产品。
1.2 方法
1.2.1 病理剖检 按常规方法对送检雏鸭进行剖检,观察主要脏器的病理变化,采集雏鸭肝脏、脾脏、肺脏、心脏和肾脏等组织,以及心包和腹腔渗出物用于后续检测。
1.2.2 引物合成 参考地方标准、行业标准和期刊文献等(表1)合成鸭疫里氏杆菌(Riemerellaanatipestifer,RA)、鸭大肠埃希氏菌(E.coli)、鸭坦布苏病毒(Duck Tembusu virus,DTMUV)、鸭腺病毒Ⅰ型(Fowl adenovirus Ⅰ,FAdV Ⅰ)、鸭腺病毒Ⅱ型(FAdV Ⅱ)、鸭甲型肝炎病毒(Duck hepatitis A virus,DHAV)、番鸭细小病毒(Muscovy duckling parvovirus,MDPV)和禽流感病毒H9(Avian influ-enza virus H9,AIV H9)等病原的检测引物,引物序列见表1。

表1 引物序列
1.2.3 组织DNA提取 将采集的雏鸭组织匀浆后在-80 ℃反复冻融,离心取上清。部分上清用于DNA的提取,加入10 mg/mL终体积SDS和0.5 mg/μL终浓度蛋白酶K,颠倒混匀1 min,56 ℃水浴30 min。加入等体积DNA提取液,振荡混匀5 min后,12 000 r/min离心5 min。吸取上清,加入等体积氯仿,混匀5 min后,室温12 000 r/min离心5 min。吸取上清,加入1/10体积2 mol/L乙酸钠和2倍体积无水乙醇,在-80 ℃过夜。4 ℃、12 000 r/min离心15 min,弃上清,加入1 mL 750 mL/L乙醇洗涤2次,4 ℃离心弃上清,自然风干后加入ddH2O溶解,置-20 ℃保存备用。
1.2.4 组织cDNA的获得 取组织冻融离心上清,加入适量TRIzol溶液,剧烈振荡10 min;加入1/5体积氯仿,充分混匀后作用5 min,4 ℃、12 000 r/min离心5 min;吸取适量上清,加入等体积异丙醇,颠倒混匀后室温作用10 min,在-80 ℃沉淀30 min以上,4 ℃、12 000 r/min离心15 min;弃上清,加入750 mL/L乙醇洗涤2次,4 ℃离心弃尽上清,风干,加入适量DEPC H2O溶解。将提取的RNA以反转录试剂盒反转录为cDNA,置-20 ℃保存备用。
1.2.5 病原PCR检测 对于不同病原分别以提取的DNA或反转录获得的cDNA为模板,采用相应特异性引物进行PCR检测。
1.2.6 细菌的培养及鉴定 将采集的心包和腹腔渗出物分别接种TSA/巧克力培养平板,37 ℃培养过夜后,挑取单个菌落进行PCR检测。
1.2.7 细菌药敏试验 利用K-B法对分离菌进行药敏试验,将纯化培养的菌液均匀涂布于TSA/巧克力培养平板,待表面菌液干燥后加入药敏纸片,37 ℃培养24 h,测量抑菌圈直径,判定分离菌药物敏感性。
1.2.8 动物致病性试验 以1×108CFU/mL细菌培养物,0.2 mL/只腹腔接种试验小鼠,另以无菌生理盐水0.2 mL/只注射小鼠作为对照,每组5只,连续观察5 d,记录小鼠的发病和死亡情况。
2 结果
2.1 送检雏鸭临床症状
5只送检病危雏鸭精神沉郁、头颈歪斜、呼吸困难、瘫倒无力、羽毛污秽,泄殖腔周围有污绿色排泄物(图1A和图1B)。5只病死雏鸭头颈歪斜、羽毛粗乱,部分雏鸭泄殖腔周围有污物,口腔内有黄黑色黏稠物质(图1C和图1D)。
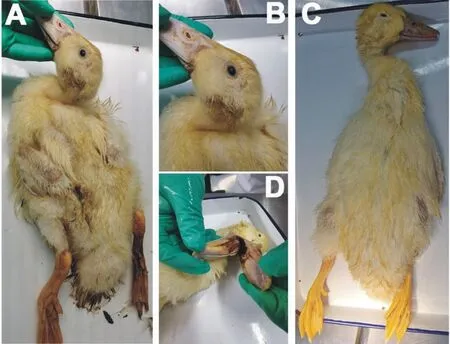
A.病危雏鸭大体照;B.病危雏鸭头颈部;C.病死雏鸭大体照;D.病死雏鸭口腔污物
2.2 送检雏鸭剖检病理变化
对雏鸭进行剖检,打开胸腔和腹腔后,病危雏鸭各脏器界限清晰,肝略肿大、部分区域黄白色,心包有少量浆液性渗出,其余脏器无明显变化(图2A和图2B)。病死雏鸭脏器粘连,肝肿大、棕红色,心脏皱缩,肝脏表面和心包内有大量易剥离的纤维素性渗出物(图2C、图2D和图2E)。
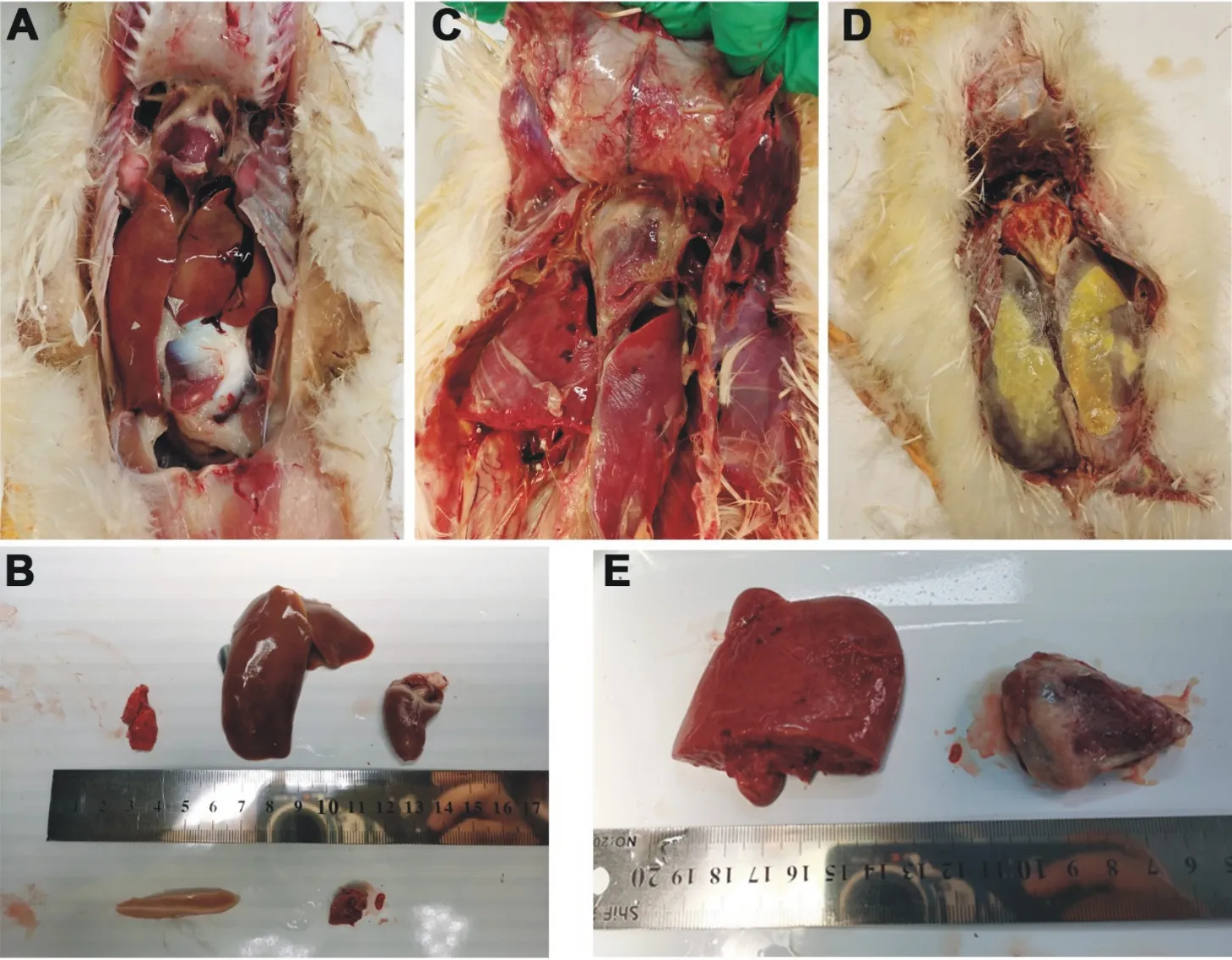
A.病危雏鸭胸腔和腹腔脏器;B.病危雏鸭各主要脏器;C.病死雏鸭胸腔和腹腔脏器;D.病死雏鸭大量纤维素渗出;E.病死雏鸭肝脏和心脏
2.3 送检雏鸭常见病原的PCR检测
为了确定送检雏鸭是否感染了常见的病毒,采集10只送检雏鸭部分组织脏器,分别提取DNA和RNA,以提取的DNA和反转录获得的cDNA为模板,分别PCR检测鸭8种常见病原,结果显示,在所有10只雏鸭组织中均未获得DTMUV、FAdV Ⅰ、FAdV Ⅱ、DHAV、MDPV和AIV H9等病毒以及RA的特异性扩增条带,而10只雏鸭组织中均检测到大小为250 bp的E.coli阳性条带(图3)。

M.DNA 标准DL 5 000;1~10.雏鸭样品;NC.阴性对照
2.4 送检雏鸭渗出物细菌培养鉴定
将10只送检雏鸭的肝脏表面和心包渗出物分别接种LB培养平板和TSA/巧克力培养平板,37 ℃培养过夜后,在LB培养平板上生长有多量圆形、光滑、半透明灰白色菌落,在TSA/巧克力培养平板生长有较少表面光滑、圆形半透明的菌落。从LB培养平板随机挑取10个菌落后,利用细菌16S rRNA基因通用引物进行PCR(图4),测序结果经NCBI Blast分析,与E.coli参考菌株的基因序列同源性均达到99%以上。

M.DNA 标准DL 5 000;1~10.菌落
2.5 药敏试验结果
药敏试验结果见表2。本试验分离的E.coli对氨苄西林、阿莫西林、新霉素、红霉素、氟苯尼考、恩诺沙星、多黏菌素B和复方新诺明等药物耐药,而对庆大霉素、卡那霉素、阿奇霉素、头孢他啶、头孢氨苄、氧氟沙星和多西环素等药物敏感。

表2 鸭大肠埃希氏菌药敏试验结果
2.6 动物致病性试验
小鼠腹腔接种0.2 mL浓度为1×108CFU/mL的分离菌后,接种小鼠全部死亡,分离培养小鼠肝脏病菌,发现与病死鸭分离的E.coli形态和培养特性一致,PCR鉴定为E.coli。空白对照组小鼠全部存活。
3 讨论
规模化鸭场由于养殖密度大、鸭群生活环境潮湿、鸭舍卫生情况不达标等原因,常见多种病原感染,包括细菌性病原E.coli和RA[1-2],病毒性病原DTMUV、FAdV Ⅰ、FAdV Ⅱ、DHAV、MDPV和AIV H9等[3-8],这些病原往往混合感染,使患病鸭在临床上表现出复杂的症状和病理变化,给疫病的诊断带来一定的困难,造成更严重的损失。在本次北京鸭养殖场出现的病例中,我们首先通过组织PCR排除了病危雏鸭和病死雏鸭存在常见病毒的感染,推测其病变可能是由于E.coli或RA感染所致。
E.coli感染导致的鸭大肠杆菌病临床表现多种多样,有败血症、脐炎、呼吸道型、输卵管炎、腹水症、鼻窦炎、肿头和腹泻等,其中临床常见败血型鸭大肠杆菌病,患病鸭剖检可见明显的心包炎、肝周炎、腹膜炎、气囊炎,组织脏器周围可见明显的纤维素或干酪样渗出物,严重的呈现块状,可以从心血、肝脏、脾脏、脑等器官进行细菌分离[9]。但鸭大肠杆菌病的临床症状与鸭传染性浆膜炎有较高相似性,肉眼往往难以鉴别。鸭传染性浆膜炎是由RA感染导致的疾病,常表现为精神沉郁、厌食、头颈歪斜,有神经症状,病鸭眼眶和鼻孔周围有黏性分泌物,部分病鸭有呼吸道症状、咳嗽和打喷嚏等出现,粪便稀薄呈绿色或是黄绿色,典型病理变化为败血症,以及由于浆膜表面纤维素性渗出导致的心包炎和肝周炎等[10]。在本次北京鸭养殖场出现的雏鸭急性死亡病例中,基于临床症状和病理变化难以做出准确的诊断,还需要借助细菌分离培养鉴定和动物致病性试验进行鉴别诊断。本研究首先已通过PCR检测中发现,不论在病危雏鸭还是病死雏鸭组织样本中均能检测到E.coli。随后对雏鸭渗出物中的细菌进行分离培养鉴定,发现培养的菌落主要为E.coli,动物致病性试验也证实分离的E.coli能导致小鼠出现相同的症状。因此,对于这起雏鸭急性死亡病例的诊断结果为鸭大肠埃希氏菌感染所致。临床上对分离细菌主要使用抗菌药物进行治疗,但抗菌药物的广泛使用又造成了耐药菌株的出现[2,11]。本研究对分离的E.coli进行耐药性分析发现,分离的E.coli菌株主要对青霉素类、氨基糖苷类、大环内酯类、氯霉素类、多肽类和磺胺类抗菌药物耐药,而对头孢类和四环素类抗菌药物较敏感,为本次疫情的临床合理用药提供了依据。
在北京鸭的养殖过程中,常常因多种病原的混合感染导致出现各种类型的疾病,且这些疾病的临床症状和病理变化相似性较高,往往需要结合实验室检测方能确诊,在本起疫情的诊断过程中,通过病理学检测方法和病原学检测方法,最终确定了为鸭大肠埃希氏菌感染所致,且分离的鸭大肠埃希氏菌具有一定的耐药性,诊断结果为陕西省韩城市北京鸭养殖场的疫病防控提供了指导,为企业减少损失提供了技术支撑。
