淫羊藿多糖和板蓝根多糖的提取和初步鉴定
2022-12-07李秀萍王春雨刘德稳吴秀芬李卫东李冬梅于运峰胡元亮
李秀萍,王春雨,唐 艳,刘德稳,高 晨,吴秀芬,李卫东,李冬梅,于运峰,胡元亮
(1.德州学院生态与资源环境学院,山东德州 253000;2.南京农业大学动物医学院,江苏南京 210095)
淫羊藿又名三枝九叶草,为小檗科植物柔毛淫羊藿、箭叶淫羊藿或心叶淫羊藿的干燥地上部分,味辛、甘,性温,入肝、肾经,有强筋骨、祛风湿、温肾壮阳的功效。临床主治母畜不发情、寒湿痹痛等。淫羊藿的主要成分有黄酮、多糖、生物碱、蒽醌类、萜类、微量元素等,多糖作为其主要有效成分之一,因为其广阔而显著的药用价值成为现代医学研究的热点。近年来研究发现淫羊藿多糖具有抗病毒、调节免疫活性、抗氧化等生物活性[1]。
板蓝根为十字花科植物菘蓝的干燥根,始载于《神农本草经》,有清热解毒、凉血利咽等功能,临床上常用于病毒及细菌感染性疾病[2-3]。近年来,随着人们对多糖生物活性和特殊药用功能认识的进一步加深,板蓝根多糖被认为是板蓝根生物活性和特殊药用功能的主要作用因子之一。因此,关于板蓝根多糖的研究越来越引起研究人员的重视。
本试验在之前研究的基础上[4-5],用水煎醇沉法提取淫羊藿多糖和板蓝根多糖,Sevag法除蛋白后用DEAE-52柱层析分离,得到初步纯化的淫羊藿多糖(Epimediumpolysaccharides,EPS1和 EPS2)和板蓝根多糖(Isatisroot polysaccharides,IRPS1和IRPS2),并对淫羊藿多糖EPS1和板蓝根多糖IRPS1进行了沉淀溶解试验和红外光谱鉴定,旨在初步探讨这两种多糖的制备和理化性质,为进一步研究提供参考。
1 材料与方法
1.1 材料
1.1.1 试验用药物 淫羊藿饮片和板蓝根饮片,购自南京金陵大药房。淫羊藿饮片,安徽济人有限公司产品,批号12067;板蓝根饮片,徐州彭祖中药饮片公司产品,批号12067。
1.1.2 主要试剂 D(+)-葡萄糖,分析纯,中国惠兴生化试剂有限公司产品;苯酚,国药集团化学试剂有限公司产品;无水乙醇、丙酮、乙醚、浓硫酸、盐酸、氯化钠、氢氧化钠、氯仿、正丁醇均为分析纯,上海试剂一厂产品。
1.1.3 主要仪器 FA1104N型电子天平、754型紫外分光光度计,上海精密科学仪器有限公司产品;真空干燥箱,上海精宏试验设备有限公司产品;L-550型离心机,湖南湘仪试验仪器开发有限公司产品;RE-52A型旋转蒸发仪、SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂产品;101A-1E型电热鼓风干燥箱,层析柱(2 cm×80 cm),上海试验仪器有限公司产品;BA-100A型自动部分收集器、HL-2B型数显恒流泵、TH-1000型梯度混合器,上海沪西分析仪器有限公司产品;Scietz-12N型冷冻干燥机,宁波新芝生物科技股份有限公司产品;75-2A型微量振荡器,上海医用分析仪器厂产品;透析袋,上海绿鸟科技发展有限公司产品;DEAE-52柱层析填料,Whatman进口分装产品。
1.2 方法
1.2.1 淫羊藿多糖和板蓝根多糖的提取 称取淫羊藿2 kg,加950 mL/L乙醇蒸馏30 min,加20倍水武火煮沸,文火维持1 h,煎煮2次,合并滤液浓缩至2 000 mL。室温缓慢加乙醇至80%,静置24 h,取沉淀加蒸馏水2 000 mL溶解,静置过夜,取上清加乙醇至80%,静置24 h,取沉淀真空干燥,得淫羊藿粗多糖(grossEpimediumpolysaccharide,EPSg),称重,计算多糖提取率。
多糖提取率(%)=多糖质量(g)/淫羊藿饮片质量(g)×100%。
取板蓝根2 kg,加950 mL/L乙醇蒸馏3次,晾干,加10倍水浸泡2 h,煮沸,以下提取同上,得板蓝根粗多糖(grossIsatisroot polysaccharide IRPSg),称重,计算多糖提取率。
多糖提取率(%)= 多糖质量(g)/板蓝根饮片质量(g)×100%。
1.2.2 淫羊藿多糖和板蓝根多糖的分离 Sevag法去蛋白:将上述所得2种多糖加适量蒸馏水60 ℃水浴使完全溶解,加入1/5体积氯仿,1/25体积正丁醇,振摇20 min,3 500 r/min离心20 min,取水相重复上述操作7次~8次,旋转蒸发仪浓缩,冷冻干燥,得去蛋白多糖。
DEAE-52纤维素离子交换层析:将处理后的DEAE-52 纤维素装柱(1.6 cm×50 cm),取去蛋白多糖加蒸馏水溶解成100 mg/mL,离心,取上清液50 mL上柱,淫羊藿多糖以0.1 mol/L NaCl、0.4 mol/L NaCl溶液洗脱,板蓝根多糖以蒸馏水、0.1 mol/L NaCl溶液洗脱,控制洗脱速度为1 mL/min,分管收集,每管5 mL,用苯酚-硫酸法检测至无糖检出。以洗脱管数为横坐标,吸光值为纵坐标绘制洗脱曲线。合并单一峰洗脱液,浓缩、冷冻干燥,得初步纯化的淫羊藿多糖(EPS1和EPS2)和板蓝根多糖(IRPS1和IRPS2)。
1.2.3 淫羊藿多糖和板蓝根多糖的鉴定
1.2.3.1 糖含量测定 用改良的硫酸-苯酚法。
标准曲线的绘制:精密称取105 ℃干燥至恒重的葡萄糖25 mg,加适量蒸馏水溶解并定容至50 mL,作为对照品溶液。精密量取对照品溶液1.0、2.0、3.0、4.0、5.0 mL,分别置50 mL容量瓶中,加水至刻度,摇匀。精密量取上述各溶液2 mL,置具塞试管中,分别加50 mL/L苯酚溶液1.0 mL,摇匀,迅速滴加浓H2SO45.0 mL,摇匀,在沸水浴中保温15 min,取出冷却至室温,以相应试剂为空白,用分光光度仪测定490 nm处的吸光度值。以对照品浓度(x)为横坐标,吸光度(y)为纵坐标,绘制标准曲线,得回归方程(y=Ax+b)和R2值。
样品含量测定:将待测样品经105 ℃干燥至恒重,精密称取10 mg加适量蒸馏水溶解并定容至50 mL,精密量取2 mL置具塞试管中,按标准曲线的操作方法测定各样品吸光度y值,将平均y值求数后代入回归方程,计算多糖含量
1.2.3.2 沉淀溶解试验 分别取淫羊藿多糖EPS1 pH为9的收集液和板蓝根多糖IRPS1 pH为10的收集液各10 mL,分别用50 mL/L盐酸滴定,待沉淀完全再用20 mg/mL NaOH溶液回滴,观察溶解情况。
1.2.3.3 红外光谱测定 取适量KBr初步研磨后,其放在紫外灯下烘干1 h~2 h,加适量多糖混匀,研磨成极其细小的粉粒,做成透明均匀的压片,用Nicolet FT-IR200型傅里叶变换红外光谱仪记录4 000/cm~400/cm范围内的红外光谱[6-7]。
2 结果
2.1 淫羊藿多糖和板蓝根多糖的提取和分离
2种多糖的得率、糖含量见表1。淫羊藿2 kg经水煎醇沉法获得淫羊藿粗多糖EPSg 84.69 g,得率为4.24%,糖含量为21.35%;DEAE-52纤维素层析洗脱得到2个峰(图1),分别收集2个峰得到2个纯化的淫羊藿多糖EPS1和EPS2,其多糖含量分别为53.1%和37.34%。标准曲线的回归方程为y=15.28x+0.017 2,R2=0.999 3。

图1 淫羊藿多糖的DEAE-52纤维素离子交换洗脱曲线

表1 两种多糖的得率和糖含量
板蓝根饮片2 kg经水煎醇沉法获得板蓝根粗多糖IRPSg 104.76 g,得率为5.24%,糖含量为34.76%;DEAE-52纤维素柱层析洗脱得到2个峰(图2),分别收集2个峰得到2个纯化的板蓝根多糖IRPS1、IRPS2,其多糖含量分别为97.92%和30.85%。
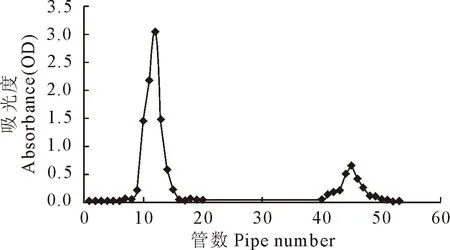
图2 板蓝根多糖的DEAE-52纤维素离子交换洗脱曲线
2.2 淫羊藿多糖和板蓝根多糖的沉淀溶解差异
分别取收集液淫羊藿多糖EPS1和收集液板蓝根多糖IRPS1各10 mL,用50 mL/L盐酸滴定,收集液淫羊藿多糖EPS1出现颗粒状沉淀,收集液板蓝根多糖IRPS1出现絮状沉淀;用20 mg/mL NaOH溶液回滴,EPS1的颗粒状沉淀不溶解,IRPS1的絮状沉淀可以溶解。结果表明,EPS1与IRPS1的理化性质不同。
2.3 淫羊藿多糖和板蓝根多糖的红外光谱
EPS1和IRPS1的红外光谱见图3和图4,2种糖的红外光谱显示一些糖的特征性振动峰:EPS1在3 387.74/cm、IRPS1在3 363.16/cm处有一强且宽的吸收峰,为O-H键的伸缩振动;EPS1在1 642.52/cm、IRPS1在1 637.89/cm处有一吸收峰,为-C=O的伸缩振动;在1 400/cm~1 000/cm处为C-H、C-O和C-C振动吸收峰。
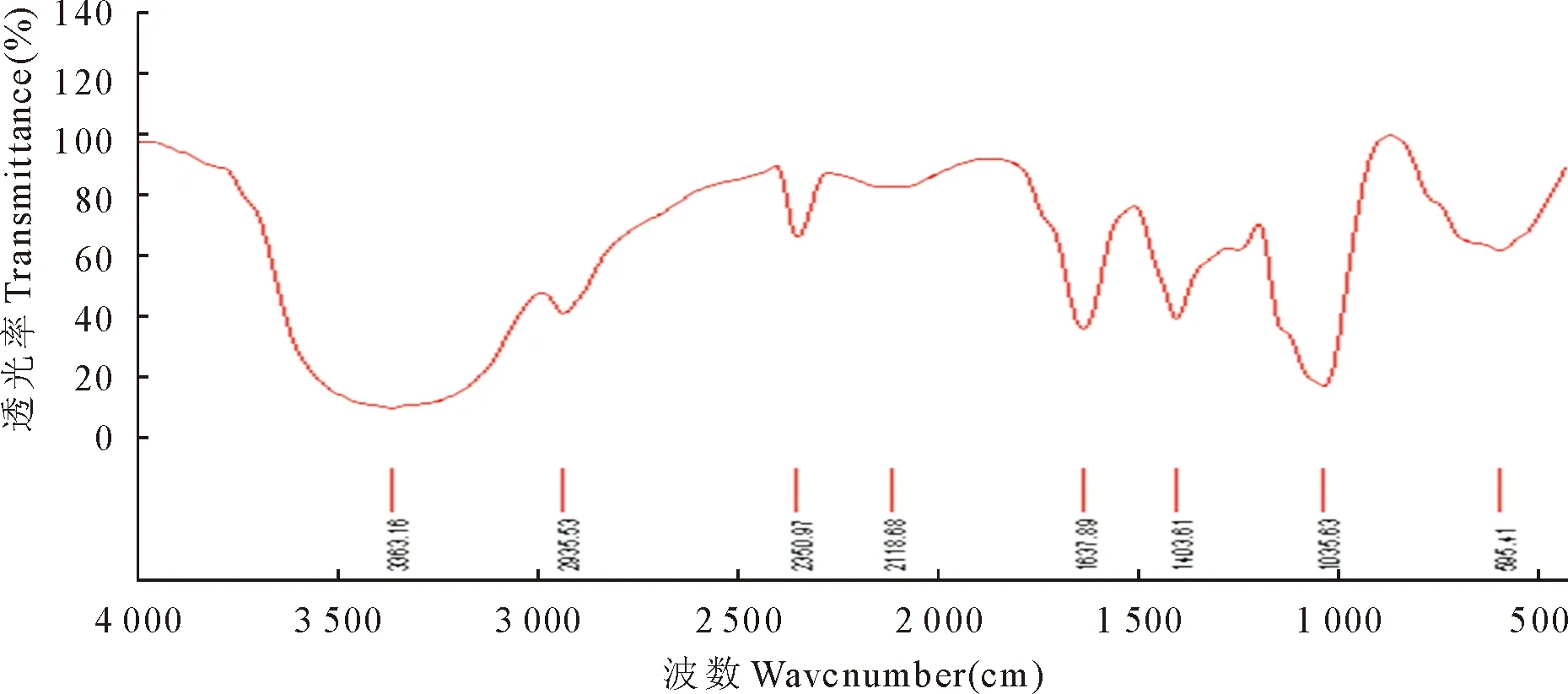
图4 IRPS1的红外光谱
3 讨论
考虑到糖苷键的理化性质,多糖的提取过程应避免过热、酸、碱等因素以及避免浸提过程中染菌。经乙醇沉淀后可得到粗多糖,为得到更纯的多糖,需再脱色和脱蛋白处理,脱蛋白方法常用Sevag法或蛋白酶法等[8],本试验采用了对多糖组成成分影响较小的Sevag法。在提取分离过程中,根据不同的原料,选择浸提工艺和技术参数也不相同,本试验中,淫羊藿和板蓝根都采用了2次浸提,淫羊藿因含色素在提取前需进行脱色处理,板蓝根因脂类成分较多则需进行脱脂处理。淫羊藿2 kg经水煎醇沉法获得淫羊藿粗多糖EPSg 84.69 g,得率为4.24%,多糖含量为21.35%;Sevag法去蛋白、DEAE-52纤维素离子交换层析后,得到2个纯化的淫羊藿多糖EPS1、EPS2,其多糖含量分别为53.1%和37.34%。板蓝根饮片2 kg经水煎醇沉法获得板蓝根粗多糖IRPSg 104.76 g,得率为5.24%;板蓝根粗多糖IRPSg的多糖含量为34.76%;Sevag法去蛋白、DEAE-52纤维素离子交换层析后,得到2个纯化的板蓝根多糖IRPS1、IRPS2,其多糖含量分别为97.92%和30.85%。初步纯化后,IRPS1的得率1.98%大于EPS1得率1.53%;IRPS1多糖的含量97.92%大于EPS1多糖含量53.1%。
离子交换层析法是通过载体表面带电基团与样品离子和洗脱液所带电荷离子进行可逆交换、离子偶极作用和离子吸附实现分离的。不同多糖尤其是多糖与蛋白质结合的复合多糖,采用不同盐浓度的洗脱液洗脱,根据多糖所带电荷的差异而达到分离的目的[9]。本试验中酸性淫羊藿多糖与阴离子交换剂DEAE-52纤维素的结合更为牢固,板蓝根多糖更容易被洗脱。淫羊藿多糖我们以0.1 mol/L、0.4 mol/L NaCl溶液洗脱,板蓝根多糖以蒸馏水、0.1 mol/L NaCl溶液洗脱。用0.1 mol/L NaCl溶液洗脱,得到的淫羊藿多糖EPS1吸光度最高,为1.6;在其他条件相同的条件下,用蒸馏水洗脱,板蓝根多糖IRPS1吸光度最高,为3。
糖的红外光谱显示,EPS1和IRPS1均具有3 600/cm~3 000/cm、3 000/cm~2 800/cm、1 400/cm~1 200/cm多糖特征吸收峰。3 300/cm和2 900/cm左右的特征吸收峰分别是由-OH和-CH2基团中C-H的伸缩振动引起的[10]。EPS1中吡喃环的C-O-C的伸缩振动使红外图谱出现1 150.24/cm的特征吸收峰[11]。1 025.51/cm吸收峰的存在说明多糖含有吡喃糖环内酯键。EPS1中852.40/cm特征吸收峰说明EPS1中存在α-糖苷键。1 404.68/cm处的特征吸收峰是-COOH中的COO-伸缩振动引起的;-COOH中-OH的伸缩振动引起1 243.84/cm处的特征吸收峰[12],此结果与酸性多糖结果一致[13]。在IRPS1中,1 035.63/cm处的强吸收峰证明单糖以吡喃糖苷的形式存在,在1 637.89/cm处吸收峰是C=O的非对角伸缩振动吸收引起,在1 230/cm处没有中强吸收峰,即没有S=O对称伸缩振动的特征峰,表明组分IRPS1中不含糖醛酸[14]。
淫羊藿多糖与板蓝根多糖的组成和理化性质不完全相同。
