达氟沙星多克隆抗体制备及间接竞争ELISA方法的建立
2022-12-07张欣欣齐永华路少鹏李文明郭东光潘鹏涛王选年
张欣欣,齐永华,岳 锋,路少鹏,李文明,郭东光,潘鹏涛,王选年*
(1.新乡学院动物疫病分子诊断河南省工程实验室,河南新乡 453000;2.郑州大学,河南郑州 450000)
达氟沙星(danofloxacin,DAN)为第三代氟喹诺酮类动物专用药物,分子式为C19H20FN3O3[1],分子质量为357.38 u。市售产品多为甲磺酸达氟沙星,白色至淡黄色结晶性粉末,无臭、易溶于水、微溶于甲醇,几乎不溶于氯仿。达氟沙星为广谱抗菌药物,对巴氏杆菌、支原体、大肠埃希氏菌均具有较强的抗菌活性[2];但不合理使用或滥用直接导致动物性食品中DAN的残留,严重威胁人类健康,给监管工作带来了极大的挑战。
目前检测达氟沙星药物残留的方法主要有理化检测法(包括高效液相色谱法、液相色谱质谱联用法等)、微生物检测法、免疫分析检测法(包括酶联免疫吸附法、电化学酶联免疫法)等。理化检测法结果准确、可靠,可以作为标准方法,但仪器设备昂贵,样品前处理复杂,不能满足现场快速检测的要求;微生物检测法灵敏度不高;免疫分析检测方法则克服了以上方法的缺点,凭借其快速、高效、灵敏、稳定的优势在兽药残留检测领域得到了快速的发展[3]。
目前报道的检测DAN残留的ELISA方法有直接法、间接法和双抗夹心法。直接法是将抗原直接包被到固相载体上,孵育洗涤后加入酶标抗体与抗原反应。间接法是目前检测中应用最多的一种方法。将待检测样品直接吸附到固相载体上,洗涤除去未结合的抗原及杂质,用无关蛋白封闭,洗涤后加入特异性抗体与固相抗原结合,再加酶标二抗,最后加底物显色,颜色的深浅与待测抗原的量成正比。双抗体夹心法是将特异性抗体先吸附到固相载体上,封闭后加含有待测抗原的样品,形成固相抗体抗原复合物,然后加酶标抗体,加底物显色,根据颜色的深浅进行抗原的定性或定量。而ic-ELISA方法是包被抗原,将待测抗原与特异性抗体一起加入,接着加酶标二抗,最后加底物显色。在ic-ELISA方法中,待测抗原与固相抗原一起竞争相同的有限抗体,当样品中游离的抗原越多,结合的抗体就越多,而固相抗原只能结合较少的抗体,反之亦然。因此,ic-ELISA方法具有更高的灵敏性[4]。
因此,本研究合成了达氟沙星完全抗原,制备出针对DAN特异性强、灵敏度高的多克隆抗体,并以此多克隆抗体为核心试剂成功建立了检测DAN的间接竞争ELISA(ic-ELISA)方法,为进一步开发快速检测DAN试剂盒奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 达氟沙星、诺氟沙星(norfloxacin,NOR)、氧氟沙星(ofloxacin,OFL)、环丙沙星(ciprofloxacin,CIP)、恩诺沙星(enrofloxacin,ENR)、二氟沙星(difloxacin,DIF)、培氟沙星(pefloxacin,PEF)、洛美沙星(lomefloxacin,LOM)、沙拉沙星(sarafloxacin,SAR)标准品,浙江国邦药业有限公司产品;牛血清白蛋白(bovine albumin,BSA)、鸡卵清白蛋白(ovalbumin,OVA)、弗氏完全佐剂(Freund's complete adjuvant,FCA)、弗氏不完全佐剂(Freund's incomplete adjuvant,FIA),美国Sigma公司产品。
1.1.2 实验动物 新西兰大白兔,由河南省动物实验中心提供。
1.1.3 主要仪器 多功能酶标仪(Enspire),美国Bio-Rad公司产品;加热磁力搅拌器(CMAGHS4),德国IKA公司产品;紫外可见分光光度计(UV-3010),日本Hitachi公司产品。
1.2 方法
1.2.1 DAN完全抗原的制备 采用混合酸酐法制备DAN完全抗原。称取10 mg DAN充分溶于混合溶剂(二氧六环、DMF、三乙胺的摩尔比为3∶3∶0.1)中,冰浴搅拌30 min,之后滴加5 μL氯甲酸异丁酯冰浴搅拌2 h,此反应液为A液[5];称取20 mg BSA或18 mg OVA充分溶于2 mL 浓度为0.1 mol/L的PBS(pH7.4)中,此反应液为B液;磁力搅拌下,将A液缓慢加入B液中,4 ℃条件下反应12 h;反应好的混合物装入处理好的透析袋中,4 ℃条件下用PBS透析3 d,每天更换3次透析液[6];透析结束,5 000 r/min离心10 min,上清即为完全抗原;将制备好的完全抗原分装于1.5 mL EP管中,置-20 ℃保存备用。
1.2.2 完全抗原的聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定 使用Bradford检测试剂盒测定完全抗原DAN-BSA和DAN-OVA的浓度,将完全抗原及载体蛋白等量上样进行SDS-PAGE鉴定;
1.2.3 完全抗原紫外光谱扫描鉴定 在200 nm~400 nm间分别对载体蛋白、半抗原、完全抗原进行紫外吸收光谱测定,确证半抗原与BSA或OVA是否偶联成功。
1.2.4 动物免疫 用上述制备的完全抗原DAN-BSA免疫2.0 kg~2.5 kg的雌性新西兰大白兔,首次免疫注射时,取 1 mg/mL的免疫原500 μL,与等量的弗氏完全佐剂充分乳化,皮下多点注射。间隔半个月后,取相同剂量的DAN-BSA,与等量的不完全佐剂乳化,同样方法二次免疫。每隔2周免疫1次,4免后10 d耳缘静脉采血,检测抗血清效价,15 d后心脏大量采血,分离血清,置-20 ℃保存备用。
1.2.5 ic-ELISA的建立
1.2.5.1 ic-ELISA基本步骤
(1)包被:使用包被液将包被原DAN-OVA稀释到合适浓度,100 μL/孔加入酶标板孔中,4 ℃包被过夜。
(2)封闭:将过夜包被的酶标板用PBST清洗5次,拍干,每孔加入含50 mg/mL脱脂奶粉的PBST溶液200 μL,37 ℃封闭 2 h;将封闭好的酶标板用PBST清洗5次,拍干。
(3)竞争反应:将1 mg/mL的DAN标准品用含有50 mg/mL脱脂奶粉的PBST溶液稀释成系列浓度,加入到已固定好抗原的酶标板中,每孔50 μL,振荡混匀;接着向每孔中加入50 μL稀释至合适浓度的抗体,37 ℃孵育 40 min;反应结束后,PBST清洗5次,拍干[7]。
(4)加酶标二抗:用PBST-50 mg/mL脱脂奶粉将酶标二抗(羊抗兔IgG-HRP)稀释成合适的浓度,每孔加入100 μL,37 ℃孵育30 min;反应结束后,洗板5次,拍干。
(5)显色:每孔加入100 μL TMB显色液,37 ℃显色 10 min,之后每孔加入50 μL 终止液(2 mol/L H2SO4)。
(6)测定:用酶标仪测定各孔450 nm处的吸光值。
(7)计算:使用Origin 9.0对数据进行拟合处理,以标准品浓度的对数值为横坐标,OD 450 nm值为纵坐标绘制曲线,计算各曲线的最大吸光值(maximum absorbance,Amax)和半数抑制浓度(half inhibitory concentration,IC50)。综合考虑 Amax、IC50以及Amax/IC50,确定ic-ELISA的最佳反应条件。Amax/IC50值越大,说明方法的灵敏度越高[8]。
1.2.5.2 ic-ELISA条件的优化 参照文献[9]进行。
(1)最佳包被原浓度和抗体稀释倍数的的确定:通过棋盘法确定包被原的合适浓度和抗体稀释倍数。将包被原稀释成不同的浓度包被于酶标板上,抗体进行倍比稀释,按照步骤1.2.5.1测定在0 μg/mL和0.5 μg/mL DAN标准品存在下OD 450 nm值处的吸光值;选择0 μg/mL DAN存在下OD 450 nm值在1.0~1.5之间及0.5 μg/mL DAN存在下OD 450 nm值在0.2~0.3之间的包被原浓度和抗体稀释倍数为最佳组合。
(2)最佳标准品稀释液的确定:在上述最佳反应条件下,分别用 PBS、PBST、PBST-50 mg/mL脱脂奶粉稀释标准品,按步骤1.2.5.1 测定,比较不同药物稀释液下的Amax和IC50及其比值,确定最佳的标准品稀释液。
(3)最佳竞争反应时间的确定:在上述最佳反应条件下,选择不同的竞争反应时间,按步骤1.2.5.1测定,比较不同竞争反应时间下的Amax和IC50及其比值,确定最佳的竞争反应时间。
(4)最佳酶标二抗稀释倍数的确定:在上述最佳反应条件下,将二抗稀释成不同的浓度,按步骤1.2.5.1测定,比较不同浓度下的Amax和IC50及其比值,确定最佳的二抗稀释倍数。
(5)最佳酶标二抗反应时间的确定:在上述最佳反应条件下,选择不同的二抗反应时间,按步骤1.2.5.1测定,比较不同反应时间下的Amax和IC50及其比值,确定最佳的二抗反应时间。
1.2.5.3 ic-ELISA 标准曲线的建立 在上述优化好的反应条件下,按步骤1.2.5.1测定,以标准品浓度的对数值为横坐标,以抑制率B/B0(B:添加标准品的OD值;B0:不添加标准品的OD值)为纵坐标绘制标准曲线[10]。
1.2.6 方法特异性鉴定 在上述优化好的反应条件下,选取8种与待测物结构和功能相似的药物按步骤1.2.5.1测定其交叉反应率(CR)。交叉反应率(CR)%=IC50(标准品)/IC50(类似物)×100%。
1.2.7 灵敏度与稳定性试验 将标准品稀释成3个不同的浓度(0.04、0.4、4 μg/L),每个浓度重复测定3次,计算变异系数(CV)。变异系数(CV)%=标准差/平均值×100%。
1.2.8 回收率试验 DAN在生物体内主要通过肾脏代谢,故尿液中药物浓度较高。以猪尿作为稀释液,将DAN稀释成3种不同的浓度(0.04、0.4、4 μg/L),根据建立好的标准曲线进行回收试验,计算回收率。回收率%=实际测定的浓度/添加的浓度×100%[11]。
2 结果
2.1 完全抗原的鉴定
2.1.1 SDS-PAGE电泳鉴定DAN-BSA和DAN-OVA 在SDS-PAGE凝胶电泳中,样品的迁移率只与分子质量大小有关;从图 1和图2可以看出,偶联产物DAN-BSA和DAN-OVA迁移速度明显慢于BSA和OVA,表明偶联产物的分子质量大于载体蛋白,并且条带清晰,纯度比较高,证明完全抗原偶联成功。

M.蛋白分子质量标准;1.DAN-BSA;2.BSA
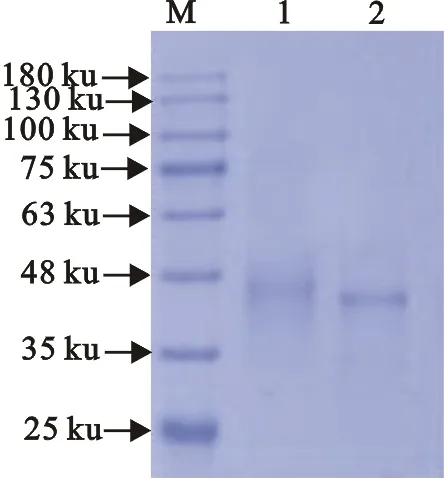
M.蛋白分子质量标准;1.DAN-OVA;2.OVA
2.1.2 紫外光谱扫描鉴定DAN-BSA和DAN-OVA 在200 nm~400 nm间分别对载体蛋白、半抗原、完全抗原进行紫外吸收光谱测定,结果如图3A和图3B所示。载体蛋白BSA和OVA在278 nm处出现了最高吸收峰,半抗原在272 nm处出现了最高吸收峰,而合成的完全抗原在新的波长处出现了最高吸收峰,表明完全抗原合成是成功的。

A.DAN-BSA;B.DAN-OVA
2.2 免疫血清的评价
在ELISA方法中,通常采用固定一定的包被原浓度(本文采用3 μg/mL)进行效价的测定,其450 nm处的吸光值在 1.0~1.5 时抗血清的稀释倍数即为抗血清的效价[9]。经测定,该血清的效价为1∶51 200。
2.3 ic-ELISA反应条件的优化
2.3.1 最佳包被原浓度和抗体稀释倍数的确定 合适的包被原浓度和抗体浓度有利于抗原抗体更好的反应;将包被原分别稀释成1、3、5、7 μg/mL,抗体按1∶1 600~1∶102 400进行倍比稀释;按照步骤1.2.5.1测定在0 μg/mL和0.5 μg/mL DAN标准品时OD 450 nm值;选择0 μg/mL DAN时OD 450 nm值在1.0~1.5之间和0.5 μg/mL DAN时OD 450 nm值在0.2~0.3之间的包被原浓度和抗体稀释倍数为最佳。经测定,最佳的包被原浓度为3 μg/mL,最佳的抗体稀释倍数为1∶25 600。
2.3.2 最佳标准品稀释液的确定 合适的药物稀释液有利于药物的分散,本研究比较了PBS、PBST、PBST-50 mg/mL脱脂奶粉3种溶液作为标准品稀释液对ic-ELISA方法灵敏度的影响。结果如图4所示,当用PBST-50 mg/mL脱脂奶粉作为稀释液时IC50最低,Amax/IC50值最大,因此,选择PBST-50 mg/mL脱脂奶粉为最佳的标准品稀释液。

图4 最佳标准品稀释液的确定
2.3.3 最佳竞争时间的确定 一般情况下抗原抗体的结合随着时间的延长反应会更充分,但当达到一定水平后,延长时间不仅不能够明显的提高检测方法的灵敏度,而且还会造成时间上的浪费。本研究比较了20、40、60、80 min 4个竞争时间对ic-ELISA方法灵敏度的影响,结果如图5所示,随着竞争反应时间的延长,Amax逐渐增大,IC50先减小后增大;当竞争时间为40 min时,IC50最低,且Amax/IC50值最大,故确定最佳的竞争反应时间为40 min。

图5 最佳竞争反应时间的确定
2.3.4 最佳酶标二抗稀释倍数的确定 抗原抗体的结合是一种动态平衡的过程,在一抗浓度确定的条件下,二抗也具有最佳的反应浓度。本研究比较了1∶3 000、1∶5 000、1∶7 000不同二抗稀释倍数对ic-ELISA方法灵敏度的影响。结果如图6所示,当二抗稀释倍数为1∶5 000时,IC50最低,且Amax/IC50值最大,故最佳的酶标二抗稀释倍数为1∶5 000。
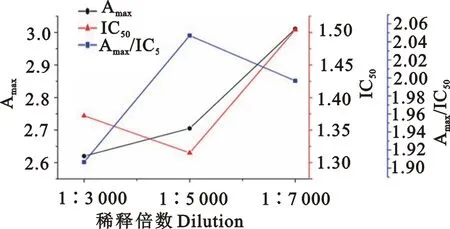
图6 最佳酶标二抗稀释倍数的确定
2.3.5 最佳酶标二抗反应时间的确定 二抗反应时间过长会导致非特异性结合增大,背景值偏高;本研究比较了20、30、40 min不同反应时间对ic-ELISA方法灵敏度的影响,结果如图7所示,随着二抗反应时间的延长,Amax逐渐增大,IC50先减小后增大;因为反应20 min时,二抗与固定在酶标板上的抗体结合不充分,而反应40 min又使得非特异性结合增大,导致IC50的增加,因此,确定的最佳二抗反应时间为30 min。

图7 最佳二抗反应时间的确定
2.4 ic-ELISA标准曲线的建立
综上所述,3 μg/mL为最佳的包被浓度,标准品用PBST-50 mg/mL脱脂奶粉稀释最好,最佳的竞争时间为40 min,酶标二抗按1∶5 000稀释时,抗原抗体作用30 min效果最好。在上述最优的反应条件下建立ic-ELISA标准曲线,以DAN标准品浓度的对数值为横坐标(x),吸光值B/B0为纵坐标(y),应用Origin 9.0软件建立竞争标准曲线。结果如图8所示,线性回归方程为y=36.85-39.21x,相关系数R2为0.98,IC50为0.39 μg/L,最低检测限为0.04 μg/L,线性范围IC20-IC80为0.09 μg/L~6.16 μg/L。

图8 ic-ELISA检测DAN标准曲线
2.5 ic-ELISA方法特异性分析
在上述最优的反应条件下,本研究选取了NOR、OFL、CIP、ENR、DIF、PEF、LOM、SAR 8种与DAN结构和功能相似的氟喹诺酮类药物按照步骤1.2.5.1进行交叉反应率检测。结果如表1所示,所建立的检测DAN的ic-ELISA方法特异性极好,与选取的8种相似物均没有交叉反应性。

表1 DAN抗血清与结构类似物的交叉反应率检测
2.6 重复性与稳定性分析
重复性与稳定性是保证残留检测准确度的先决条件,本研究中以样品测定值的CV来表示。将标准品稀释成3个不同的浓度(0.04、0.4、4 μg/L),每个浓度重复测定3次,3个标准品浓度所对应的CV分别为6.37%、7.61%、5.49%,其平均CV为6.49%,CV<10%,表明该方法重复性与稳定性较好。
2.7 猪尿中DAN回收率的测定
用猪尿将DAN稀释成3种不同的浓度(0.04、0.4、4 μg/L)根据建立好的标准曲线进行添加回收试验,将每个浓度反复测定3次,最终确定了猪尿中样品的平均回收率在92%~101%之间,证明了该检测方法适用于样品中DAN的检测。
3 讨论
3.1 完全抗原的合成及多克隆抗体的制备
强特异性抗体保证了免疫分析方法的顺利进行,但强特异性抗体的产生需要高质量的完全抗原。完全抗原的制备受多种因素的影响,如小分子本身结构需具有某些特征的基团,如含有苯环、杂环或含有分支结构等,否则难以刺激动物产生抗体或产生的抗体效价较低[12];同时应该尽可能保持半抗原原有的分子结构特征,使其暴露在人工抗原的表面,并能够最大限度的被免疫细胞识别,刺激机体产生特异性免疫应答,进而才能产生针对半抗原的高亲和力、高特异性抗体[13]。
达氟沙星是小分子物质,没有免疫原性,不能引起免疫应答,只有与载体偶联形成完全抗原后才能借助T细胞表位间接诱导B细胞进行增殖和分裂,进而产生特异性抗体。由于免疫系统一般对远离载体端的结构识别能力较强,对连接端的结构识别能力较弱,文献中通常选择远离待测物特征结构的官能团作为连接臂的结合位点[14]。达氟沙星自身结构带有活性基团羧基,本研究使用混合酸酐法制备了完全抗原。由于免疫原刺激机体产生抗体时,机体同时产生针对小分子半抗原和大分子蛋白表位的抗体,为了避免载体蛋白抗体的干扰,本研究在制备免疫原和包被原时选择了不同的载体蛋白,保证了检测方法的准确度和特异性。本研究结果显示,采用混合酸酐法成功制备完全抗原,用偶联成功的DAN-BSA免疫新西兰大白兔,用DAN-OVA检测免疫效果,四免后兔血清效价可达51 200。用该抗体构建的ic-ELISA检测方法的IC50为0.39 μg/L,且特异性极好,与NOR、OFL、CIP、ENR、DIF、PEF、LOM、SAR均无交叉反应。
目前多篇文献报道制备了抗DAN的单克隆抗体和多克隆抗体并建立了类似的检测方法。卢圣欣[6]采用碳二亚胺法制备完全抗原,成功获得了抗DAN的多克隆抗体,其IC50为2.0 μg/L,对氟罗沙星的交叉反应率为20.65%,对培氟沙星的交叉反应率为21.7%,对其他氟喹诺酮类交叉反应率小于0.5%;袁美芳[2]也采用碳二亚胺法制备完全抗原,成功获得了抗DAN的单克隆抗体,其IC50为0.129 μg/L,与环丙沙星、恩诺沙星、莫西沙星和沙拉沙星均有一定的交叉反应能力。经分析得出,单克隆抗体相比于多克隆抗体其灵敏度更好,相对稳定,但是制备周期长,过程复杂,容易造成污染。而多克隆抗体灵敏度虽略差,但其制备周期短,比单克隆抗体更能容许抗原中的微小变化。
3.2 ic-ELISA方法的优化
ic-ELISA方法的灵敏度和稳定性受包被原浓度、标准品稀释液、竞争反应时间等多种因素的影响,故优化反应条件是至关重要的。包被原浓度的高低直接影响了抗原抗体的反应,合适的稀释液有利于标准品的分散,反应时间长短决定抗原抗体是否充分结合[15];除此之外,二抗的稀释倍数和反应时间也会影响方法的灵敏性。邓丽华[9]报道,优化ic-ELISA方法时要综合考虑最大吸光值(Amax)、半数抑制浓度(IC50)及两者之间的比例(Amax/IC50)来确定最佳的反应条件;IC50越低,Amax/IC50越高对应的反应条件越佳。
本研究对包被原浓度、标准品稀释液、竞争反应时间、二抗稀释倍数及反应时间进行了优化,最终确定3 μg/mL为最佳的包被浓度,标准品用PBST-50 mg/mL脱脂奶粉稀释最好,最佳的竞争时间为40 min,酶标二抗按1∶5 000稀释时,抗原抗体作用30 min效果最好。最终在最佳反应条件下建立了检测DAN的ic-ELISA检测方法。
本研究成功制备了抗达氟沙星的多克隆抗体,利用该抗体建立了检测达氟沙星残留的ic-ELISA方法,其 IC50为0.39 μg/L,最低检测限为0.04 μg/L,检测范围为0.09 μg/L~6.16 μg/L,与NOR、OFL、CIP、ENR、DIF、PEF、LOM、SAR均无交叉反应。该方法特异性好,准确度高,为进一步研制达氟沙星免疫快速检测试剂盒奠定了基础。
