药物相关性颌骨坏死不同阶段治疗方法述评
2022-06-29孙国文
孙国文, 田 美
(南京大学医学院附属口腔医院,南京市口腔医院口腔颌面外科,江苏 南京 210008)
药物相关性颌骨坏死(MRONJ)是指一种特异性的颌骨严重并发症,常出现于使用了抗骨质吸收类药物(如双膦酸盐、地诺单抗)、抗血管生成类药物(如贝伐单抗、阿柏西普)、酪氨酸激酶抑制剂(如舒尼替尼、索拉非尼)及哺乳动物雷帕霉素靶向基因抑制剂(如依维莫司、西罗莫司)等药物后。 自Marx[1]在2003 年首次报道MRONJ 以来,越来越多的文献报道了各种不同的治疗方法,主要包括应用抗生素、漱口水、激光等保守治疗方法,软组织清创、刮治术、死骨摘除术等保守性手术治疗方法,以及大范围切除或完全切除等彻底性手术治疗方法。然而目前没有标准的治疗方案, 这可能是由于MRONJ 的发病机制尚不清楚, 治疗策略主要基于临床经验而不是科学数据来构建的。 目前发表的专家共识和临床指南[2-5]指出,对MRONJ 进行适当的分期有助于临床医生为患者提供最佳的治疗方案,最常用的分期系统及相应的治疗方案见表1。 该指南的主体思想为早期给予保守治疗,晚期予以手术治疗,虽然这一观点被临床医生广为接受,但是每个阶段具体的治疗方法仍有很大争议。 因此,本文总结了近年的参考文献并结合了笔者的临床经验,对不同阶段MRONJ 的具体治疗方法进行述评,以期为临床工作者提供参考。

表1 美国口腔颌面外科协会(American Association of Oral and Maxillofacial Surgeons, AAOMS)关于MRONJ 的分期及相应治疗方案Table 1 Stages and corresponding treatment plans of MRONJ of American Association of Oral and Maxillofacial Surgeons (AAOMS)
1 有MRONJ 的危险倾向
应告知口服或静脉注射相关药物的患者MRONJ 的潜在风险和保持良好口腔卫生的重要性,并根据每个患者的危险因素定期对患者进行口腔检查。 对低风险(口服药物、口腔健康状况良好)患者安排每年复查,高风险(静脉注射药物、有局部危险因素)的患者每3~6 个月进行1 次检查[6]。 检查的内容包括是否存在骨坏死的迹象和MRONJ 的危险因素。
口内已有的炎症性疾病是公认的危险因素。 因此,若此阶段发现患者有牙周炎,应对患者进行牙周治疗以预防和降低MRONJ 的风险, 牙周治疗主要包括牙周袋探诊、龈上洁治术、龈下刮治术和根面平整术[2,7]。 牙周手术被认为是一个危险因素,应当避免[8]。 有根尖周炎的牙齿应立即行根管治疗术[9],但应避免根尖切除术,因根尖切除术也被认为是MRONJ 的危险因素[10]。 拔牙被证实是严重的的危险因素之一,因此,不可修复的牙齿建议通过移除牙冠和对剩余牙根进行根管治疗的方式来保留[2-3]。 然而近期也有文章指出, 在拔牙前停止抗骨吸收治疗、围手术期使用抗菌药物的牙拔除术可以尽早终止患牙周围的炎症状态, 避免MRONJ 的发生[11-12]。拔牙时应进行适当的牙槽骨修整,避免形成锐利的牙槽骨边缘,并严密、无张力地关闭黏膜创口,甚至不需要停止抗骨吸收药物的治疗[13]。 不合适的义齿造成的黏膜损伤也是MRONJ 的危险因素之一,即使患者没有主诉与义齿相关的不适,也应该检查和评估局部可摘义齿和全口义齿的稳定与固位[3,14]。
2 MRONJ 0 期
对于MRONJ 0 期的界定一直是学术界较有争议的问题。 AAOMS[2]、癌症支持疗法多国学会、国际口腔肿瘤学会、美国临床肿瘤协会[3]、日本颌骨坏死联合委员会[7]、韩国骨骼矿物研究学会及韩国口腔颌面外科学会[10]在分期系统中纳入了0 期。 但是颌骨坏死国际研究小组[15]考虑到过度诊断的风险,没有将其纳入分期。 据报道,仅50%的0 期病变可能会进一步发展为1、2、3 期,而有些使用了抗骨吸收治疗药物的患者可能只是存在根尖周炎或牙周炎,若将其过度诊断为MRONJ 0 期并停用或调整抗骨吸收药物会影响骨相关疾病的治疗[4]。因此,应谨慎诊断0 期,并建议采用保守治疗的方法控制感染和疼痛。 同时,应密切监测以防止疾病进展。
3 MRONJ 1 期
3.1 保守治疗
对于MRONJ 1 期病变的治疗方式是最有争议的。 包括AAOMS 在内的学术组织持保守治疗的观点,他们认为早期手术治疗的成功率较低,可能和抗骨吸收类药物沉积在整个颌骨中,及术中无法定位坏死骨的切除边缘有关[3]。 因此,1 期的治疗重点不在于治愈,而在于控制症状和避免疾病进展[2,4]。
药物治疗是最主要的保守治疗方式,其中应用最广泛的是青霉素类药物(氨苄西林、阿莫西林),β-内酰胺酶抑制剂(克拉维酸、舒巴坦),甲硝唑或其组合[16]。氯己定是首选的局部抗菌药物。大多数文献没有明确说明抗生素的用量,使用时间也未达成共识, 但大多数作者都认同抗生素治疗应长期持续,直到相关的体征和症状缓解[17-19]。
激光具有调节细胞代谢、减轻疼痛和促进组织愈合的特性, 因而被单独或辅助用于早期MRONJ的治疗[20]。 其中使用最广泛的类型是低强度激光治疗(low level laser therapy,LLLT),它独特的生物效应能够诱导成骨细胞分化, 增加其数量和活性,促进新骨生成,同时抑制细菌生长,减轻炎症和感染[21]。 另外,Er∶YAG 激光也被报道用于早期的保守治疗,这是一种高功率的激光,对水和羟基磷灰石有亲和力,因此,其非常有利于烧灼特定的骨组织表面,并且对周围组织的损伤很小[22]。 然而,目前缺乏对激光类型、输出功率、应用时间等参数的一致性报道,且需要随机对照试验来进一步证实激光在早期治疗时的优势。
高压氧(hyperbaric oxygen,HBO)可以产生有益的氧梯度,增加活性氧和活性氮,从而影响破骨细胞的分化、活性并参与调节骨代谢。 基于这一特性,Freiberger 等[23]发表了应用HBO 治疗MRONJ 患者的系列病例, 发现62.5%的患者症状得到缓解。 然而, 他们的随机对照试验显示,HBO 组在软组织完全愈合方面与对照组没有显著差异[24]。 近期发表的综述也表明,应用HBO 的患者中仅有5.17%完全缓解,而大多数患者(48.27%)表现为轻微改善[25]。由此可见, 目前在MRONJ 的治疗中,HBO 主要作为手术外的辅助治疗手段,而非单独使用。
臭氧一般以由3 个氧原子组成的气体形式存在,通过刺激内源性抗氧化剂刺激细胞增殖,清除坏死骨组织,促进软组织愈合。 自从Agrillo 等[26]首次将臭氧应用于MRONJ 患者的治疗后, 越来越多的研究指出臭氧疗法可提高手术或药物治疗MRONJ 的疗效, 但臭氧疗法极少单独用于治疗MRONJ[25]。
最近,特立帕肽(甲状旁腺激素的同化剂)被报道用于治疗MRONJ。 这种化合物通过促进成骨细胞的增殖活化来激活骨重塑,增加骨形成。 Sim 等[27]纳入了34 例MRONJ 患者进行特立帕肽和安慰剂的随机对照试验,结果表明在第52 周时,特立帕肽组的病灶愈合率(45.4%)明显高于安慰剂组(33.3%),特立帕肽组患者的骨体积明显增加。 近期发表的综述表明, 在45.1%单独使用特立帕肽的病例中观察到坏死骨消退,1 期患者坏死骨消退的可能性是3 期患者的1.21 倍[28]。因此,特立帕肽应被视为MRONJ 1 期病变的有效治疗方式之一。
除此以外,己酮可可碱和α-生育酚因其具有降低血液黏稠度、 减少炎症反应的作用而作为MRONJ 早期阶段抗菌药物的辅助治疗[29]。应用香叶基香叶醇进行局部或全身治疗可提高成骨细胞、成纤维细胞和内皮细胞的活力和迁移能力, 并且在MRONJ 的1 期促进黏膜愈合[30]。
3.2 手术治疗
越来越多的研究显示, 对1 期的MRONJ 病变进行手术治疗的效果非常好,黏膜愈合率可达70%甚至以上[31]。 倾向于手术治疗的临床工作者认为,1 期病变的治疗目标是完全清除坏死骨、 促进黏膜完全愈合、临床无症状,以达到健康的生理状态[32]。所以对于1 期治疗方案,不同的选择可能是对治疗成功定义的不同所造成的。
早期手术治疗的主要好处是此时MRONJ 病变的坏死骨尺寸通常较小,因此手术创伤小,在完全去除坏死骨的同时,能够保证软组织的愈合,避免保守治疗失败导致病变的进展。 有报道称,经保守治疗的病变虽然黏膜情况得到了改善,但是黏膜下的坏死骨并没有恢复活力, 在40 例黏膜情况好转的1 期病变中有31 例最终发展为2 期(18 例)甚至3 期(13 例)[33]。另外,早期手术治疗能够在术中进行病理检查, 明确诊断并排除肿瘤骨转移等严重并发症。
早期的手术治疗主要是保守手术治疗,包括软组织清创、刮治术等。 软组织清创术是指去除表浅的坏死软组织,减少受影响的区域,减轻疼痛。 而刮治术相对来说更为彻底, 术中去除病变骨组织、肉芽组织和硬化骨质,但不进行扩大切除。 在关闭创口时,仅通过无张力地缝合而不调动皮瓣来保证手术部位黏膜的闭合。
4 MRONJ 2 期
AAMOS 等协会的共识和指南仍建议在2 期采用尽可能保守的治疗,将手术治疗作为减少坏死骨和感染的辅助手段。但是大量的临床研究表明,从2 期开始, 手术治疗的预后优于单纯保守治疗。 例如,Hayashida 等[34]报道了361 例处于2 期的MRONJ患者,其中采用手术治疗的患者有76.7%被治愈,而保守治疗的患者仅有25.2%被治愈。然而,由于缺乏保守手术和积极手术疗效的对比研究,手术治疗的范围和具体手术方式尚无定论。
根据笔者的经验,完全去除坏死骨组织、磨除锐利的骨边缘,并进行无张力地缝合能够获得较高的黏膜愈合率,如图1。如何鉴别坏死骨是临床上的挑战,通常我们在术前行螺旋CT 检查,评估病变的部位和范围。 术中根据骨的颜色、质地及是否有新鲜血液流出来判断切除的范围。 但是这种方法完全依赖医生的临床经验,主观性较强。 为了克服这一困难,自体荧光技术被引进并应用于MRONJ 手术,其显示出优于传统手术的疗效[35]。 四环素荧光技术也可辅助确定死骨的范围,并且与自体荧光相比也具有相当的成功率,但患者需在术前1 周口服四环素类药物[36]。 超声骨刀可以在不损伤软组织的情况下进行微创骨切割, 因此也被用于MRONJ 患者的手术治疗[37]。 最近有文章报道了在计算机导航下切除MRONJ 2 期病变的病例, 该方法能够提高手术的准确性和可靠性,减小额外的手术创伤[38]。
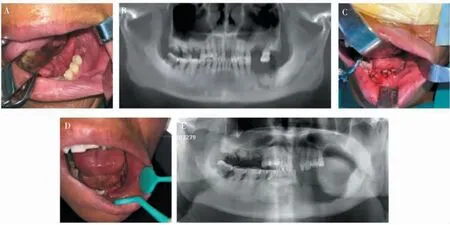
图1 左下颌骨2 期MRONJ 患者(63 岁男性)行颌骨部分切除术的术前和术后图像Figure 1 Images of a 63-year-old man with MRONJ stage 2 before and after partial resection of left mandible
在手术彻底清除坏死骨后,另一个挑战是对创口进行无张力的严密封闭,以最大限度地降低骨暴露和受微生物感染的风险。 临床上可使用局部组织瓣来关闭2 期病变的创口,主要有黏骨膜瓣、颊脂垫瓣、下颌舌骨肌瓣、鼻唇沟瓣等,其中黏骨膜瓣是最常规、最方便的组织瓣。 2 期MRONJ 病变周围黏膜未发生明显改变时可使用黏骨膜瓣;当病变范围较小时,可直接拉拢缝合病变两侧的黏骨膜瓣关闭创口;当创面比较大时需做辅助切口,切开骨膜,进行邻近瓣修复。 颊脂垫瓣被报道应用于较大MRONJ 的上颌病变,这种皮瓣的特点是简单、并发症低、机械稳定性好及血管成形良好。 此外,颊脂垫中的脂肪组织含有可以分化成不同细胞类型的干细胞,促进包括骨组织在内的组织愈合[39]。值得一提的是,3 期MRONJ 病变存在鼻窦和上颌窦受累时,颊脂垫瓣也被认为是关闭创口的优先选择[40]。 下颌的MRONJ 病变可使用下颌舌骨肌瓣来关闭创口,这是一种肌筋膜瓣, 尤其适用于下颌骨舌侧的病变。 下颌舌骨肌瓣和颊脂垫瓣都可以和局部黏骨膜瓣联合使用,对创口进行双层关闭[41]。鼻唇沟瓣属于带蒂皮瓣,用其可简单快速进行口内重建,因此也有学者将其用于MRONJ 的治疗。但是,由于鼻唇沟瓣体积较大且可能生长毛发, 有影响未来佩戴义齿的可能[42-43]。
在MRONJ 的手术治疗过程中, 还会应用一些额外的再生材料。目前,广泛用于MRONJ 的再生材料主要是自体血小板浓缩物 (autologous platelet concentrates, APC) 和骨形态发生蛋白 (bone morphogenetic protein, BMP)。
APC 富含多种生长因子,如血小板衍生生长因子、血小板源性生长因子、转化生长因子、血管内皮生长因子等。 因此,APC 具有刺激和加速组织愈合的作用。近期有研究报道,APC 凝块的pH 值可能不利于细菌的生长,因此其还有抗菌、抗感染的作用[44]。术前或术中收集患者自体的血液,离心处理后弃去上清液和底部的红细胞层,即可得到APC。 术中在去除所有病变组织后, 用注射器或移液器将APC 打在创口处,然后行无张力的关创。 目前临床上应用最多的是第一代APC, 即富血小板血浆(platelet-rich plasma, PRP)。 富 血 小 板 纤 维 蛋 白(platelet-rich fibrin, PRF)是第二代APC,它含有比PRP 多6 倍的生长因子,并且具有更长的释放时间(约1 周)[45]。 有研究表明,APC 中的浓缩生长因子(concentrated growth factors,CGF)可以释放长达13 d的生长因子,且呈均匀扩散趋势[46]。 因此,该APC 在生长因子保留和释放方面具有显著优势。
BMP 是一组属于转化生长因子TGF-β 超家族的信号分子,具有诱导成骨的能力,目前已被用于治疗MRONJ。 术中一般采用胶原蛋白海绵作为BMP 的载体,将其放置于清创后的患处。 一些研究表明,当这些海绵被应用于颌骨时,会产生快速的成骨过程[47]。 然而,BMP 可能导致一些显著的副作用,如肿胀、炎症、形成血清凝块和致癌性[48]。 因此,我们认为还需要进一步的研究来证明BMP 的有效性和安全性。
5 MRONJ 3 期
除了身体情况不佳、不能耐受手术的患者采用保守治疗的方式外,3 期病例基本都采用了手术治疗的方式,手术治疗包括保守手术治疗和彻底手术治疗,如死骨摘除术、颌骨部分切除术、下颌骨截骨术等。 Vanpoecke 等[49]对3 期病例的保守手术和彻底手术方法进行了文献回顾和对比,结果显示,广泛的骨切除至安全切缘取得了更好的治疗结果。Carlson[50]也强调了积极手术治疗的作用,并提出MRONJ 病灶的彻底消除只能通过广泛的手术措施来实现, 而骨刮除等保守手术治疗只能缓解症状,而不能真正治愈病灶。
笔者认为,3 期患者应该按照病变的部位进行不同的治疗。如图2 所示,3 期的下颌骨病变通常发展到了下颌骨下缘,进行下颌骨部分切除术或刮治术可能无法完全去除病变的骨质,而下颌骨节段性截骨术可以切除下颌骨的某一病变节段,中断其连续性,从而阻止病变的扩展[51]。术中尽量保留残留骨段的骨膜附着,不宜过度剥离,确保残留骨段有足够的血供。 术中确定手术切缘和应用再生材料的方法可参考2 期, 但术后的修复又出现了新的争议。当身体状况允许, 且病变组织已进行根治切除时,是否应该立即用游离皮瓣进行颌骨重建。 持反对观点的学者认为,多数MRONJ 患者有恶性肿瘤伴肺、骨转移,有的甚至表现为恶病质,长时间的手术风险大;供区骨存在肿瘤转移的可能,术前排查较为困难;抗骨吸收治疗可能导致供体部位骨质受损,血管密度下降,骨组织瓣容易发生坏死,因此建议仅进行钛板修复或不修复,如果不用钛板修复,可应用带翼导板维持咬合关系。 Sacco 等[52]对11 项3 期MRONJ 病变的手术方式进行了资料分析, 结果显示与微血管重建相比,下颌骨节段性截骨术的复发率明显更低、术后并发症更少,预后良好。 而持支持观点的临床工作者已经将腓骨游离皮瓣、血管化的髂骨瓣、肩胛游离皮瓣、前臂桡侧皮瓣、股前外侧皮瓣应用到了3 期MRONJ 病变的修复重建中[53-55],黏膜完全愈合率为75.0%~97.5%。 他们认为同期血管化修复重建可以更彻底地去除坏死骨和软组织,而不用担心骨不连和创口张力大。 另外,四肢骨和颅面骨胚胎来源不同,前者的骨髓间充质干细胞可能比后者具有更少的增殖和成骨能力,且更不容易受双膦酸盐类药物影响,所以供体区骨瓣并不容易坏死[54]。

图2 右下颌骨3 期MRONJ 患者(67 岁男性)行右下颌骨节段性截骨术的术前和术后图像Figure 2 Images of a 67-year-old man with MRONJ stage 3 before and after right mandibular segmental osteotomy
完全切除3 期上颌骨病变后,通常可以观察到上颌窦瘘。 采用颊脂垫瓣和黏骨膜瓣双层封闭创口可以取得良好的预后。 也有报道采用赝复体修复上颌缺损,可以改善口鼻漏、语音功能及美学效果[39]。但也有学者认为赝复体修复可能会增加MRONJ 复发的风险, 因为义齿创伤被认为是发病的一个重要促进因素。 笔者认为上颌骨的解剖形态特殊,且3 期病变可能会累及颧骨、上颌窦、鼻腔,彻底切除死骨损伤较大,出血较多,且难以确定手术边界。 本课题组研究发现,对于上颌骨3 期MRONJ 患者,仅采用死骨摘除的方式建立通畅的慢性引流通道,虽然局部可能仍有坏死骨, 但建立窦腔与口腔的通畅引流后有利于脓液和炎症引流, 并减少或消除死骨形成,从而快速消除临床症状,提高患者生命质量[51,56],尤其对一些全身情况欠佳的患者较为适用,如图3[56]。

图3 右上颌骨3 期MRONJ 患者(81 岁男性)行死骨摘除术的术前和术后图像Figure 3 Images of a 81-year-old man with MRONJ stage 3 before and after right maxillary sequestrectomy
综上所述,MRONJ 每个阶段的治疗策略仍没有形成普遍共识,且目前已有的一些结论很大程度上是基于低水平证据的研究。 本文对每个阶段的治疗方法进行了述评,结论为在早期阶段,非手术治疗和保守手术治疗似乎都是合适的选择,彻底的手术治疗适用于晚期的MRONJ 患者, 但是需要更多的研究来确定手术干预的确切时机和范围。 希望我们的研究可以为临床治疗提供参考,并激励研究人员进行更多的病例对照研究和大样本的随机研究。
