人唾液外泌体对大鼠皮肤损伤的修复作用
2022-06-29宋思嘉陈文霞李贤玉
宋思嘉, 陈文霞, 李贤玉
(广西医科大学口腔医学院,附属口腔医院,广西颅颌面畸形临床医学研究中心,颌面外科疾病诊治研究重点实验室,广西壮族自治区卫生健康委员会口腔感染性疾病防治重点实验室,广西 南宁 530021)
外泌体是一种双层膜样结构囊泡, 直径为50~150 nm,可由不同种类的细胞分泌,其参与调节包括肿瘤转移、免疫、炎症、血管疾病、损伤修复等在内的多种生理、病理过程[1]。 研究发现,在损伤修复过程中,多种组织或细胞来源的外泌体均能显著促进组织修复、减少瘢痕组织形成。 既往研究表明,多种不同来源的间充质干细胞外泌体可通过调节皮肤创面愈合过程中的炎症反应、 细胞增殖和迁移、血管生成、胶原沉积等多个阶段,促进伤口愈合并抑制瘢痕形成, 对于皮肤损伤表现出良好的修复作用[2-3]。 然而,获取这些细胞来源的外泌体往往需要培养大量的细胞,技术敏感性高、耗时长且成本高。 寻找便捷高效的外泌体具有极其重要的意义。
外泌体也存在于多种体液当中,正常人每日唾液分泌量约为1.0~1.5 L,获取容易。 健康人的唾液能加快皮肤损伤的愈合过程[4-5]。 我们推测,唾液中的外泌体在此过程中能够发挥类似的作用。 有研究表明,唾液中富含大量外泌体,相关研究主要集中在唾液外泌体在口腔疾病的诊断、标志的应用中[6],在促进损伤修复、 抑制瘢痕组织形成方面应用较少。另有研究表明,人唾液来源的细胞外囊泡表面富含凝血组织因子(coagulant tissue factor,CTF),可传递至活化的血小板促进凝血,进而降低感染风险促进愈合。 但是唾液外泌体(S-Exos)对于皮肤损伤修复的确切效果有待研究[7]。 本研究通过切除大鼠背部全层皮肤建立大鼠全层皮肤缺损模型,将唾液和唾液外泌体分别与无菌水凝胶混合, 制备成注射液,通过局部皮下注射的方法治疗大鼠背部皮肤全层缺损,探讨人S-Exos 对大鼠皮肤全层损伤创面愈合的影响,为临床皮肤创面修复提供新的治疗策略。
1 材料和方法
1.1 实验动物及主要试剂
1.1.1 实验动物 SPF 级雄性SD 大鼠18 只,6~8 周龄,体质量200~260 g,购于广西医科大学实验动物中心。 动物的饲养环境条件和动物实验方案均通过广西医科大学动物伦理委员会批准(批准号:201904024)。
1.1.2 主要试剂 多肽水凝胶(Corning 公司,美国);CD9、CD63 抗体 (System Bioscience 公司, 美国);RIPA 裂解液、 磷酸盐缓冲液(phosphate-buffered saline,PBS)、Masson 染色试剂盒 (Solarbio 公司,美国)。CollagenⅠ、Collagen Ⅲ、α-SMA 抗体(武汉三鹰生物技术有限公司,中国);小鼠/兔链霉卵白素-生物素法检测试剂盒、DAB 显色试剂盒、 胃蛋白酶消化液(北京中杉金桥生物技术有限公司,中国)。
1.2 唾液收集,S-Exos 的提取、鉴定
1.2.1 唾液收集 根据知情同意原则, 采集20 例健康成年志愿者(18~35 岁)的唾液,本研究已通过广西医科大学医学伦理委员会的批准 (批准号:20210065)。 在样本采集前1 h,志愿者用清水漱口,并避免进食、饮水。 用无菌离心管收集志愿者的非刺激性全唾液(每人5~30 mL),0.5 h 内收集完毕。将所有唾液混合,用于下一步实验。
1.2.2 S-Fxos 的提取 采用超高速离心法分离SExos, 首先将收集到的唾液用PBS (1∶5) 稀释,以3000×g、4 ℃下离心30 min;10 000×g、4 ℃下离心40 min;收集上清液,用0.22 μm 滤膜过滤;随后以120 000×g、4 ℃下超速离心90 min 以沉淀外泌体。用PBS 洗涤S-Exos 后,以120 000×g、4 ℃下最后离心90 min 得到S-Exos,PBS 重悬,-80 ℃保存。
1.2.3 透射电镜观察S-Fxos 的形态 吸取样品10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液,吸取醋酸双氧铀10 μL 滴加于铜网上沉淀1 min, 滤纸吸去浮液,常温干燥数min,观察外泌体的形态。
1.2.4 Western blotting 检测S-Fxos 相关蛋白 提取唾液蛋白及外泌体蛋白,100 ℃下煮沸变性5 min。等量上样至十二烷基硫酸钠聚丙酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶,120 V 电压条件下电泳80 min,200 mA 电流条件下转膜90 min, 用5%脱脂奶粉封闭1 h,一抗(CD9 1∶1 000;CD63 1∶1 000)4 ℃下孵育过夜,辣根过氧化氢酶标记二抗(1∶20 000),室温孵育1 h,滴加增强化学发光(enhanced chemiluminescence,ECL)试剂后用Bio-blot 曝光仪检测灰度值的表达。
1.3 大鼠全层皮肤缺损模型的建立及分组处理
根据相关文献的描述建立大鼠皮肤全层缺损模型,18 只大鼠用3%戊巴比妥钠以30 mg/kg 的剂量进行腹腔注射麻醉[8]。 待大鼠麻醉后,剃除背部毛发,消毒铺巾,以脊柱为中线,采用皮肤活检打孔器在大鼠背部制作2 个皮肤全层损伤创面,即2 个直径为10 mm 的圆形对称损伤, 止血, 用3M Tegaderm 辅料覆盖1 d,随后保持创面开放。损伤模型建立的当天记为第0 天。 将18 只大鼠随机分为3 组,分别为对照组、唾液处理组、外泌体处理组,每组6 只大鼠共12 个创面。 各组注射液的制备如下。 对照组:PBS 与1%的水凝胶以1∶1 的比例混合; 唾液处理组: 唾液与1%的水凝胶以1∶1 的比例混合;外泌体处理组:唾液外泌体(400 μg/mL)与1%的水凝胶以1∶1 的比例混合。 根据分组,于术后48 h 每个创缘皮下注射100 μL 注射液(分为4 个点注射,每点25 μL)。
1.4 创面愈合情况观察
观察记录伤口愈合情况,在第0、4、8、12、14 天时拍照、记录大鼠皮肤损伤修复情况,用ImageJ Fiji软件(NIH 公司,美国)测量伤口面积,计算伤口愈合率。 伤口愈合率(%)=(原始创面面积-未愈合创面面积)/原始创面面积×100%。
1.5 组织学观察
分别于第14 天和第35 天随机处死各组小鼠,每组3 只。 采集损伤部位全层皮肤组织,用4%多聚甲醛固定,石蜡包埋,收集所有样本,在样本的最大直径处, 连续切取3~5 张4 μm 的切片,HE 染色观察大鼠皮肤损伤处的组织学表现,每组选取3 个样本, 每个样本切片随机选取3 个同样大小的视野(×400),统计视野中细胞核的数目。
1.6 统计学分析
采用SPSS 25.0 软件进行统计学分析。 采用GraphPad Prism 6 软件绘图。 多组间样本均数比较采用单因素方差分析,2 组间比较采用t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 S-Exos 提取物的检测及鉴定
用透射电镜观察S-Exos(图1A),来自唾液的外泌体有双层膜结构, 呈“杯托”样,直径约为70 nm;Western blotting 结果(图1B)显示,唾液中提取到的外泌体生物标志物CD9 和CD63 表达阳性。
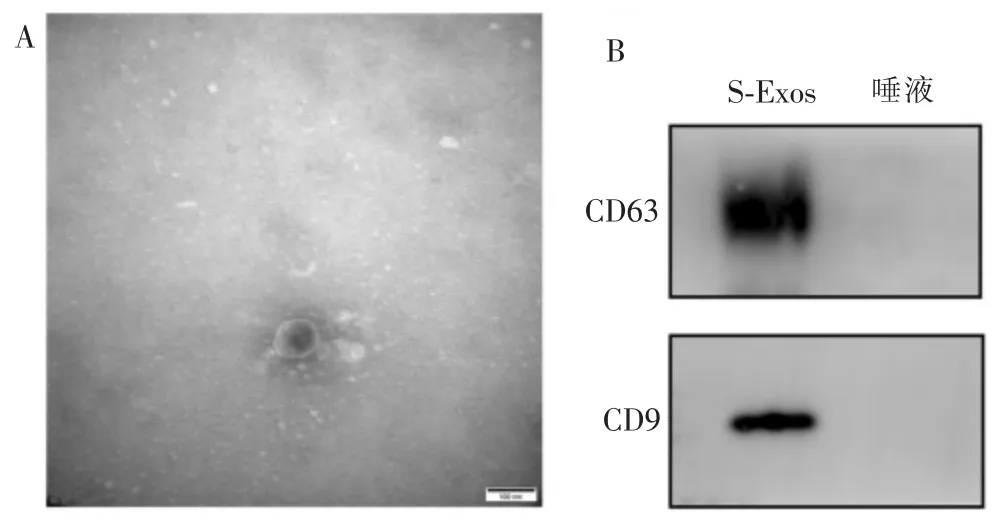
图1 唾液外泌体的鉴定及表征Figure 1 Identification and characterization of S-Exos
2.2 各组大鼠皮肤全层缺损愈合情况
第0 天, 成功建立了大鼠皮肤全层缺损模型,全层皮肤被切除,皮下组织完全暴露,皮肤活检打孔器形成的圆形创口边缘整齐, 面积大致相同(78.5 mm2)。 图2A 分别显示了对照组、唾液处理组和外泌体处理组在术后不同时间点的皮肤创面图像。 在不同时间点,伤口处均未发现炎症或感染迹象。 术后伤口周围表皮向皮肤缺损处生长延伸,各组创面均有不同程度的收缩, 从术后第4 天开始,唾液外泌体处理组呈现出加速大鼠皮肤损伤愈合趋势。 术后第8 天,外泌体处理组大鼠背部创面愈合率高达(92.44±3.93)%, 显著高于对照组[(79.05±6.35)%]和唾液处理组[(73.93±8.35)%](P<0.01,表1)。术后第12 天,各组创缘新生上皮生长明显,创缘新皮较薄,呈透明状,无毛发生长,外泌体处理组损伤基本愈合。 术后第14 天, 伤口处血痂均已自行脱落,各组创面均基本愈合,部分皮肤创面仍有点状上皮未覆盖的区域,其面积与初始面积相比,平均缩小98%以上(表1);可见瘢痕组织形成,颜色较正常皮肤浅。 术后第35 天,各组损伤部位瘢痕组织肉眼形态无明显差异。
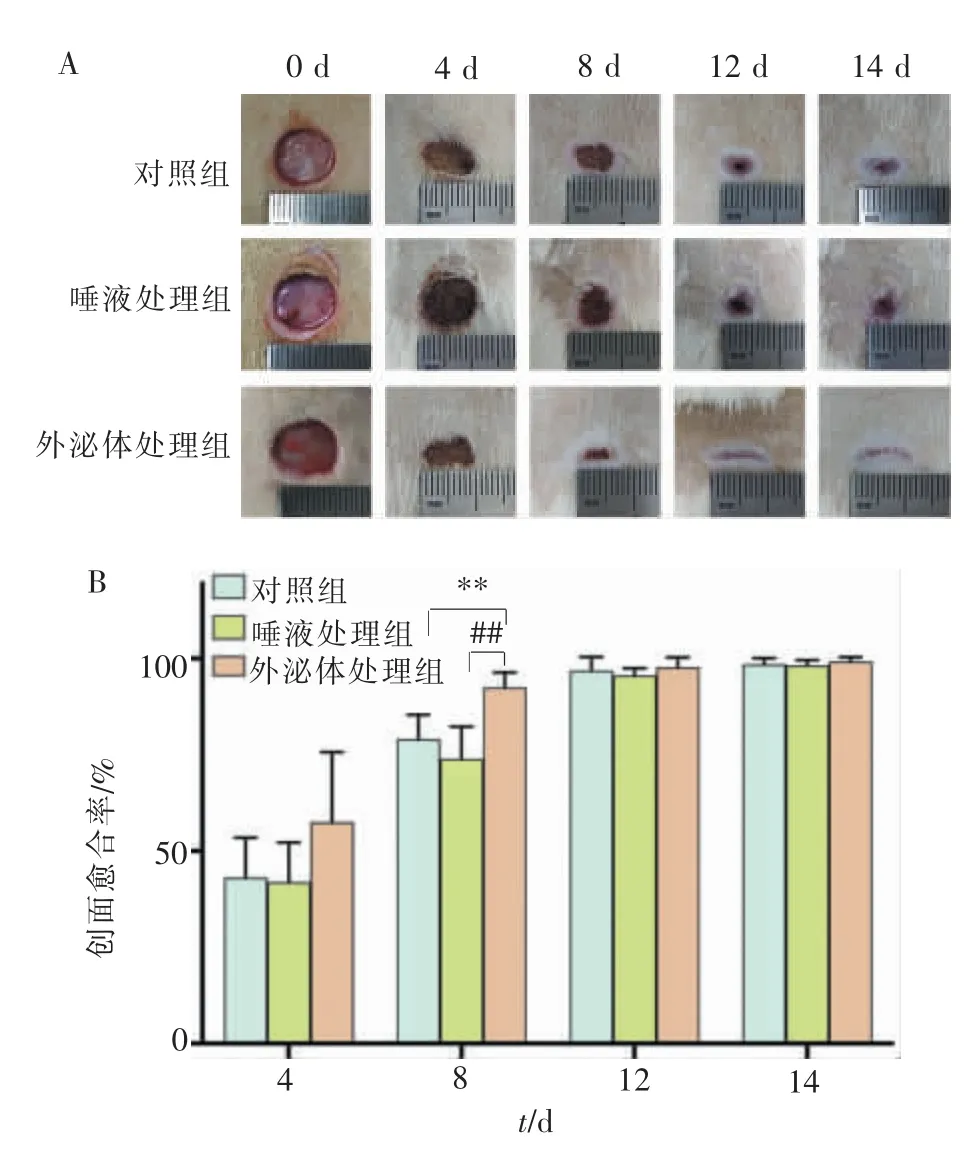
图2 各组大鼠皮肤缺损愈合情况及愈合率Figure 2 Skin defects repair conditions and healing rates

表1 各组大鼠不同时间点创面愈合率比较(n=6,x±s)Table 1 Skin wound healing rate of rats at different time points in different groups (n=6,x±s)
2.3 各组大鼠损伤部位组织学观察
术后第14 天, 观察各组大鼠皮肤缺损处组织(图3A), 各组创面呈现出不同程度的肉芽组织增生状态,成纤维细胞和胶原纤维大量增殖,肉芽组织表面上皮组织增生,较正常皮肤组织增厚,结构与正常皮肤相似。 各组均有毛细血管新生,并且观察到外泌体处理组损伤部位细胞密度较高,通过细胞数目统计,外泌体处理组皮肤损伤处的细胞(主要为成纤维细胞和炎症细胞)数目(324±70)明显多于对照组(123±12)和唾液处理组(227±81),差异有统计学意义(P<0.05)。 术后第35 天,各组损伤处组织均可见大量细胞外基质成分沉积,各组成纤维细胞密度均较14 d 时减少,炎症细胞少见。 外泌体处理组的缺损处皮肤表皮组织增生程度减轻,与正常皮肤表皮厚度相似;细胞外基质中胶原纤维呈现出有序的平行排列,皮肤组织中可见个别毛囊生成(图3B)。 相反,对照组和唾液处理组仍有较厚的表皮增生,皮下组织中存在大量胶原纤维堆积,且结构更为松散,分布杂乱;未见皮肤附属器生成。

图3 各组大鼠皮肤创面组织形态学表现和细胞数目统计Figure 3 Histological features of cutaneous wound healing and cell density measurement
3 讨论
本研究中采用了多肽水凝胶作为外泌体及其他注射物的支架。 水凝胶是具有3D 结构的黏性聚合物,具有与天然组织相似的物理性质[9]。 无菌多肽水凝胶具有良好的生物相容性,呈纳米级纤维结构,平均孔径为50~200 nm,为组织的再生提供了3D 微环境。 本研究将唾液外泌体与多肽水凝胶混合,提供了组织再生的支架, 水凝胶形成了膨胀3D 网络结构,能使分子和细胞自由扩散,并延长了外泌体在局部的作用时间[10]。
皮肤损伤的修复是一个连续和重叠的过程,一般需要经历炎症、增殖和重塑3 个阶段[11-12],其中涉及多种细胞和生长因子的参与和互相协调。 当机体皮肤受到损伤后, 通过清创协调各种趋化因子,炎症细胞募集,清除异物和坏死组织。 同时,炎症细胞分泌细胞因子,诱导上皮细胞、成纤维细胞、血管内皮细胞等的分裂和增殖, 有助于缺损皮肤的修复。伤口一旦闭合, 重塑阶段开始, 此时细胞外基质(extracellular matrix, ECM)改变,胶原网络重塑,不规则的胶原纤维趋向于规则。 既往研究发现,外泌体可以通过多种方式在组织修复中发挥作用,其中包括调节炎症反应、传递血管生成信号、调节胶原重塑等方式[13]。
据报道,S-Exos 可提升成纤维细胞的增殖和迁移能力,这有助于在伤口区域产生收缩力,这一过程主要发生在伤口愈合初始阶段[14]。本研究中,经SExos 处理后的皮肤伤口愈合更快,表现为损伤后伤口早期收缩迅速, 在术后第8 天显示出明显差异;术后第14 天观察损伤部位组织形态发现, 外泌体处理组细胞数量明显多于对照组和唾液处理组(P<0.05), 表明S-Exos 可以刺激损伤部位成纤维细胞的增殖,由此产生的收缩力可能是外泌体处理组改善伤口愈合的原因之一。 外泌体处理组在术后14 d时,炎症细胞数目增多,同时新生血管丰富,伤口中的血管生成水平通常与炎症反应相关,炎症细胞产生大量促血管生成介质[15],毛细血管网的生成有助于肉芽组织的形成,这些组织学表现提示了S-Exos能通过促进成纤维细胞的增殖、调节缺损部位的炎症反应等促进伤口愈合。
正常皮肤由2 个组织层组成:角质化的表皮层和富含胶原纤维的真皮层。 毛发和腺体等附属物源自表皮并与之相连,深入真皮层[16],表皮作为生物体的最外层,通过上皮细胞的迁移和增殖快速闭合伤口部位。 本研究中,各组大鼠皮肤受到损伤后,均可观察到表皮组织的快速增殖变厚,这对于恢复生物体的屏障功能至关重要。 当机体受到损伤后,理想的组织再生不是单纯的缺损部位修补,而是组织结构三维形态的恢复。 我们期望皮肤缺损能够最大程度恢复到正常皮肤的组织形态,包括皮肤附属器的再生。 皮肤附属器是皮肤生理功能的组成部分,以往认为, 毛囊形成通常只发生在胚胎发育过程中[17]。近年来的研究发现,当皮肤组织的再生潜力被激活后,伤口的愈合过程与胎儿相似,可实现毛囊的新生[18-19]。 多种来源的外泌体确实可以促进毛囊的新生和毛发的生长, 包括角质形成细胞来源的外泌体、神经祖细胞衍生的外泌体、真皮乳头细胞分泌的外泌体、脂肪干细胞来源的外泌体等[20-23],通过促进Wnt/β-catenin 信号通路的激活[20-21],促进了毛囊细胞生长周期的调控, 提示外泌体可能包含有促进毛囊新生的成分, 其中外泌体中的microRNA(miRNA)可能参与调控毛囊新生过程:神经祖细胞衍生的外泌体传递的miR-100 抑制多个β-catenin负调节因子并增加β-catenin 信号转导从而诱导毛囊再生[20];真皮乳头细胞分泌的外泌体中,miR-218-5p 上调,靶向SFRP2,进而上调Wnt/β-catenin 信号通路来调节毛囊发育[21]。本研究中,我们在术后35 d时观察到外泌体处理组有毛囊皮肤附属器生成,表明人S-Exos 也具有促进毛囊再生的作用; 同时,外泌体处理组表皮增生情况恢复,说明外泌体处理后的损伤部位能够恢复到正常皮肤组织结构。
本研究利用人S-Exos 促进缺损皮肤的愈合和表皮附属物再生,达到了较好的损伤修复效果。本研究可为临床皮肤创面修复提供新的治疗策略。
