CYP3A5 在口腔鳞状细胞癌组织中的表达及作用
2022-06-29陈伟鸿
陈伟鸿, 熊 洁, 查 骏
(广州医科大学附属口腔医院急诊综合科,广州口腔疾病研究所,口腔医学重点实验室,广东 广州 510140)
口腔鳞状细胞癌(OSCC)常常会引起咀嚼、语言 障碍和吞咽困难,每年确诊的患者超过50 万[1],是世界上第六大常见的癌症, 约占所有恶性肿瘤的5%[2]。 OSCC 是头颈部恶性肿瘤发病率最高的肿瘤,患者通常容易发生细胞浸润和转移。 此外,虽然目前治疗OSCC 的方法很多,包括手术切除、放疗和化疗,但经这些方法治疗后,患者预后均较差,且容易产生严重的副作用, 如面部畸形或部分功能缺失等。 因此,探索OSCC 的分子机制、寻找新的治疗靶点和诊断标志是目前函待解决的问题。
CYP3A5 是细胞色素P450 酶系(cytochrome P450 enzyme system,CYPs)3A 亚家族的主要成员,主要分布于一些肝外组织如肠壁、肾、前列腺和肺等中,其传统的生物学功能为参与内外源性物质代谢。 目前的研究表明, 细胞色素P450 参与肿瘤治疗,并与肿瘤的发生和发展密切相关[3-5]。CYP3A5 是参与内源性分子如药物、外源性致癌物质和类固醇代谢过程细胞色素P450 超家族酶的成员[6]。 早期的报道显示,CYP3A5 的异常表达与肝细胞癌(hepatocellular carcinoma,HCC)的进展有关,可作为治疗丙型肝炎病毒(hepatitis C virus,HCV)相关HCC 及标志物的靶点[7]。 但是,CYP3A5 与OSCC 之间的关系尚未见报道。
1 材料和方法
1.1 实验试剂
CYP3A5 siRNA NC (对照组)、CYP3A5 siRNA(锐博公司,中国);DMEM-F12 培养液、DMEM 培养液、胰蛋白酶、胎牛血清(Gibco 公司,美国);TRIzol试剂(Invitrogen 公司,美国);SYBR Premix ExTaq 试剂盒(TaKaRa 公司,日本);Matrigel 胶(BD 公司,美国);GenMuteTM转染试剂 (SignaGen 公司, 美国);CCK8 试剂盒(同仁公司,日本);BCA 蛋白测定试剂盒(Beyotime 公司,中国);一抗、抗β-actin、IgG(Abcam 公司,英国)。
1.2 细胞株来源、临床标本及细胞培养
SCC-9、SCC-25、CAL-27 细胞为人舌鳞癌细胞株, 购买于美国模式菌种收集中心(American type culture collection,ATCC)。 HOK 细胞为正常人口腔角质细胞株,购买于Sciencell 研究实验室。OSCC 及癌旁组织来源于广州医科大学附属口腔医院,该研究已取得患者同意并签署书面知情同意书,同时通过广州医科大学附属口腔医院伦理委员会同意(批准号:KY2017015)。 经病理检查确诊为OSCC,术前均未接受过化疗、放疗及免疫治疗。
HOK 细胞用DMEM-F12 培养液 (含10%胎牛血清) 培养,SCC-9、SCC-25、CAL-27 细胞用DMEM培养液(含10%胎牛血清)于37℃、5% CO2培养箱中培养。
1.3 细胞转染
根据GenMuteTM转染试剂操作指南进行转染,转染前1 天, 将细胞接种于2 mL 无抗生素完全培养液的6 孔板中,每孔为1×105个,当细胞生长至密度为50%~60%时更换为完全培养液 (含抗生素和10%胎牛血清),将CYP3A5 siRNA 和CYP3A5 siRNA NC 转染于不同孔中, 用无血清及抗生素的DMEM培养液稀释CYP3A5 siRNA 和CYP3A5 siRNA NC至10 nmol/L,各取80 μL ddH2O、20 μL 5×transfection buffer、4 μL GenMuteTM至5 μL 上述无血清及抗生素的DMEM 培养液稀释液中,混匀、室温下孵育20 min 后加入不同孔板中, 再加入1 mL 完全培养液,48 h 后提RNA 检测转染后基因表达水平的改变情况,并完成增殖、迁移、侵袭等实验。
1.4 细胞增殖
收集转染CYP3A5 siRNA 及CYP3A5 siRNA NC 的细胞接种于96 孔板中, 以每孔5 000 个细胞的密度常规培养于培养箱中,分别于0、24、48、72 h 时于每孔中加入10 μL CCK8 试剂, 于培养箱中放置4 h,用酶标仪测定其在450 nm 处的吸光度值。
1.5 细胞侵袭迁移
用无血清培养液对8 g/L 的Matrigel 胶进行水化,取50 μL 包被于Transwell 小室底部,37 ℃下静置2 h, 取对数生长期转染CYP3A5 siRNA 及CYP3A5 siRNA NC 后的细胞,制成1×106个/mL 的无血清细胞悬液, 向每个铺胶的Transwell 小室中加入200 μL 细胞悬液,并在24 孔板每孔对应加入600 μL的完全培养液,然后将小室放入孔中,于培养箱培养24 h 后取出,用4%多聚甲醛固定及结晶紫染色,高倍显微镜下随机3 个视野观察细胞,计数并统计。
1.6 实时定量聚合酶链反应(RT-qPCR)
取各组对数生长期细胞,使用TRIzol 试剂提取总RNA,采用NanoDrop 2000 进行定量,通过逆转录试剂盒将RNA 逆转录成cDNA, 使用Prime-ScriptTMRT 试剂盒进行RT-qPCR,反应条件如下:95 ℃30 s,95 ℃5 s,55 ℃30 s,72 ℃30 s,40 个循环。通过2-ΔΔCt法进行结果计算,所有试验重复3 次。引物及内参引物均由上海捷瑞生物工程有限公司设计合成,见表1。
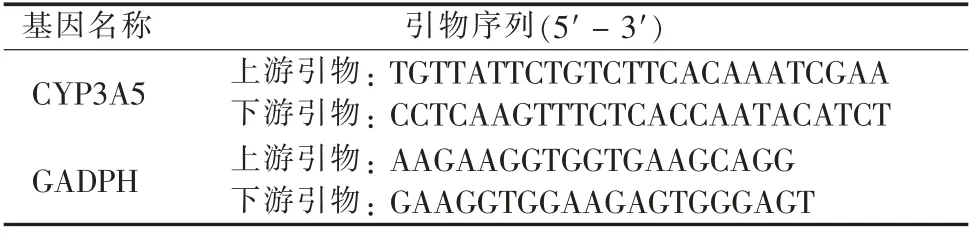
表1 RT-qPCR 引物序列Table 1 The primer sequences of the genes used for RT-qPCR
1.7 Western blotting 检测蛋白表达水平
取转染后48 h 的细胞,加入RIPA 裂解液后提取总蛋白, 根据BCA 蛋白定量试剂盒说明书进行蛋白定量,将制备好的蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE),采用Western blotting 检测CYP3A5 蛋白表达情况。
1.8 免疫组织化学
使用一抗在4 °C 下对脱蜡的OSCC 组织切片进行免疫组织化学(IHC)染色,阴性对照则将一抗替换为正常IgG,在4 °C 下过夜,随后用二抗处理载玻片并用苏木精复染,随机拍摄免疫组织化学染色后的5 组图片, 通过Image J 软件分析阳性面积并进行统计,取平均值。
1.9 统计学分析
数据均采用SPSS 20.0 软件进行统计学分析,数据以平均值±标准差(x±s)表示,2 组间比较采用独立样本t 检验、配对t 检验,多组间比较采用单因素方差分法,以P<0.05 为差异有统计学意义。
2 结果
2.1 CYP3A5 在OSCC 组织和细胞中的表达水平
RT-qPCR 结果显示,在10 例OSCC 组织(0.16±0.16)中,CYP3A5 的基因表达水平显著低于其在癌旁组织(1.04±0.16)中(图1A,P<0.001);同时,对比HOK细胞系,SCC-9、SCC-25、CAL-27 细胞中,CYP3A5 基因同样呈现低表达水平 (图1B,P<0.01)。 CYP3A5蛋白在OSCC 组织及细胞系中均为低表达水平(图1C、D,P<0.05)。
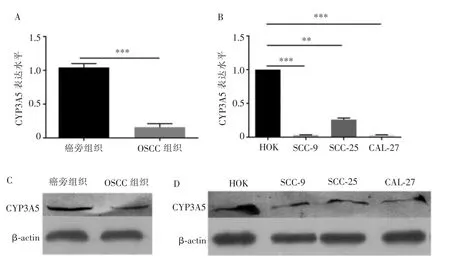
图1 OSCC 组织及细胞系中CYP3A5 的基因及蛋白表达水平Figure 1 Genetic and protein expression levels of CYP3A5 in OSCC tissues and cell lines
2.2 CYP3A5 siRNA 的转染效率检测及细胞系筛选
RT-qPCR 结果显示, 转染CYP3A5 siRNA-1 及siRNA-2 后,SCC-9 (siRNA-1: 0.61±0.07;siRNA-2:0.69±0.12)、SCC-25 (siRNA-1: 0.53±0.08;siRNA-2:0.80±0.07)、 CAL-27 (siRNA-1: 0.53±0.19;siRNA-2:0.74±0.23)细胞中CYP3A5 基因的相对表达量均显着低于对照组(图2,P<0.05),且CYP3A5 siRNA-1转染效率高于CYP3A5 siRNA-2,证明CYP3A5 基因在OSCC 细胞系中被成功敲降, 因而选用CYP3A5 siRNA-1 于后续实验,后续实验均用CYP3A5 siRNA敲降成功的细胞系。
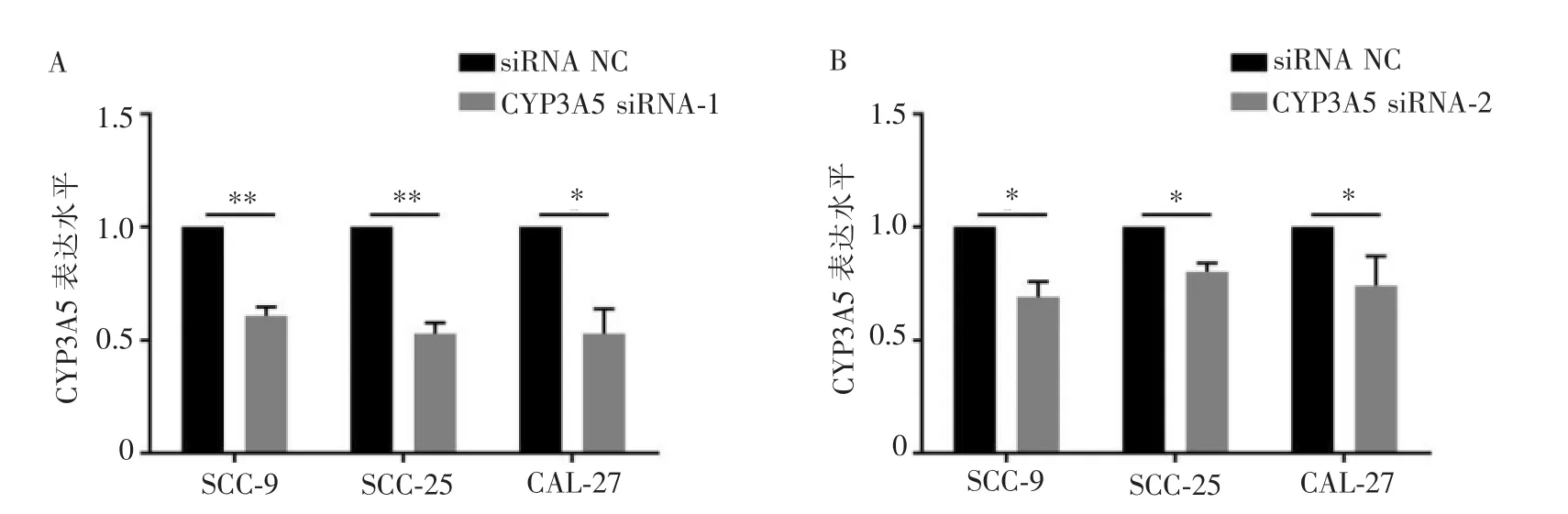
图2 CYP3A5 siRNA 的转染效率及细胞株筛选Figure 2 Transfection efficiency of CYP3A5 siRNA and cell line screening
2.3 抑制CYP3A5 基因表达对OSCC 细胞增殖的影响
CCK8 结果显示, 转染CYP3A5 siRNA 48、72 h后,SCC-9 (48 h: 0.73±0.05;72 h: 0.97±0.06)、SCC-25(48 h: 0.73±0.05;72 h: 1.09±0.13)、CAL-27(48 h:0.79±0.06;72 h: 1.05±0.16)细胞增殖得到明显促进(图3,P<0.05)。 因 此, 在OSCC 细 胞 系 中 抑 制CYP3A5 的表达能够明显促进细胞增殖。

图3 抑制CYP3A5 基因表达对OSCC 细胞系增殖的影响Figure 3 Effect of inhibiting of the expression of CYP3A5 gene on the proliferation of OSCC cell lines
2.4 抑制CYP3A5 基因表达对OSCC 细胞侵袭及迁移的影响
Transwell 细胞侵袭结果显示, 与对照组相比,转染CYP3A5 siRNA 的SCC-9 (1 051.33±99.14)、SCC-25(1 051.67±145.75)、CAL-27(973.33±181.36)细胞穿过人工基底膜的细胞数明显增多,细胞侵袭能力明显增强(图4,P<0.05)。 同样,Transwell 细胞迁移结果显示,与对照组相比,转染CYP3A5 siRNA的SCC-9(10 522±91.43)、SCC-25(1 070.33±116.63)、CAL-27(1 007±103.12)细胞穿过人工基底膜的细胞数显著增多,细胞迁移能力明显增强(图5,P<0.05)。 因此,在OSCC 细胞系中抑制CYP3A5 基因的表达能够明显促进细胞侵袭及迁移能力。
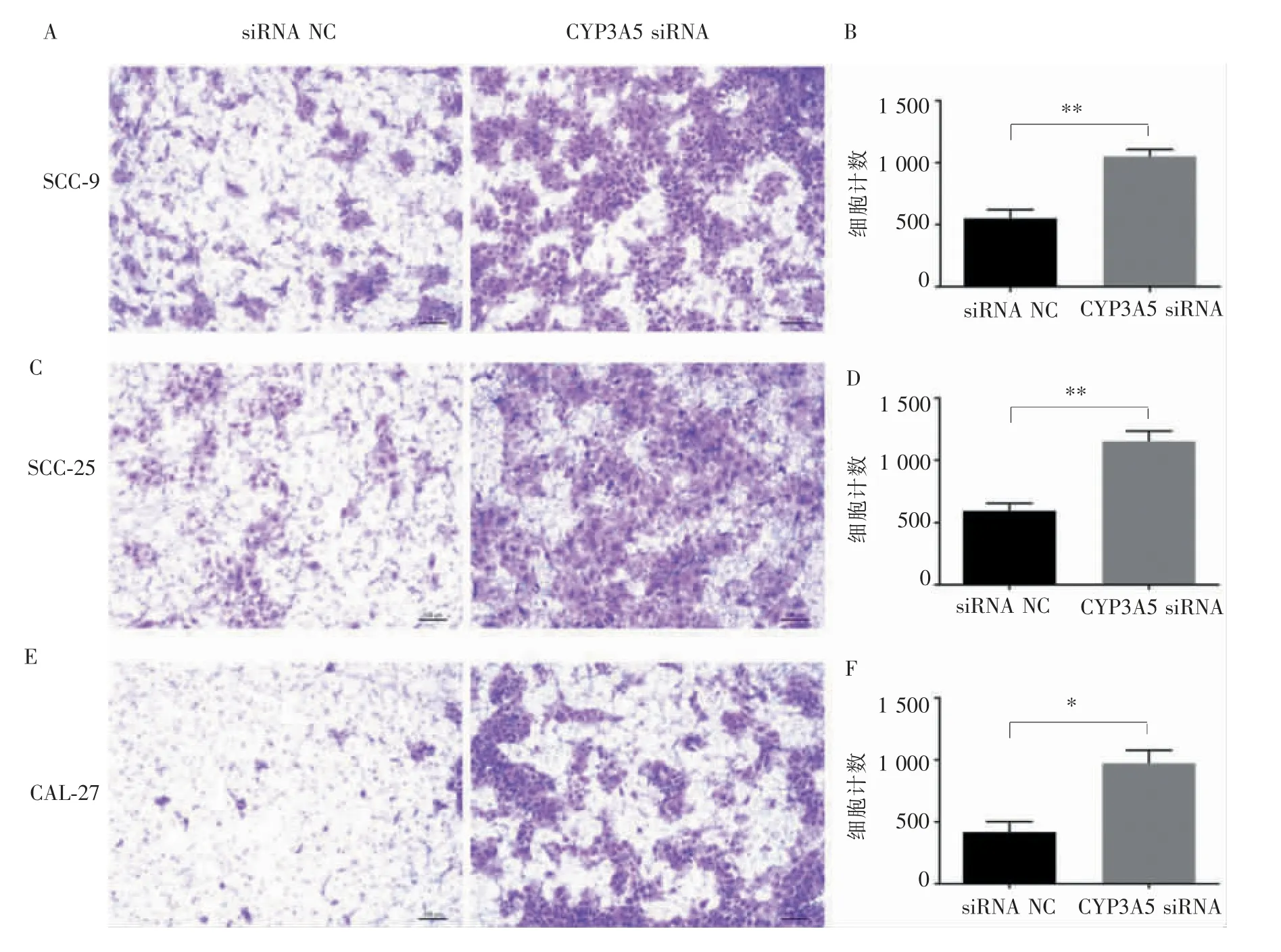
图4 抑制CYP3A5 基因的表达促进OSCC 细胞侵袭(×40)Figure 4 Inhibition of the expression of CYP3A5 gene promoted the invasion of OSCC cell lines(×40)

图5 抑制CYP3A5 的表达促进OSCC 细胞迁移(×40)Figure 5 Inhibiting of the expression of CYP3A5 gene promoted the migration of OSCC cell lines(×40)
2.5 CYP3A5 在OSCC 组织中的表达水平
应用免疫组织化学法分析OSCC 组织中CYP3A5 的表达水平,结果显示CYP3A5 在OSCC 癌组织(0.007±0.002)中呈显著低水平(图6,P<0.01)。
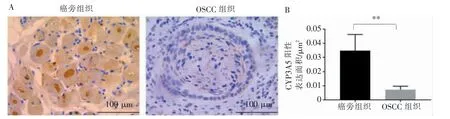
图6 免疫组织化学法分析CYP3A5 在OSCC 组织中的表达水平(×40)Figure 6 IHC analysis of CYP3A5 staining expression level in OSCC tissues(×40)
3 讨论
经过不断的实践研究,人们逐渐提高了对癌症相关基因的认知,但是某些癌症的确切分子机制及致病机理仍然不清楚,如OSCC 的发生是多因素、多步骤、逐渐发展的结果[8]。 OSCC 是世界上最常见的恶性肿瘤之一。与其他恶性肿瘤类似,OSCC 的形成是多种因素导致基因突变的结果。 淋巴结局部转移是OSCC 主要的、对治疗预后影响最大的生物学行为[9]。 虽然近年来口腔癌患者的治疗效果有所改善,但近5 年的生存率没有得到明显改善,约为50%[10]。因此,深入了解OSCC 的发病机制和鉴定新的基因治疗方案是近年来的重点。
CYP3A5 是细胞色素P450 CYP3A 亚家族的主要成员之一, 它在以前的研究中侧重于药物代谢、CYP3A5 多态性与癌症风险之间的关系[11-15]。近年来, 许多研究表明,CYP3A5 在多种肿瘤中异常表达,而其异常表达与肿瘤侵袭、转移密切相关。在早期的研究中, 发现CYP3A5 在骨肉瘤患者中高表达,并与转移和预后相关,这可能会使其成为骨肉瘤的生物标志物[16]。 此外,CYP3A5 的表达水平在肝细胞癌中显著降低,并通过TORC2/Akt 信号通路抑制肝癌的侵袭和转移[42]。 与上述研究结果一致,本研究的结果表明,人OSCC 中CYP3A5 的表达降低。
综上所述, 在本研究中,CYP3A5 基因在OSCC癌组织和细胞系中均呈现低表达, 并促进OSCC 细胞系的增殖、侵袭及迁移。 本研究表明,通过抑制CYP3A5 基因表达能促进OSCC 细胞的细胞增殖、侵袭和迁移,CYP3A5 可能成为未来OSCC 潜在的生物标志物和治疗靶点, 为OSCC 的治疗和预后提供了新靶点,但其在临床中作为靶向治疗分子和生物学标志物的作用,还有待进一步的研究。
