西他沙星片制备与工艺放大研究
2022-06-20张天可黄道明
张天可 黄道明
1.合肥佰未源生物医药有限公司技术部,安徽合肥 230031;2.北京阜康仁生物制药科技有限公司技术部,北京 102627
西他沙星片由日本第一制药三共株式会社开发的广谱喹诺酮类抗菌药,2008 年在日本上市,商品名为Gracevit®,每次口服50 mg,2 次/d,用于治疗细菌感染引起的咽炎、喉炎、扁桃体炎、急性支气管炎、肺炎、慢性呼吸道病变继发感染;膀胱炎、肾盂肾炎、尿道炎;子宫颈管炎;中耳炎等其他炎症,临床应用广泛。我国于2019 年批准西他沙星片进口上市[1-4],目前国内外药典均未收载该品种。
体外溶出曲线不仅是口服固体制剂在体内作用一致性评价研究的重要依据,也是药品质量提高的有力支持和主要依据,而实现仿制药与原研药具有一致的溶出行为是保证其质量和疗效一致性的关键[5-8];如何将实验室产品向商业化生产的转移是仿制药企业面临的难题。本研究通过对影响西他沙星片溶出的各种因素考察,借助数学模型[9]计算得到了可用于指导西他沙星片生产的工艺参数,为实验室工艺向车间放大工艺的转化提供了理论依据。
1 仪器与材料
1.1 仪器
SQP 型电子天平(赛多利斯科学仪器有限公司,精密度百分之一);SMG-75 型湿法混合制粒机(重庆精工制药机械有限责任公司);FL 型沸腾制粒机(哈尔滨纳诺医药化工设备有限公司);YQ100-1 型气流磨(上海赛山粉体制造有限公司);YHA-2A 型全自动提升混合机(上海华兴制药设备厂);PG34 压片机(北京航空制造工程研究所);BG75F 包衣机(北京航空制造工程研究所);YD-20KZ 型硬度测定仪(天津市天大天发科技有限公司);MA100C 型水份测定仪(赛多利斯科学仪器有限公司);RCZ-8B 型智能溶出度仪(天津市天大天发科技有限公司);UV2450 型紫外-可见分光光度仪(日本岛津公司)。
1.2 材料
参比制剂:西他沙星片(日本第一三共株式会社,批号:ZAA0010);西他沙星片(自制,批号:210466);西他沙星原料(武汉贝尔卡生物医药有限公司,批号:190508X104);甘露醇(石家庄华旭药业有限责任公司,批号:21010102);玉米淀粉(安徽山河药用辅料股份有限公司,批号:202107);低取代羟丙纤维素(湖南九典宏阳制药有限公司,批号:20200414);羟丙纤维素(安徽山河药用辅料股份有限公司,批号:B1227012);硬脂酸镁(武汉一枝花油脂有限公司,批号:A181010 X004);欧巴代(上海卡乐康公司,批号:295F680000);西他沙星对照品(天津汉康医药生物技术有限公司,批号:080813);氢氧化钠(分析纯,北京化工厂);盐酸(分析纯,北京化工厂)。
2 方法与结果
2.1 方法
2.1.1 西他沙星片样品的制备
参照日本上市的原研药西他沙星片公开信息[10],原辅料经预处理后,称配、混合、湿法制粒、流化床干燥、总混、压片、包衣。
2.1.2 溶出度测定
参照日本独立行政法人医药品及医疗器械综合管理机构公布的西他沙星片溶出度测定方法[10]及相关文献资料[11],以pH 1.2 盐酸溶液、pH 4.0 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液及纯化水900 ml 为溶出介质,按照2020 年版《中华人民共和国药典》(四部)[12]0931 项下第二法测定,取12 片样品分别置于溶出杯中,避光操作,于10、15、30 及45 min 时取样10 ml(同时补充同温度的溶出介质10 ml),0.45 μm 的微孔滤膜(聚醚砜材质)过滤,取续滤液1 ml 溶液置10 ml容量瓶中,用溶出介质稀释至刻度,摇匀,作为供试品溶液。
对照品溶液:避光操作,取西他沙星对照品约10 mg,精密称定,置10 ml 量瓶中,加溶出介质溶解并稀释至刻度,摇匀,精密量取0.5 ml 于100 ml 量瓶中,加溶出介质稀释至刻度,摇匀,作为对照品溶液。
采用紫外-可见分光光度法在295 nm 波长处测定吸光度,计算溶出量。
2.1.3 搅拌转速计算
搅拌转速计算公式:
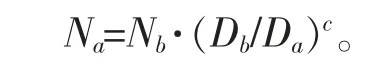
其中a、b 分别代表不同的制粒锅,N 是搅拌速度,D 是搅拌桨直径,C 是一个常数,取决于使用的放大规则:即对于恒定的弗劳德常数为0.5,对于恒定的尖端速度为1.0,对于恒定的经验剪切力为0.8。
2.1.4 溶出相似因子(f2)计算
溶出相似因子[13-14]f2(similarity factor f2)计算公式:

其中n 为取样时间点个数,Rt为参比制剂t 时刻的平均溶出量,Tt为试验样品在t 时刻的平均溶出量。
2.1.5 处方来源及设计依据
西他沙星片说明书信息[15]:“每片含西沙他星50 mg,所用辅料为D-甘露醇,玉米淀粉,低取代羟丙基纤维素,羟丙基纤维素,硬脂酸镁;包衣处方为羟丙甲基纤维素,钛白粉,滑石粉,聚乙二醇6000,二甲基硅油,二氧化硅,巴西棕榈蜡”。
根据以上信息及相关文献[16]设计西他沙星片处方及制备工艺。
2.1.6 处方筛选
2.1.6.1 填充剂用量考察 参照原研药处方信息,采用甘露醇和玉米淀粉作为填充剂,考察其用量对本品成型性及溶出的影响,见表1。处方中淀粉含量高,片剂可压性差,硬度低,脆碎度不好,不利于包衣,结合样品与原研药溶出曲线相似性比较结果,最终确定玉米淀粉用量36 mg/片,甘露醇用量50 mg/片。
2.1.6.2 崩解剂用量考察 低取代羟丙基纤维素在处方中为崩解剂,其用量大小影响药物的溶出[17-18]。处方中采用不同用量的崩解剂制备样品,考察崩解剂用量对溶出的影响,见表1。崩解剂用量增加,药物溶出速率变快,根据样品与原研药溶出曲线相似性比较结果,确定低取代羟丙基纤维素用量为18 mg/片。
2.1.6.3 黏合剂浓度考察 羟丙基纤维素在处方中为黏合剂,其浓度大小影响制粒效果及颗粒分布,从而可能影响药物的溶出[19],分别选用水,3%羟丙基纤维素水溶液,5%羟丙基纤维素水溶液作为黏合剂,考察对黏合剂浓度对溶出的影响,见表1。黏合剂浓度对本品溶出没有明显的影响,但是在制粒过程中,水作为黏合剂制出的颗粒成型性不好,颗粒松散,细分较多;5%羟丙基纤维素水溶液制出的颗粒较硬,外观不好,综合考虑,最终确定选择3%羟丙基纤维素作为黏合剂。
2.1.6.4 润滑剂用量考察 硬脂酸镁在处方中为润滑剂,其用量大小不仅影响抗黏性,而且可能影响药物的溶出,因此对其用量进行考察,见表1。本品处方中不同量的硬脂酸镁抗黏效果均良好,但硬脂酸镁用量>1.5 mg 时对溶出速率有明显影响。综合考虑确定硬脂酸镁用量为1 mg/片。
2.1.6.5 原料药粒径考察 原料药生物药剂学分类系统分类及其粒度不仅会影响药物的溶出速率,而且会影响药物的体内吸收及其生物利用度,西他沙星生物药剂学分类系统为3 类药物[20],具有高溶解性和低渗透性。为了确定原料粒度,控制药物溶出速率的均一稳定,考察粒度对药物溶出速率的影响,见表1。西他沙星原料药粒径在80~120 μm 时对本品溶出速率无明显影响,最终确定西他沙星原料药粒度为80~120 μm。
2.1.6.6 制粒转速 对于湿法制粒工艺,制粒转速影响制粒强度和颗粒分布[21-22]。分别采用制粒转速150、200、250 r/min 制备样品,考察制粒转速对溶出速率的影响,见表1。制粒转速增加,药物溶出速率变慢,制粒转速<150 r/min 或>250 r/min 时,样品与原研药溶出曲线相似性降低,转速为200 r/min 时,制备样品与原研药溶出曲线相似性较好,优选制粒转速为200 r/min。
2.1.6.7 制粒时间 对于湿法制粒工艺,制粒时间影响制粒强度和颗粒分布[23-24]。分别按照制粒1、2 min 和3 min 制备样品,考察制粒时间对溶出的影响,见表1。制粒时间延长,溶出速率变慢,制粒时间3 min,样品与原研药溶出不相似,制粒时间2 min,样品与原研药溶出相似性较好,优选制粒时间为2 min。
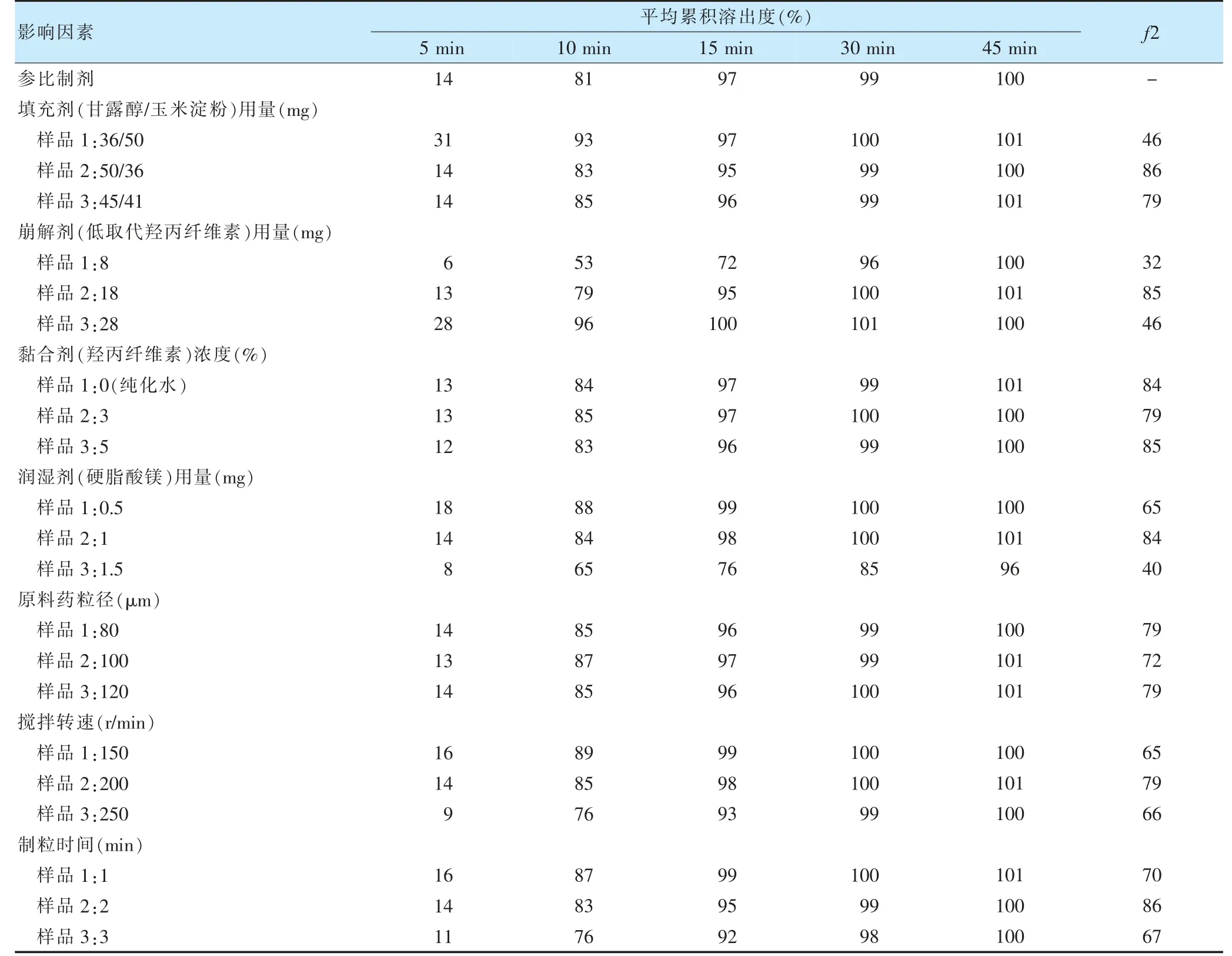
表1 各影响因素对西他沙星片溶出影响
2.1.7 工艺放大研究
本研究将西他沙星片从实验室2500 片批量放大到车间50 万片批量,所用制粒锅均为GHL 型,搅拌桨直径分别为16 cm 和100 cm,通过数学模型计算(见2.1.3 搅拌转速计算公式),确定放大搅拌转速为80 r/min。根据工艺研究结果,确定制粒搅拌转速(80 r/min)、制粒时间(2 min)为关键工艺参数,按照该工艺参数进行车间放大生产,考察放大产品与原研药溶出曲线相似性[25],结果见表2 及图1~4。结果表明车间放大产品与原研药在不同介质中的溶出曲线均相似[26-27],处方工艺可行,可用于指导西他沙星片商业化生产。
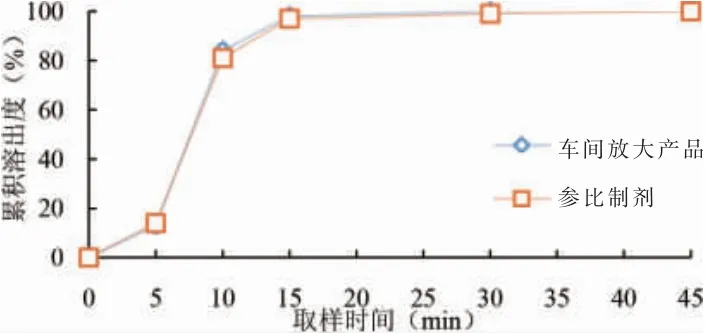
图1 放大产品与参比制剂在pH1.2 介质中溶出曲线比较
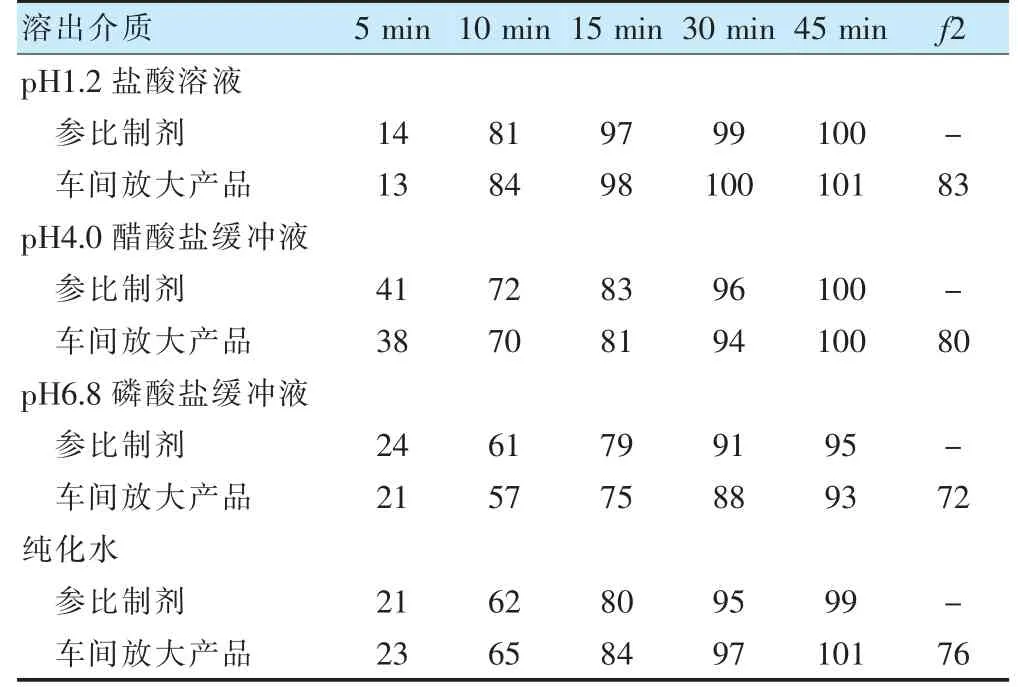
表2 车间放大产品与参与制剂在不同介质中平均累积溶出度比较(%)
3 讨论
近年来,国家大力推进仿制药一致性评价,对于口服固体制剂而言,填充剂、崩解剂、黏合剂、润滑剂、原料药粒径、制粒转速及制粒时间等因素均可影响产品的制备及溶出速率,应对其进行重点研究。本品通过对上述影响因素研究,最终确定了关键辅料及其用量:甘露醇50 mg/片,玉米淀粉36 mg/片,低取代羟丙纤维素18 mg/片,硬脂酸镁1 mg/片,黏合剂为3%的羟丙基纤维素水溶液;关键工艺参数为制粒转速80 r/min、制粒时间2 min。本品为薄膜衣片,所用包衣材料为欧巴代,其水溶性良好,包衣前后药物溶出无明显差异,因此未严格对其用量筛选,根据既往产品薄膜衣增重(2%~4%)经验,选择包衣增重3%。原料药粒径限度制定应基于原料粒径的正态分布,这对原料药的粉碎和混合提出了更高的要求,为保证不同批次的西他沙星原料粒径分布的一致性,应对原料药粒径制定内控质量标准。通过研究其他品种发现,不同厂家生产的同一品种体外溶出快慢不一,产品质量不一是导致临床疗效存在差异的重要因素[28]。

图2 放大产品与参比制剂在pH4.0 介质中溶出曲线比较

图3 放大产品与参比制剂在pH6.8 介质中溶出曲线比较

图4 放大产品与参比制剂在水介质中溶出曲线比较
在湿法制粒工艺中,产品处方组成,批量,制粒锅大小、几何构型,制粒转速,制粒时间等因素都会影响产品的质量,各种参数在制粒过程中存在着相互竞争机制,因此,无论产品从实验室向中试规模转化,还是从中试向商业化规模转化,工艺参数的确定都是一个难题,尤其是设备厂家、型号不同的情况下,如何将实验室产品进行车间放大转移是一个值得探讨的课题。本研究为放大工艺参数的确定提供了理论依据,降低了产品从实验室向车间放大转移的风险,对于口服固体制剂仿制药的开发具有指导意义。
