补肾生血药对化疗早期骨髓细胞的影响
2022-06-20王文娟贾春蓉岳竹君
巫 蓉 祝 微 王文娟 迟 莉 贾春蓉 岳竹君
1.首都医科大学中医药学院,北京 100069;2.首都医科大学附属北京天坛医院中医科,北京 100051;3.首都医科大学附属北京佑安医院病理科,北京 100069
化疗后骨髓抑制患者易出现感染、出血及贫血,不仅影响化疗进程,甚至威胁其生命[1-2]。因此,防治骨髓抑制是肿瘤治疗的重要内容。有研究表明,中医药在改善骨髓抑制方面优势明显[3]。既往研究中,中药干预结束时间多集中在环磷酰胺(Cyclophosphamide,CTX)造模后1~2 周[4-6],此时骨髓已进入恢复期。研究显示,CTX 化疗早期(化疗后5 d 内)外周血白细胞数明显下降,骨髓有核细胞数明显减少[7-8]。中药能否对化疗早期骨髓细胞产生影响,目前报道较少。补肾生血药为左归丸与当归补血汤合方,前期证实化疗后应用该药9~14 d 可明显促进骨髓细胞增殖,改善骨髓抑制[9-10]。本研究拟观察补肾生血药对化疗早期骨髓细胞的影响,以期为临床用药提供一定的参考。
1 材料与方法
1.1 实验动物
SPF 级雄性BALB/c 小鼠65 只,6~8 周龄,体重(20±2)g,由北京维通利华技术有限公司提供,动物生产许可证号:SCXK(京)2016-0006,使用许可证号:SYXK(京)2018-0003。本研究经首都医科大学实验动物伦理委员会批准(AEEI-2018-054)。
1.2 试剂与仪器
补肾生血药颗粒剂(北京康仁堂药业有限公司);JAK 激酶2(JAK kinase 2,JAK2)、信号转导及转录激活因子5(signal transduction and activator of transcription 5,STAT5)、磷酸化STAT5(phosphorylated-STAT5,P-STAT5)兔抗小鼠抗体(美国CST,货号:0011、0004、0015);β-actin 兔抗小鼠抗、辣根过氧化物酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司,批号:TA-09、ZB-2301);小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)、γ 干扰素(interferon-γ,IFN-γ)酶联免疫吸附试验试剂盒(北京金海科隅生物科技发展有限公司,批号:20190901);CTX(江苏盛迪医药有限公司,批号:18020825);重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)(厦门特宝生物工程股份有限公司,批号:201705B06);RIPA 裂解液(北京普利莱基因技术有限公司,批号:201907258620);Trizol(美国Invitrogen);cDNA 第一链合成试剂盒(康为世纪,批号:CW2569);SYBR FAST qPCR 试剂盒(美国KAPA Biosystems)。
1.3 研究方法
1.3.1 分组及干预 65 只小鼠按随机数字表法分为空白组、模型组、阳性对照组、补肾生血药高剂量组、补肾生血药低剂量组,每组13 只。预防给药5 d,补肾生血药高、低剂量组采用临床等效剂量的补肾生血药(47.0、23.5 g/kg)灌胃,其余组灌胃等量蒸馏水[10]。预防给药结束后,模型组、阳性对照组、补肾生血药高及低剂量组均腹腔注射环磷酰胺(100 mg/kg),空白组腹腔注射等量生理盐水,连续3 d[10]。同时进行干预用药,阳性对照组皮下注射rhG-CSF(30 μg/kg),其余组与预防给药阶段相同,连续5 d[10]。以外周血白细胞数降低为造模成功[11]。干预结束后,颈椎脱臼处死小鼠,收集骨髓细胞[7]。
1.3.2 骨髓细胞形态观察 取各组100 μl 骨髓细胞悬液(约1×107个细胞),除去上清液后用2.5%戊二醛固定,再经1%锇酸固定,制作超薄切片,透射电子显微镜下观察骨髓细胞超微结构。因透射电子显微镜样本观察批次及机器型号差异,不同组图片放大倍数稍有差异。
1.3.3 TNF-α、TGF-β、IFN-γ 含量检测 采用酶联免疫吸附试验检测,各组骨髓细胞悬液取上清,标准品孔中加入不同浓度标准品50 μl,样本孔中加入待测样本10 μl 及40 μl 稀释液;加入抗体100 μl,封闭并孵育1 h;重复洗涤5 次;加入底物A、B 各50 μl,避光孵育15 min 加入50 μl 终止液。采用酶标仪于450 nm 处测定OD 值。绘制标准曲线,计算样本中TNF-α、TGF-β、IFN-γ 含量。
1.3.4 JAK2、STAT5 的mRNA 表达情况检测 取各组骨髓细胞悬液1 ml,除去上清液后加入Trizol 吹打混匀。按试剂盒说明书操作,提取总RNA,测定RNA 浓度及纯度,反转录成cDNA,进行实时荧光定量PCR,反应体系共20 μl,条件:95℃预变性10 min,95℃变性10 s、59℃退火延伸60 s,共45 个循环。引物序列见表1。β-actin 为内参,采用2-ΔΔCT法分析JAK2、STAT5 的mRNA 表达情况。

表1 引物序列
1.3.5 JAK2、STAT5 及P-STAT5 蛋白表达情况检测采用蛋白质印迹法,取各组骨髓细胞悬液1 ml,除去上清液加入RIPA 裂解液(含蛋白磷酸酶抑制剂)混匀,离心提取总蛋白,测定蛋白浓度。将样品加热变性,每孔上样量30 μg,依次进行聚丙烯酰氨凝胶电泳、转膜、封闭、一抗(β-actin 1∶5000,JAK2、STAT5、PSTAT5 均1∶1000)和二抗(IgG 1∶5000)孵育、显影、曝光。β-actin 为内参,采用Image J 软件分析JAK2、STAT5及P-STAT5 蛋白表达。
1.4 统计学方法
采用SPSS 22.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,比较采用t 检验;多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 五组骨髓细胞超微结构
空白组骨髓有核细胞分布密集,核膜、胞膜完整,细胞器结构清晰。模型组有核细胞稀少,见大量细胞碎片,其余各组有核细胞数不同程度增多,胞体减小,细胞器尚好。见图1。

图1 五组骨髓细胞超微结构
2.2 五组骨髓细胞TNF-α、TGF-β、IFN-γ 含量比较
模型组TNF-α、TGF-β、IFN-γ 含量高于空白组,差异有高度统计学意义(P <0.01)。补肾生血药高、低剂量组TNF-α、TGF-β、IFN-γ 含量低于模型组,补肾生血药高剂量组TGF-β、IFN-γ 含量低于补肾生血药低剂量组,差异有统计学意义(P <0.05 或P <0.01)。见图2。
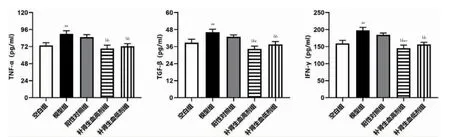
图2 五组骨髓细胞TNF-α、TGF-β、IFN-γ 含量比较
2.3 五组骨髓细胞JAK2、STAT5 的mRNA 表达水平比较
与空白组比较,模型组JAK2、STAT5 mRNA 表达下调;与模型组比较,补肾生血药高、低剂量组STAT5 mRNA 表达上调;与补肾生血药低剂量组比较,补肾生血药高剂量组JAK2 mRNA 表达下调,差异均有统计学意义(P <0.05 或P <0.01)。见图3。
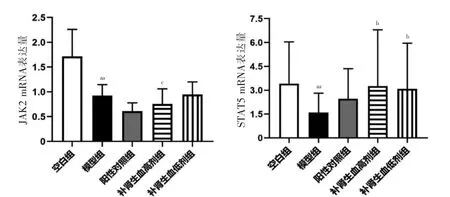
图3 五组骨髓细胞JAK2、STAT5 的mRNA 表达比较
2.4 五组骨髓细胞JAK2、P-STAT5、STAT5 蛋白表达水平比较
模型组JAK2、P-STAT5、STAT5 蛋白表达水平低于空白组,补肾生血药高、低剂量组JAK2、P-STAT5蛋白表达水平高于模型组,补肾生血药高剂量组P-STAT5 蛋白表达水平低于补肾生血药低剂量组,差异均有统计学意义(P <0.05 或P <0.01)。见图4~5。

图4 五组骨髓细胞JAK2、P-STAT5、STAT5 蛋白条带图
3 讨论
TNF-α、TGF-β、IFN-γ 为造血负调控因子,能通过多途径抑制骨髓造血,加速造血细胞凋亡[12-15]。TNF-α 直接抑制骨髓细胞分裂,诱导其凋亡;TGF-β 可于G1期阻断造血干细胞(hemopoietic stem cell,HSCs),抑制其增殖分化,诱导其凋亡;IFN-γ 与HSCs 受体结合,可抑制HSCs 自我更新和增殖。研究报道,化疗药可促进TNF-α、IFN-γ、TGF-β 分泌,抑制造血细胞增殖分化[16-17],与本研究结果一致。JAK2-STAT5 通路能介导多种造血因子的信号转导,参与造血细胞增殖、分化、凋亡,在骨髓造血、免疫调节方面发挥着重要作用[18-19]。JAK2 与红细胞生成相关;STAT5 活化后具有促细胞增生、抑制凋亡的作用。有研究报道,CTX 可下调骨髓细胞JAK2、STAT5 蛋白表达[20]。本研究结果显示,CTX 可下调JAK2、STAT5 mRNA 表达,提示化疗后JAK2-STAT5 通路抑制明显。本研究结果显示,补肾生血药能减轻骨髓细胞结构损伤,降低骨髓中造血负调控因子含量,上调JAK2-STAT5 通路分子表达,提示补肾生血药能减轻化疗早期骨髓细胞损伤,机制与降低造血负调控因子含量,正调控JAK2-STAT5 通路相关。

图5 五组骨髓细胞JAK2、P-STAT5、STAT5 蛋白表达比较(n=13)
