基于响应面的红曲色素液态发酵培养基优化
2021-12-22王芳慧张静王昌禄李贞景杨华刘欢欢
王芳慧,张静,王昌禄,李贞景,杨华,刘欢欢
(天津科技大学 食品工程与生物技术学院/省部共建食品营养与安全国家重点实验室,天津 300457)
红曲霉(Monascus)又名丹曲[1],是一种小型丝状腐生真菌,是目前世界上能产食用色素的重要微生物之一,在我国已有1000多年药食两用的历史,可促进消化和血液循环[2]。红曲色素作为一种安全、无毒的天然食用色素,是由多种物质组成的聚酮类混合物,属于红曲霉的次级代谢产物,目前已被鉴定的红曲色素多达上百种,其中研究最多的是6种醇溶性色素[3],包括2种红色素:红斑红曲胺(Rubropunctamine,R1)和红曲玉红胺(Monascorubramine,R2);2种黄色素:红曲素(Monascin,Y1)和红曲黄素(Ankaflavin,Y2);2种橙色素:红斑红曲素(Rubropunctatin,O1)和红曲玉红素(Monascorubrin,O2)[4-6]。红曲色素作为天然色素,相较于化学合成色素具有无毒副作用的优点,同时具有降胆固醇、降血脂、抗肿瘤等功能[7-9],在食品行业、医疗保健品及化妆品行业具有广阔的应用前景[10-11]。目前,红曲色素已被广泛应用于肉制品、调味品、酿酒等行业。随着红曲色素在各行业的推广,人们对其的需求量越来越大,提高红曲色素产量成为亟待解决的问题。
红曲霉发酵产红曲色素的传统工艺为固态发酵,操作简单,成本较低,但是卫生条件难以控制,菌种纯度低,劳动强度大[12-13]。与固态发酵相比,红曲液态发酵生长周期短,杂质少。发酵培养基是菌体生长和产物合成的基础,适宜的培养基配方可以使目标产物产量少,产品质量稳定[14-16],具有更大的优势,但是液态发酵红曲色素产量较低,使其发展受到大幅度提高,因此高效、准确的培养基优化方法就显得尤为重要。
响应面方法(RSM)是一种在单变量和多变量系统中寻求最优条件的有效统计方法,中心组合设计(CCD)实验是响应面分析法[17]中的一种,适用于多因素多水平实验,有连续变量存在,可作为一种优化方法。CCD实验是将体系的响应值作为一个或多个因素的函数,用图形技术将这种函数关系表示出来,以供实验设计中选择最优化条件。本实验运用Plackett-Burman实验(PB实验)[18]筛选对响应值具有显著影响的因素后,即用CCD实验对红曲霉发酵培养基进行优化,以提高红曲色素产量。
续 表

续 表
续 表
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
红曲霉M-7:保藏于天津科技大学食品科学与工程学院发酵食品与微生物资源开发研究室。
1.1.2 试剂
琼脂粉、可溶性淀粉:分析纯,北京索莱宝生物科技公司;甲酸、乙腈:色谱纯,天津康科德有限公司;无水乙醇:分析纯,天津康科德有限公司;土豆、大米粉:食品级,市售;其余试剂:分析纯,购自天津市化学试剂一厂。
1.1.3 培养基
固体培养基:土豆葡萄糖培养基(PDA)。
种子培养基:大米粉30 g/L,NaNO33 g/L,KH2PO42.5 g/L,MgSO4·7H2O 1 g/L,pH自然。
基础发酵培养基:葡萄糖50 g/L,(NH4)2SO45 g/L,KH2PO44 g/L,MgSO4·7H2O 0.5 g/L,MnSO4·H2O 0.03 g/L,ZnSO4·7H2O 0.01 g/L和FeSO4·7H2O 0.01 g/L,pH 6。
以上培养基均在0.1 MPa,在121 ℃条件下湿热灭菌20 min。
1.2 仪器与设备
ZQWY-200N型振荡培养箱 上海知楚仪器有限公司;TDZ5-WS型低速多管架自动平衡离心机 长沙高新技术产业开发区湘仪离心机仪器有限公司;LRH-250-GⅡ型恒温培养箱 广东省医疗器械厂;KQ8200B型超声波清洗机 昆山市超声仪器有限公司;Agilent 1200型高效液相色谱仪 安捷伦科技有限公司。
1.3 菌株培养与发酵
固体培养:菌种划线接种于固体斜面后,在28 ℃条件下培养4~5 d。
种子培养:用10 mL无菌水洗斜面得孢子悬浮液,移取1 mL至装有40 mL种子培养基的250 mL三角瓶中,置于30 ℃,180 r/min的摇床中培养48 h。
发酵培养:将种子液转接到发酵培养基中,接种量为10%,装液量为40 mL/250 mL,摇床温度30 ℃,转速180 r/min,培养4 d。
1.4 分析方法
菌体量的测定:取10 mL发酵液在3800 r/min条件下离心15 min,弃上清液,将菌体沉淀于60 ℃烘箱烘干至恒重后称重,计算菌体量。
红曲色素含量的测定:红曲色素含量的测定采用高效液相色谱法,色谱柱为ZORBAX SB-C18,流动相A为超纯水(含0.1%(V/V)甲酸),流动相B为乙腈(色谱纯),流速为1 mL/min,进样量为20 μL,柱温为25 ℃。提取方法:取发酵液10 mL于离心管中,在3800 r/min条件下离心15 min,弃上清液,加入5 mL 70%(V/V)乙醇混匀后(此处计为浓缩2倍),置于60 ℃水浴锅中水浴1 h,水浴期间不定时上下翻动。水浴结束后超声30 min,以3800 r/min离心15 min,得红曲色素乙醇溶液。根据浓度(X)与峰面积(Y)建立标准曲线并计算色素含量(mg/L)。
1.5 实验设计方法
1.5.1 PB实验
使用Minitab 18软件进行N=21的PB实验设计,对可用于发酵培养基的2种碳源和5种氮源共7个因子进行研究,以葡萄糖和淀粉取代原始培养基中的葡萄糖组分,以硝酸钠、硫酸铵、尿素、氯化铵和硝酸铵取代硫酸铵组分。各因子分别取高(1)和低(-1)两个水平。以6种醇溶性红曲色素(R1、R2、Y1、Y2、O1、O2)产量和菌体量(DCW)为响应值,仿行数为2。各因子水平设置见表1。

表1 PB实验各因子水平值Table 1 The factors and levels of PB experiment g/L
1.5.2 最陡爬坡实验设计
根据PB实验结果,选择对7种响应值影响显著的因素进行下一步优化,并以此作为CCD实验中设置中心水平的参考。各组因子水平设计见表2,每组3个平行。

表2 最陡爬坡实验中各因子水平值Table 2 The level value of each factor of the steepest climbing experiment g/L
1.5.3 CCD实验设计
以最陡爬坡实验的最优条件为参考,综合考虑6种红曲色素产量和菌体量确定CCD实验中各因素的中心值,使用Minitab 18软件设计实验。各因子水平见表3。将各组6种色素产量和DCW数据输入软件后,使用响应优化器功能对所有响应值进行优化,得到最适培养基结果,发酵验证。

表3 CCD实验各因子水平值Table 3 The factors and levels of CCD experiment g/L
2 结果与分析
2.1 PB实验结果
对发酵培养基的2种碳源——葡萄糖、淀粉和5种氮源——硝酸钠、硫酸铵、尿素、氯化铵、硝酸铵进行显著因素筛选,考察其对6种红曲色素产量及DCW的影响,发酵结果见表4。用Minitab 18对实验结果进行统计学分析,分析结果见表5。

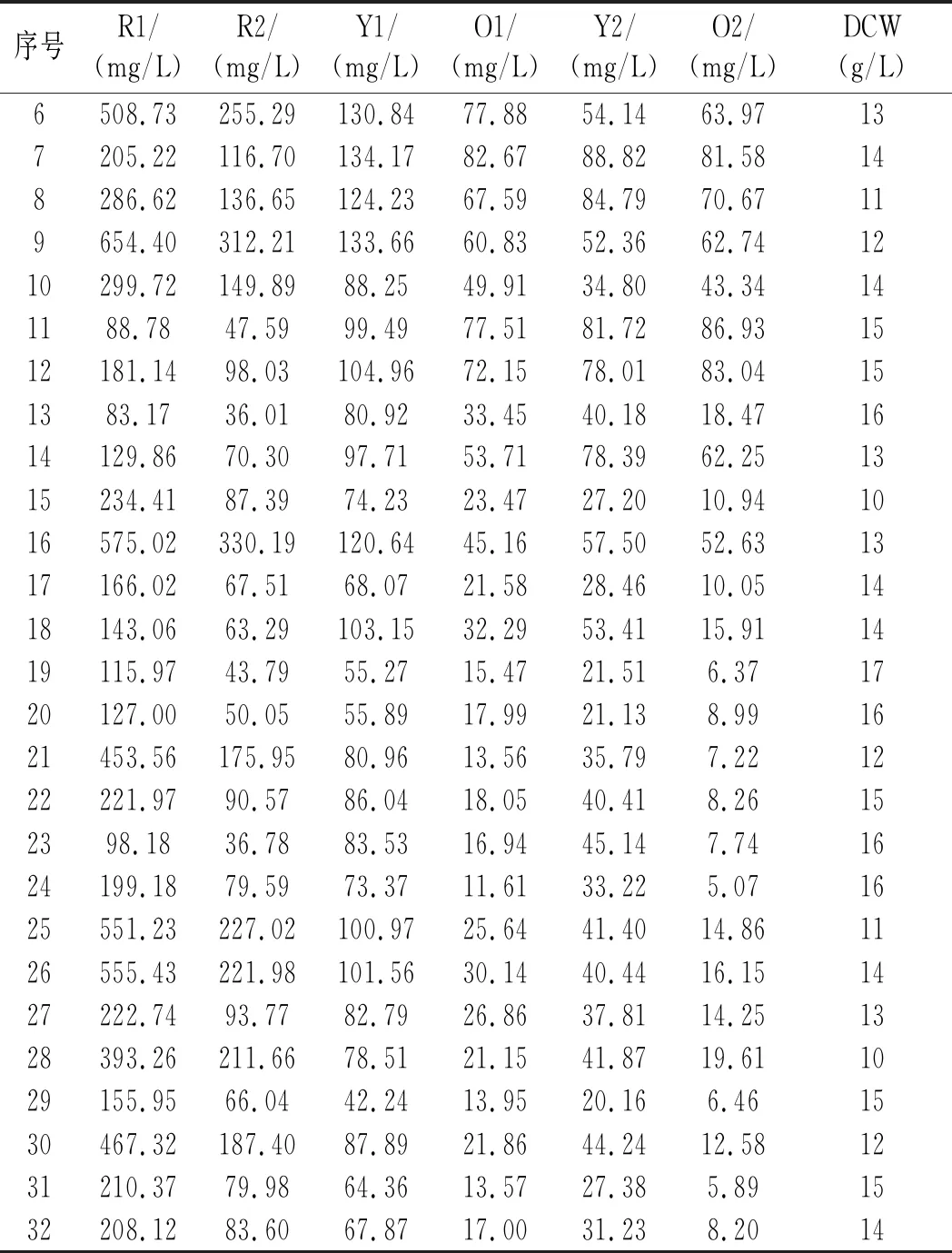
表4 PB实验结果Table 4 The PB experimental results
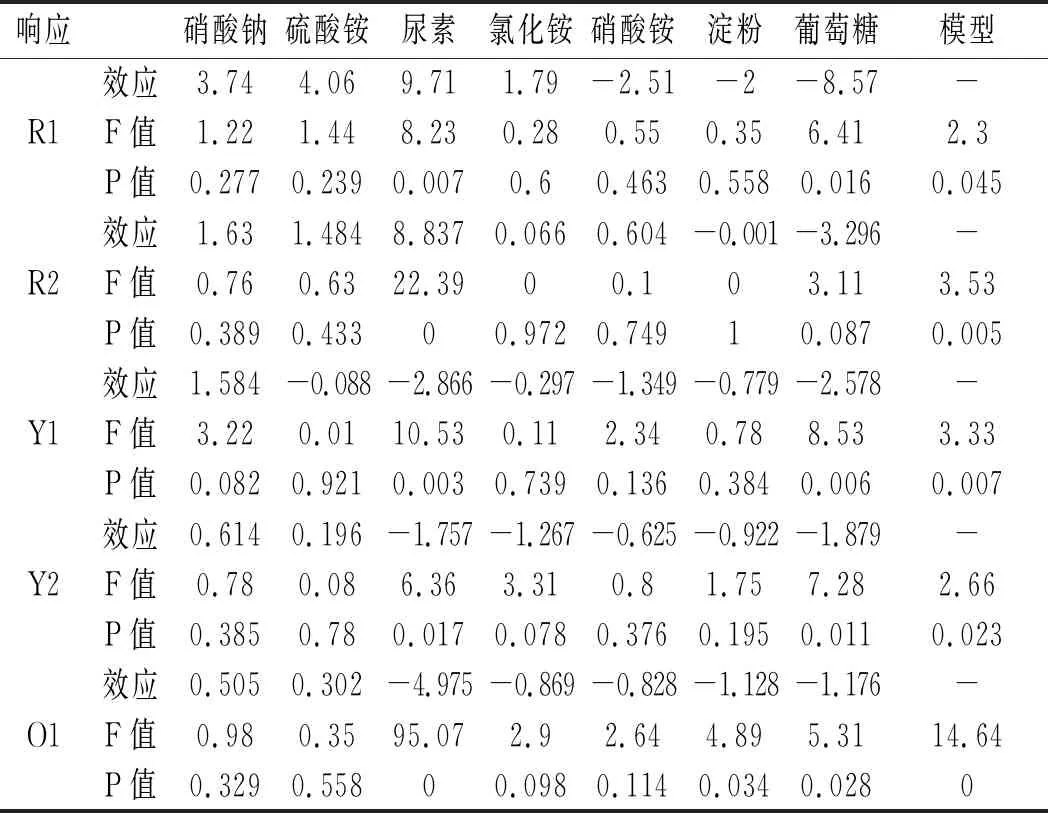
表5 PB实验中各因素效应值Table 5 The effect values of various factors of the PB experiment
由表5可知,尿素对7种响应值均有显著影响,对红曲色素R1、R2表现为正效应,其余为负效应;葡萄糖除了对红曲色素O2和DCW的影响不显著外,对其他5种响应值的影响均显著,且对所有响应值均表现为负效应;淀粉对红曲色素O1、O2有显著影响,表现为负效应;硝酸钠对红曲色素Y1有显著影响,表现为正效应;氯化铵对红曲色素Y2有显著影响,表现为负效应;在5种氮源中,硫酸铵和硝酸铵对7种响应值的影响均不显著,接下来的实验质量分数均取1 g/L。
2.2 最陡爬坡实验
在PB实验的基础上,对影响显著的5个因素——尿素、硝酸钠、氯化铵、葡萄糖和淀粉进行进一步优化,结合7个响应值各方面因素确定最陡爬坡实验各因素水平,实验结果见表6。

表6 最陡爬坡实验结果Table 6 The steepest climbing experimental results
由表6可知,第3组实验产红曲色素总量最高。与第3组相比,第4组色素产量较低,但菌体量较高。综合考虑7个响应值,同时参考PB实验中5个因子正负效应确定葡萄糖、淀粉、尿素、硝酸钠、氯化铵在CCD实验中的中心值分别为42.5,11,0.55,0.7,1.1 g/L。
2.3 CCD实验
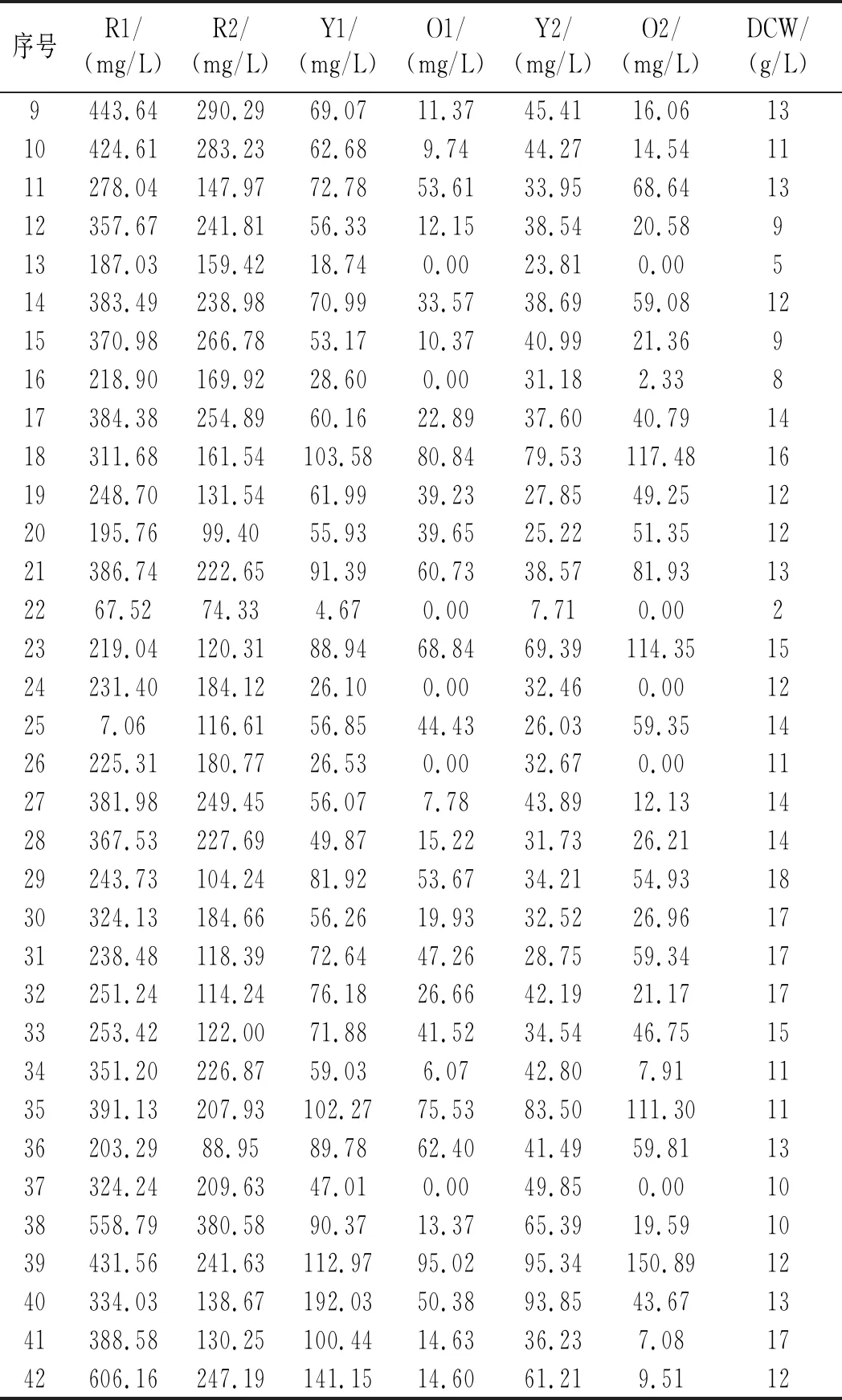
使用Minitab 18设计N=32的5因素5水平的CCD实验,其中包括16个立方点实验,6个中心点实验和10个轴点实验,实验结果见表7。

表7 CCD实验结果Table 7 The CCD experimental results
利用软件Minitab 18对实验数据进行二次多项回归分析并绘制响应面等高曲线图,分析因素间的交互作用与各因素对各响应值的影响。以红曲色素R1、R2、Y1、Y2、O1、O2与尿素、淀粉的等值线图为例进行分析(因素数和响应值较多,此处不逐一列出),见图1。尿素与淀粉之间的交互作用对红曲色素R1、R2、Y2均不显著,而对Y1显著。在其他条件都固定在最佳水平时,淀粉含量在6~16 g/L时4种色素均能达到最大值;对于尿素这一成分,两种红色素的需求量较低,在0~0.5 g/L之间能达到最高产量,而两种黄色素对其需求较高,在0.4~0.7 g/L之间才能达到最高产量。

图1 R1、R2、Y1、Y2与尿素、淀粉的等值线图Fig.1 The isograms of R1,R2,Y1,Y2 with urea and starch
由于响应值和因素均较多,需要整体考虑各响应值高低确定各因素水平,故采用响应优化器功能对所有响应值进行优化,得到各因素推荐浓度(葡萄糖35 g/L、淀粉16 g/L、尿素0.8 g/L、硝酸钠1 g/L、氯化铵1.6 g/L)和7种响应值预测值,经过发酵验证(3个平行),与对照组进行对比,见表8。

表8 响应优化器优化结果预测与实际产量对比Table 8 Comparison of optimization results prediction and actual yield of the response optimizer
由表8可知,响应优化器预测结果与实际结果较符合,但总产量与预测值仍有一定差距,可能是微生物液态发酵的不稳定性导致,而红曲色素作为次级代谢产物,其合成又受到多方面因素影响。与对照组相比,两种红色素产量显著上升,占色素总产量的76%,该培养基配方对生产单一红曲红色素提供了一定的参考;黄色素和橙色素产量显著下降,这可能是由于培养基中添加了尿素,尿素被红曲霉代谢过程中产生的蛋白酶分解为多种氨基酸,使橙色素转换为红色素[19]。Martinkova等[20]研究表明,红曲橙色素具有一定的胚胎致畸性和毒性,在生产中应降低其产量,本实验中,两种橙色素仅占色素总产量的7%,在实际生产中有一定意义;菌体量的提高也有利于色素总产量的增加,本实验中色素总产量提高了31%。
3 讨论
培养基组成对红曲色素的种类和产量有很大影响,其中,碳源直接为菌体的生长和繁殖提供能量,浓度高低影响着细胞渗透压及微生物代谢水平;氮源控制着红曲霉菌丝体的生长,浓度过高可能使菌丝体生长过度并缠绕成球,影响营养物质和氧气传递,不利于色素合成,所以合适的碳、氮源选择及配比对菌体生长与色素合成尤为重要。
相较于传统的利用线性数学模型设计试验的正交试验,响应面采用非线性模型,可以近似构造一个具有明确表达形式的多项式来表达隐式功能函数,从而找到整个区域上因素的最佳组合和响应值的最优值,而且可以同时优化多种响应值。本实验采用响应面法对红曲发酵培养基进行优化,使色素总产量提高了31%,其中两种红色素产量占总色素的76%,该结果可为色素的工业化生产提供一定理论参考。
