微型空化器内引入气流强化壳聚糖降解的效果研究
2021-12-22曹艳黄崇煌黄承都任仙娥黄永春
曹艳,黄崇煌,黄承都,任仙娥,黄永春*
(1.广西科技大学 生物与化学工程学院,广西 柳州 545006;2.广西糖资源绿色加工重点实验室,广西 柳州 545006)
壳聚糖(chitosan)是甲壳素(chitin)脱乙酰化产物,具有无毒无害、生物相容性好、抗菌抑菌和抗氧化性良好等优点,在食品加工、环境保护、生物医药、化工等诸多领域有着广泛的应用前景[1-3]。低聚壳聚糖是壳聚糖的降解产物,相比高分子量的壳聚糖具有更好的溶解性和优越的功能特性,例如:低分子量的壳聚糖更易被人体吸收而广泛用于食品添加剂和保健品行业[4],另外,相对分子量低的壳聚糖具有更优的抗菌和抗氧化性能而在食品保鲜领域中发挥着重要作用[5]。由此可见,低聚壳聚糖的制备十分关键,而壳聚糖的降解是获得低聚壳聚糖的一种有效途径。
水力空化是一种应用广泛的绿色新技术[6-7],具有操作简单、成本低、能耗低等优点,近年来广泛用于壳聚糖的降解研究[8-9]。水力空化对壳聚糖的降解作用主要源于“空化效应”产生的物理(机械剪切)效应及化学(自由基)效应。朱新锋等[10]发现剪切效应主要是引起β-(1,4)-糖苷键发生断裂,增大剪切力有利于该键的断裂。Yan等[11]对水力空化降解壳聚糖的机理进行了研究,指出自由基化学效应是随机切割糖苷键,且是引起壳聚糖降解的主要因素。因此,增强任何一种效应都会对壳聚糖的降解过程起到强化作用。
本课题组的前期研究表明[12],水力空化能够促进壳聚糖的有效降解,但降解速率较慢。杨锋等[13]研究了不同气体对涡流空化降解壳聚糖的影响,结果表明空气对涡流空化降解壳聚糖有明显的促进作用。本文尝试通过在微型文丘里管内引入空气气流来增强空化的物理及化学效应,探究壳聚糖降解过程的强化机制,寻求一种能够实现壳聚糖高效降解的新途径。
1 材料和方法
1.1 材料和试剂
壳聚糖(工业级,脱乙酰度90%):深圳中发源生物科技有限公司;冰乙酸和三水合乙酸钠:均为分析纯,西陇科学股份有限公司。
1.2 主要仪器与设备
微型空化器 自制;WT300-1JB微型齿轮泵 兰格恒流泵有限公司;BT100S蠕动泵 保定雷弗流体科技有限公司;PHS-3E型pH计 上海仪电科学仪器股份有限公司;乌氏黏度计(0.58 mm) 合肥申谊玻璃制品有限公司;HSVision EoSens Cube 7高速相机 德国HSVision公司;Nicolet 6700红外光谱仪 美国Thermo Fisher公司。
1.3 实验装置及原理
本研究采用的实验装置示意图见图1。

图1 实验装置示意图Fig.1 The schematic diagram of experimental devices注:1为恒温水浴锅;2为烧杯;3和4为齿轮泵;5为空化器;6为蠕动泵;7为高速相机;8为电脑;9为光源;10和11为压力表。
采用T型进料的方式,两股壳聚糖溶液分别经微型齿轮泵输送,通过蠕动泵引入一定量的空气进入溶液,两股气-液混合流体在T型入口端碰撞混合成一股流体进入微型文丘里管的空化段,发生空化,空化流体(含有大量空化泡的气-液两相混合流体)形成并在压力恢复段发生空化泡的溃灭,壳聚糖发生降解,降解后的溶液回收至原烧杯中,进行循环降解。
本实验的空化发生器选取文丘里管,其结构示意图见图2。两个入口端的直径均是5 mm,出口端的直径是6 mm;文丘里管的入口锥角是30°,出口锥角是21°;喉部直径是0.5 mm,喉部长1.5 mm。
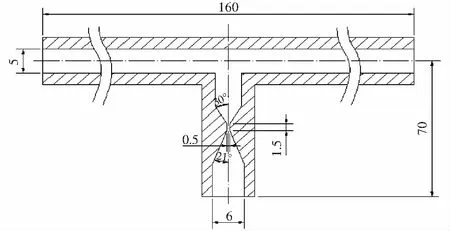
图2 水力空化器的结构示意图Fig.2 The schematic diagram of hydraulic cavitator注:图中标注尺寸的单位为mm。
在流体输送稳定后,采用CCD高速相机观测和记录气-液两相流体流经空化段时的流动状态,结果见图3。

图3 气-液两相流体流经空化段时的流动状态图Fig.3 The flow state diagram of gas-liquid two-phase fluid flowing through cavitation section
由图3可知,当引入的空气泡通过喉部到扩径段时,因压力的减小,瞬间被撕裂形成大量微小的空气泡,当气泡完全通过喉部时,产生的气泡群范围最大,流体湍动也最剧烈。
1.4 方法
1.4.1 实验方法
以乙酸-乙酸钠缓冲溶液为溶剂,壳聚糖为溶质,配制一定浓度的壳聚糖溶液。取150 mL壳聚糖溶液在反应温度下预热30 min后,同时开启两个齿轮泵输送流体,然后开启蠕动泵输入一定量的空气,通过调节齿轮泵的转速来控制入口压力的大小,在设定条件下反应一段时间后,测定壳聚糖原溶液及降解产物的特性黏度,探究不同因素对壳聚糖降解效果的影响。实验分别选取蠕动泵转速为30,60,90,120,150 r/min;入口压力为0.1,0.2,0.3,0.4,0.5 MPa;降解温度为30,40,50,60,70 ℃;降解时间为10,30,50,70,90 min;壳聚糖原溶液浓度为0.1,0.3,0.5,0.7,0.9 g/L;壳聚糖分子量为100,500,1000,2000,5000 kDa;溶液pH为2.6,3.8,4.2,4.6,5.0。
1.4.2 特性黏度下降率的计算
以特性黏度下降率(η)来反映壳聚糖的降解效果,计算公式如下:
式中:[η]0、[η]1分别表示壳聚糖降解前、后溶液的特性黏度,mL/g。其中特性黏度[14]的定义如下:
式中:ηsp(ηsp=ηr-1)为增比黏度,表示高分子溶液黏度大于溶剂黏度的相对增量,ηr为相对黏度,是用同一支黏度计测定的壳聚糖溶液流出时间(t)与纯溶剂流出时间(t')的比值,计算公式如下:
1.4.3 黏均分子量的计算[15]
壳聚糖的黏均分子量(Mη)可根据Mark-Houwink方程来确定,计算公式如下:
式中:K(K=1.635×10-30×DD14)为经验常数,cm3/g,其中DD为壳聚糖的脱乙酰度;Mη为黏均分子量,kDa;α为经验常数,计算式为α=-1.02×10-2×DD+1.82;[η]为特性黏度,mL/g。
1.4.4 红外光谱测定[16]
采用KBr压片法制备壳聚糖固体样品,在波数为400~4000 cm-1范围内对壳聚糖原料及降解产物的样品进行红外光谱分析。
2 结果与分析
2.1 不同因素对壳聚糖降解效果的影响
2.1.1 蠕动泵转速的影响
空气通过蠕动泵输送,不同蠕动泵转速对壳聚糖降解效果的影响在一定程度上反映了不同气流量对壳聚糖降解效果的影响。本实验选取的条件为:入口压力0.4 MPa,温度40 ℃,降解时间50 min,壳聚糖溶液浓度0.3 g/L,分子量1000 kDa,溶液pH 4.6,在不同蠕动泵转速下进行实验,考察蠕动泵转速对壳聚糖降解效果的影响,结果见图4。

图4 蠕动泵转速对壳聚糖特性黏度下降率的影响Fig.4 The effect of rotating speed of peristaltic pump on the reduction rate of characteristic viscosity of chitosan
由图4可知,当蠕动泵转速从30 r/min增大到150 r/min时,壳聚糖的特性黏度下降率先增大后略有降低,当蠕动泵转速为120 r/min时的特性黏度下降率最大。这是因为蠕动泵转速越大,输入体系的空气量越大,形成的空气泡越多。当空气泡通过文丘里管的空化段时,因压力变化促使空气泡瞬间产生大量的微小气泡(见图3),增加了溶液中空化核的数量,此时会有更多的水蒸气进入空化泡中,空化泡溃灭产生的瞬时高温、高压会促使水分子分解产生更多的羟自由基,强化了空化的化学效应[17-18]。同时,引入的空气量越大,空气泡通过喉部到扩径段处引起的流场扰动越大,流体间的机械剪切作用力增大,促进了壳聚糖的降解。但当蠕动泵转速增大到一定程度时,引入的空气量过大,会阻碍壳聚糖溶液的流动,一定时间内壳聚糖溶液的循环量和循环次数减少,从而使壳聚糖的特性黏度下降率略有降低。为了能在高效范围内进行壳聚糖的降解研究,本实验选择蠕动泵转速为120 r/min。
2.1.2 入口压力的影响
本实验选取的条件为:蠕动泵转速120 r/min,温度40 ℃,降解时间50 min,壳聚糖溶液浓度0.3 g/L,分子量1000 kDa,溶液pH 4.6,在不同入口压力条件下进行实验,考察入口压力对壳聚糖降解效果的影响,结果见图5。

图5 入口压力对壳聚糖特性黏度下降率的影响Fig.5 The effect of inlet pressure on the reduction rate of characteristic viscosity of chitosan
由图5可知,随着入口压力的增大,引入气流和不引入气流两种条件下的壳聚糖特性黏度下降率均逐渐增大,且引入气流条件下的特性黏度下降率高于不引入气流条件下的特性黏度下降率。这是因为入口压力越大,流体的流动速度越大,空化数(Cv)越小,空化数是反映空化过程强弱的无因此准数,空化数越小表示空化效果越好[19]。在相同的压力下,引入气流会增加溶液中空化核的数量,空化泡数量增加,空化泡溃灭几率增大,从而增强空化效应。考虑到入口压力越大,对管路的耐压和密封性能要求更高,安全性能降低且能耗增大,因此,本实验选择在0.4 MPa压力条件下进行其他单因素实验。
2.1.3 溶液温度的影响
本实验选取的条件为:蠕动泵转速120 r/min,入口压力0.4 MPa,降解时间50 min,壳聚糖溶液浓度0.3 g/L,分子量1000 kDa,溶液pH 4.6,在不同温度下进行实验,考察温度对壳聚糖降解效果的影响,结果见图6。
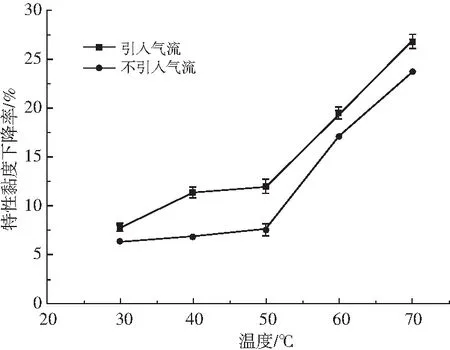
图6 温度对壳聚糖特性黏度下降率的影响Fig.6 The effect of temperature on the reduction rate of characteristic viscosity of chitosan
由图6可知,壳聚糖的特性黏度下降率受温度的影响较大,当温度从30 ℃增大到70 ℃时,引入气流条件下的特性黏度下降率从7.75%增大到26.73%,不引入气流条件下的特性黏度下降率从6.41%增大到23.69%。可以从以下几个方面来分析:(1)温度越高,液体的饱和蒸气压越大,空化数越小,空化更易发生;(2)随着温度的升高,溶液的黏度降低,空化泡更易生长和发生溃灭;(3)温度的升高会使得溶液中的氢键和盐键发生断裂,位阻减小,从而使得糖苷键更易发生断裂[20];(4)气流的引入增加了溶液中的空化核,提高了发生空化的几率。综上所述,温度越高越有利于壳聚糖的降解,但从节能降耗的角度考虑,温度不宜过高,本实验选择降解温度为40 ℃来进行其他单因素实验。
2.1.4 降解时间的影响
本实验选取的条件为:蠕动泵转速120 r/min,入口压力0.4 MPa,温度40 ℃,壳聚糖溶液浓度0.3 g/L,分子量1000 kDa,溶液pH 4.6,控制壳聚糖降解不同的时间,考察时间对壳聚糖降解效果的影响,结果见图7。

图7 时间对壳聚糖特性黏度下降率的影响Fig.7 The effect of time on the reduction rate of characteristic viscosity of chitosan
由图7可知,随着降解时间的延长,引入气流和不引入气流两种条件下壳聚糖的特性黏度下降率均呈明显的上升趋势。当降解时间从10 min延长到90 min时,引入气流时的特性黏度下降率从4.72%增大到21.53%,不引入气流时的特性黏度下降率从2.41%增大到10.84%,分别增大了3.56倍和3.50倍,增幅都较大,说明时间对壳聚糖的降解过程有明显的影响,时间越长,糖苷键被作用的次数越多,更易发生断裂,壳聚糖的降解效果越好。另外,当时间分别为10 min和90 min时,引入气流较不引入气流时的特性黏度下降率分别提高了0.96倍和0.99倍,说明引入气流对壳聚糖的降解有明显的促进作用。
2.1.5 壳聚糖溶液浓度的影响
本实验选取的条件为:蠕动泵转速120 r/min,入口压力0.4 MPa,温度40 ℃,降解时间50 min,分子量1000 kDa,溶液pH 4.6,在不同壳聚糖溶液浓度下进行实验,考察浓度对壳聚糖降解效果的影响,结果见图8。

图8 浓度对壳聚糖特性黏度下降率的影响Fig.8 The effect of concentration on the reduction rate of characteristic viscosity of chitosan
由图8可知,引入气流和不引入气流两种条件下的特性黏度下降率均随壳聚糖溶液浓度的增大而降低,且引入气流条件下的特性黏度下降率下降得更快。这是因为壳聚糖的降解是化学效应和物理(机械剪切)效应共同作用的结果,一方面,随着浓度的增大,溶液的黏度增大,表面张力增大,空化泡的生长和溃灭受到抑制,减少了空化自由基的产生,在一定程度上削弱了空化化学效应;另一方面,溶液黏度的增大会削弱流体间的机械剪切作用,导致受机械剪切作用而发生断裂的壳聚糖数量减少,从而削弱空化机械效应[21]。因此,溶液黏度的增大不利于壳聚糖的降解。另外,溶液黏度会对气流引入产生影响,溶液黏度越大,气流引入的阻力越大,进气量减少,从而减少空化核的产生数量,削弱了空化效应,所以会出现在引入气流条件下的特性黏度下降率下降得更快。
2.1.6 壳聚糖分子量的影响
本实验选取的条件为:蠕动泵转速120 r/min,入口压力0.4 MPa,温度40 ℃,降解时间50 min,壳聚糖溶液浓度0.3 g/L,溶液pH 4.6,在不同壳聚糖分子量条件下进行实验,考察分子量对壳聚糖降解效果的影响,结果见图9。

图9 分子量对壳聚糖特性黏度下降率的影响Fig.9 The effect of molecular weight on the reduction rate of characteristic viscosity of chitosan
由图9可知,当壳聚糖分子量从100 kDa增大至5000 kDa时,引入气流和不引入气流两种条件下的特性黏度下降率均增大,且前者较后者的特性黏度下降率增大的趋势更强。这是由于随着壳聚糖分子量的增大,溶液的黏度增大,空化泡的生长和溃灭受到抑制,削弱了空化的化学效应,但是分子量越大,壳聚糖的分子链越长,更容易发生链的断裂,即使因黏度增大而有所削弱的空化效应也能促进长链壳聚糖的有效降解。另一方面,壳聚糖的分子链越长,越容易受到机械剪切力作用而发生断裂,所以会出现壳聚糖的特性黏度下降率随分子量增大而增大的现象。当有气流引入时,一方面可产生更多的空化核,强化空化的化学效应;另一方面,空化泡溃灭产生瞬时高温、高压及强烈的冲击波和微射流,使流场发生扰动,在微尺度的受限空间内,流体的湍动更为剧烈,大大增强了机械剪切效应。空化的化学和机械效应都对高分子量的长链壳聚糖作用更强[22],所以会出现有气流引入时的壳聚糖特性黏度下降率受分子量影响更大的现象。
2.1.7 pH的影响
本实验选取的条件为:蠕动泵转速120 r/min,入口压力0.4 MPa,温度40 ℃,降解时间50 min,壳聚糖溶液浓度0.3 g/L,分子量1000 kDa,在不同溶液pH下进行实验,考察pH对壳聚糖降解效果的影响,结果见图10。

图10 pH对壳聚糖特性黏度下降率的影响Fig.10 The effect of pH on the reduction rate of characteristic viscosity of chitosan
由图10可知,溶液pH对壳聚糖的降解有一定影响。随着pH的增大,壳聚糖的特性黏度下降率出现先略减小再增大然后又下降的趋势。分析其原因可知,壳聚糖降解首先是酸催化反应,当pH较低(pH为2.6~3.8)时,酸催化反应起主导作用,溶液pH减小有利于壳聚糖的溶解和降解。当pH较高(pH为4.2~5.0)时,溶液的酸性条件较弱,不利于壳聚糖的溶解和降解,而且较高的pH会抑制自由基的生成,从而削弱空化效应。当pH从3.8增大到4.2时,溶液中阴离子浓度随H+浓度的减少而减少,形成的盐键减少,使得糖苷键断裂的位阻减小,从而提高了壳聚糖的降解速率。
2.2 黏均分子量分析
以浓度(c)为横坐标,增比黏度与浓度的比值(ηsp/c)为纵坐标作图,采用外推法[23]获得了壳聚糖原料及其降解产物的黏均分子量,见图11。

图11 c与ηsp/c的关系图Fig.11 The relationship diagram between c and ηsp/c
直线的截距(浓度c为0 g/mL处的数据)即为特性黏度数。由图11可知,壳聚糖原料、不加气降解产物及加气降解产物的特性黏度分别为667.39,590.06,560.62 mL/g。根据Mark-Houwink方程计算得出壳聚糖原料、不加气及加气降解产物的黏均分子量分别是663.8,579.1,547.1 kDa,说明水力空化能有效降解壳聚糖。加气相比不加气条件下壳聚糖降解产物的黏均分子量下降了5.5%,说明引入气流能够进一步促进壳聚糖的降解。
2.3 红外光谱分析
课题组前期研究结果表明,水力空化条件下壳聚糖降解产物的结构未发生变化。故本研究只对有气流引入条件下壳聚糖原料及其降解产物进行了红外光谱分析,实验结果见图12。

图12 壳聚糖降解前后的红外吸收光谱图Fig.12 The infrared absorption spectra of chitosan before and after degradation
由图12可知,壳聚糖原料及其降解产物的特征吸收峰的位置基本没有发生变化。壳聚糖的特征吸收峰有酰胺Ⅰ、Ⅱ和Ⅲ谱带特征吸收峰[24]、环伸缩振动的特征吸收峰和壳聚糖主链环状结构上的C-H伸缩振动吸收峰。壳聚糖原料的这些特征吸收峰分别位于1637,1597,1321,897,2927 cm-1处,而壳聚糖降解产物的这些特征吸收峰分别位于1643,1599,1319,901,2927 cm-1处。由此可见,这些特征吸收峰的位置基本未发生变化,说明降解过程中壳聚糖分子的酰胺结构和环状结构均没有被破坏。综上分析可知,引入气流强化壳聚糖的降解仍然是β-(1,4)-糖苷键断裂引起的,不会引起壳聚糖基本结构的变化,也进一步说明β-(1,4)-糖苷键是壳聚糖中最薄弱的化学键[25],只要能促进该化学键的断裂即可强化壳聚糖的降解过程。
3 结论
本文探究了气流引入对壳聚糖降解过程的影响规律。研究结果表明,适宜的气流(当蠕动泵转速为120 r/min)能够较好地促进壳聚糖的降解;入口压力的增大、溶液温度的升高、降解时间的延长、溶液浓度的减小或选用分子量大的壳聚糖原料都有利于促进壳聚糖的降解;溶液pH对壳聚糖的影响较为复杂,当pH为4.2时的降解效果最好。上述实验均表明,有气流引入相比无气流引入时的壳聚糖降解效果更好。当蠕动泵转速为120 r/min,壳聚糖原溶液浓度为0.3 g/L,分子量为1000 kDa,pH为4.6,温度为70 ℃,入口压力为0.4 MPa,降解时间为50 min时,壳聚糖的降解效果最明显,特性黏度下降率为26.72%,同等条件下无气流引入时的特性黏度下降率为23.69%。黏均分子量和红外光谱的分析结果表明,引入气流能够进一步强化壳聚糖的降解,且气流的引入不会改变壳聚糖降解产物的结构。本文为低聚壳聚糖的制备及其在食品领域的应用提供了参考依据。
