红曲黄色素的多样性及产品标准的讨论
2019-01-14张薄博管宏伟陈磊黄涛许赣荣吴振强
张薄博,管宏伟,陈磊,黄涛,许赣荣*,吴振强
1(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 2(华南理工大学 生物科学与工程学院,广东 广州,510006)
食品着色剂(色素)是食品工业不可或缺的食品添加剂之一。食用色素通常分为化学合成色素和生物色素。天然的生物色素中,红曲色素(包括红曲米色素及红曲红色素)是世界上最成功的利用微生物发酵法大规模生产的、并广泛应用于食品的天然生物色素,其历史悠久,生产技术成熟,价格便宜。红曲色素是包括红曲红色素、红曲黄色素、红曲橙色素在内的多种色素的混合物,作为与红曲红色素结构类似的同系物中的红曲橙色素和红曲黄色素这2种天然色素,尚未工业化生产。
从感官上来讲,黄色素是最为醒目的色素类型之一,且许多食品也多呈现黄色,故黄色素是最重要的食用色素品种之一。像甜点、冰激淋、奶油、人造奶油、油脂、玉米片、起酥油、调味色拉油、面包、通心面、饮料、肉制品(火腿、香肠)、干酪、饼干、方便面等产品中,使用黄色素的场合明显多于其他色调的色素,因此推测黄色素的产量和用量都应超过红色素。
在红曲行业,普遍被人们接受的观点是,红曲黄色素中,最常见的2种化学物质是红曲素和安卡红曲黄素。近几十年来,国内外研究者对红曲黄色素及其生产技术的研究在不断深入。人们对红曲黄色素的认知也在不断加深,现在可以明确的是,由于红曲菌种的多样性及生产方法的不同,红曲黄色素的种类和性能呈现多样性。近几年,红曲行业内值得一提的是,一种利用红曲色素为原料,通过化学合成方法制得的“红曲黄”已经面世,且制定了红曲黄色素产品的国家标准(GB1886.66—2015)。更为值得关注的是天然红曲黄色素,现在也可以像红曲红色素一样,通过发酵法大规模生产。因此,现有的红曲黄产品国家标准中的相关定义和指标等都值得商榷。针对这些问题,本文根据对红曲黄色素现有知识的掌握,从其种类和性质,生产检测方法及产品标准等方面进行了较为系统的阐述和讨论,为读者进一步全面了解红曲黄色素提供方便,为今后红曲黄色素国家标准的修改提供参考。
1 红曲黄色素的多样性
1.1 红曲黄色素的种类和结构多样性
目前,已有94种红曲色素被报道,其中有44种黄色素,8种橙色素以及42种红色素[1],在这已被发现的44种红曲黄色素中,以疏水性黄色素为主,这就包括上述2种经典的红曲黄色素,即分别于1969年和1973年被发现的红曲素和安卡红曲黄素[2-3],它们的分子结构如图1所示。
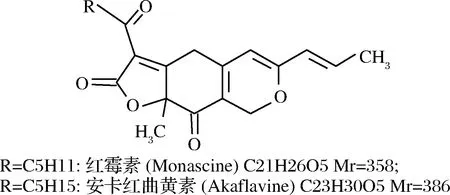
图1 两种经典的红曲黄色素的分子结构Fig.1 The structure and molecular weight of two typical Monascus yellow pigments
此后,不断有新的红曲黄色素被发现。WU等在2011年使用丛毛红曲菌BCRC 38093经红曲米发酵获得4种新的天然红曲黄色素,经鉴定为疏水性的吡啶类生物碱,并分别命名为monasnicotinate A、B、C和D[4]。同年,CHENG等使用紫色红曲菌BCRC 38038经红曲米发酵得到一种新的红曲黄色素purpureusone,经结构鉴定为一种环己烯酮类化合物[5]。另一方面,李健在2010年分离鉴定了4种亲水性的红曲黄色素A-1、A-2、C-1和C-2[6],以上所述的几种黄色素的结构如图2所示。
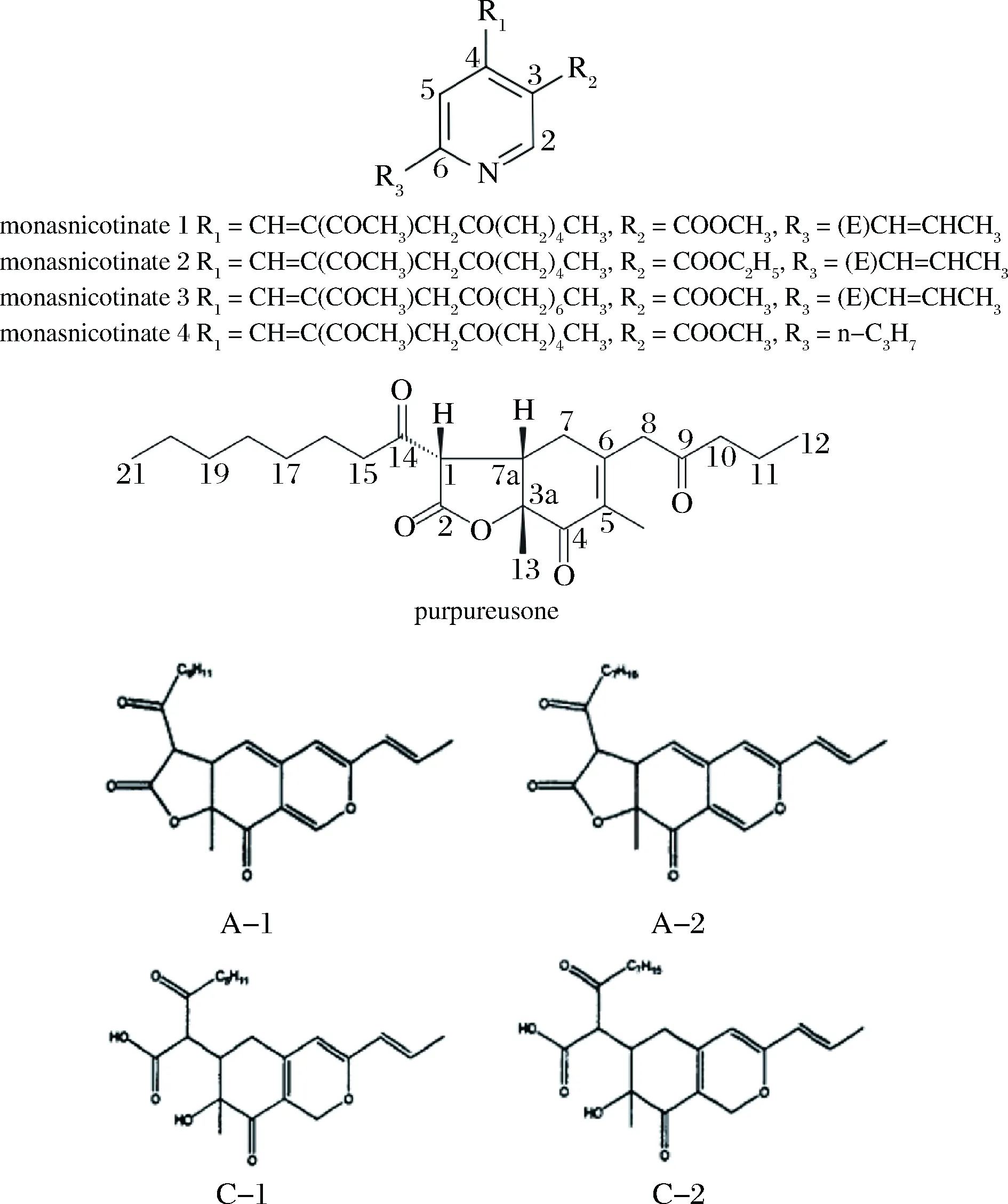
图2 部分黄色素的分子结构Fig.2 The structure of some Monascus yellow pigments
1.2 红曲黄色素性能的多样性
1.2.1 色调及最大吸收波长
红曲色素是红曲菌发酵的次级代谢产物,从结构上来说基本属于聚酮类化合物,通常为红、橙、黄3种色素的混合物,它们的最大吸收波长分别在490~530,460~480,330~450 nm[7],可见,红曲黄色素的最大吸收波长范围较大,这也是与其结构和性质的多样性紧密相关的,其中最常见的2种红曲黄色素,即红曲素和安卡红曲黄素的最大吸收峰分别为420 nm和388 nm[8]。
不同种类的红曲黄色素在薄层层析中所跑出的条带Rf值不同,色调也有差异。江南大学许赣荣等使用薄层层析对脂溶性红曲黄色素进行了分离,结果如图3所示。可见光下发现2条黄色素条带,紫外光下可见上方条带比下方条带亮。Rf值分别为0.869、0.817,最大吸收峰分别出现在421、409 nm处[9],分离的黄色素的纯度未经严格检测。

图3 红曲黄色素在薄层层析上的分布[9]Fig.3 The distribution of Monascus yellow pigments on thin layer chromatography
有结果显示亲水性的红曲黄色素的最大吸收波长比疏水性的红曲黄色素小。例如,HUANG等通过红曲菌发酵直接获得的水溶性黄色素的最大吸收峰为350 nm,远低于同时获得的疏水性黄色素的最大吸收峰410 nm[10]。
1.2.2 溶解性
根据现有的研究报导,红曲菌发酵所产的黄色素主要有疏水性和亲水性两大类,目前占大多数的是疏水性的红曲黄色素。疏水性的红曲黄色素一般具有13、17、19、20、21、22或23个碳原子,而亲水性的红曲黄色素则一般具有21或23个碳原子,且其平均分子量在344到404之间,因此,在结构的多样性上,疏水性的红曲黄色素要高于亲水性的黄色素[11]。疏水性的红曲黄色素由于具有较多的不饱和C-C双键,因此,其极性要低于亲水性的红曲黄色素。疏水性的红曲黄色素在有机溶剂(甲醇、乙醇、丙酮、己烷、乙苯、乙酸乙酯、油脂)中溶解性较好,而亲水性的红曲黄色素则可以直接从红曲菌的发酵液中获得。
1.2.3 稳定性
和其他大多数的天然色素相似,红曲黄色素在稳定性方面也同样面临着较大的挑战,它会受pH、金属离子、温度和光照等因素的影响,而引起一定程度上的变色、褪色,这会影响并制约着红曲黄色素在食品行业的推广和应用。因此,如何提高红曲黄色素的稳定性是研究者和相关行业人士都非常关注的问题,但由于红曲黄色素仍未工业化生产,目前与红曲黄色素稳定性相关的研究仍相对较少。相对而言,亲水性的红曲黄色素比疏水性的红曲黄色素具有更高的稳定性。亲水性的红曲黄色素在不同的pH条件下(pH为4、6和9)对多种金属离子(如Mg2+、Sn2+、Ca2+、Fe3+和Al3+等)有良好的耐受性,并且在一个较广的pH范围内(pH 2~10)具有相对较好的稳定性[12]。但极酸极碱性环境仍会在一定程度上不利于红曲黄色素的保存,应尽量保存在中性环境下。此外,红曲黄色素的热稳定性良好,在100℃下加热60 min后红曲黄色素的保存率仍然在95%以上,这对于食品热加工来说具有很好的应用价值。在光学稳定性方面,相比于红曲红色素,红曲黄色素在紫外光和可见光的条件下稳定性更高[13]。但红曲黄色素的稳定性会随着自然光照时间的延长而逐渐降低,而通过避光处理,红曲黄色素会显现出较好的稳定性[14]。由此可见,环境中pH、金属离子、温度和光照等因素对红曲黄色素的稳定性都有一定的影响,如何在生产、应用和储存过程中避开各种易造成其不稳定的因素,将更利于红曲黄色素的进一步开发和应用。此外,通过添加色素稳定剂,例如抗氧化剂,也可有效地提高红曲黄色素的稳定性[15]。
1.3 红曲黄色素生产方法及其产品应用的多样性
1.3.1 生产方法的多样性
红曲菌的代谢产物,以色素产物最为众多。红曲菌属下种的分类,有不同的观点。国外有专家认为红曲素可分为3个种,而我国著名的红曲专家李钟庆先生认为红曲属可分为12个种。不同的菌种,其所产生的色素种类和相对含量也是不同的。
红曲黄色素产品的生产方法,包括提取法、半合成法和发酵法。发酵法包括传统的固态发酵法和现代的液态发酵法。液态发酵法又根据不同的方法可分为常规的液态发酵法和萃取发酵法。不同的发酵工艺条件均可改变发酵色素的种类及其含量的比例。
图4-a是泰国科学家利用红曲菌固态发酵法生产的“黄金米”。江南大学与合作企业的液态发酵红曲黄如图4-b所示。由图4-c可看出,固态发酵红曲米中所含有的黄色素与液态发酵所得到的红曲色素中的黄色素相比,其种类要多。
20世纪20年代就有日本人提取法生产红曲黄色素的报道,红曲米一般都含有红、黄、橙色素,故用溶剂可从红曲米中提取黄色素,但此法收率不高。泰国科学家在20世纪90年代开始了红曲黄色素产生菌的筛选及发酵试验,先后进行了液态发酵及固态发酵法生产红曲黄色素,但泰国的红曲黄色素一直停留在研究层面,未实现工业化生产[16-17]。我国华南理工大学、江南大学、华中农业大学等高校先后都从事了液态发酵生产红曲黄色素的研究工作[18-19]。

a-黄金米与正常的红曲米;b-液态发酵红曲黄色素; c-红曲红和红曲米的板层析 (上:液态发酵红曲红乙醇溶解物;下:固态发酵红曲米乙醇提取物)图4 固态发酵红曲“黄金米”,液态发酵 红曲黄色素,红曲红和红曲米的板层析Fig.4 “Golden rice” produced by Monascus solid- state fermentation, the yellow pigments produced by liquid fermentation, the TLC of Monascus pigments
在红曲菌发酵过程中,合成的黄色素的种类和产量会受到菌种、发酵方式、发酵条件以及培养基的成分的影响。为了提高红曲黄色素的积累,可通过优化红曲菌发酵条件得以实现。例如,低pH值有利于黄色素和橙色素的积累,而相对较高的pH和氨基氮源的存在有利于形成红色素。CHEN等利用补料分批发酵,在提高红曲菌体浓度的同时,使细胞内色素的最大吸收峰逐渐转变为410 nm,大大提高了发酵结束时红曲黄色素的色调值[20]。
近些年来,微生物萃取发酵已成为一种新兴的发酵方法,可以通过该方法积累更多的红曲黄色素。另外,通过添加一些非离子型表面活性剂,也可以促使红曲菌胞内橙色素向黄色素的转化[21-22]。在通过研究阐明了发酵条件、红曲菌形态以及黄色素产量的基础上,江南大学研究团队通过自主创新,采用新型的发酵技术和提纯技术,攻克了高产红曲黄色素生产关键技术,相关成果已获得专利授权[23],红曲黄色素发酵水平获得显著提高,目前采用液态发酵红曲黄色素摇瓶发酵水平均达到500 U/mL以上,机械搅拌发酵罐发酵水平达400 U/mL左右,该项目目前正处于中试阶段[24-25]。
除此之外,通过半合成法也可以将一些疏水性的红曲色素转化成亲水性的红曲黄色素。例如,一些疏水性的红曲色素与硼氢化钠反应可以得到亲水性的红曲黄色素。使用一些磺化剂如硫磺、三氧化硫和氯磺酸,也可以使疏水性的红曲红色素转化为亲水性的红曲黄色素。虽然可以通过这种半合成的方法得到更多的红曲黄素色,但其潜在的安全性问题可能会限制它们在食品工业中的应用。
1.3.2 应用多样性
由于化学合成色素存在着较大的食品安全问题,当今在国际市场上,越来越青睐天然色素。属于食用色素新产品的天然红曲黄色素的工业化生产及应用,顺应了历史发展潮流,因而具有广泛的市场前景。
在应用方面,红曲黄色素作为无毒无害的天然色素,可广泛用于食品行业,像甜点、冰激淋、奶油、人造奶油、油脂、玉米片、起酥油、调味色拉油、面包、通心面、饮料、肉制品(火腿、香肠)、干酪、饼干、方便面等产品中。随着研究的不断深入,研究者发现红曲黄色素除了在食品工业中的应用外,还具有众多的生理活性,如抗癌、抗肿瘤、抗糖尿病、抗氧化、抗肥胖、抗炎等。此外,有文献报道,由于红曲黄色素具有提升高密度脂蛋白的功效,使其作为一种潜在的降脂药,在医药行业将有广泛的应用[26]。不仅如此,红曲素和安卡红曲黄素还有助于提高记忆力以及学习能力,有可能用于抑制阿尔茨海默病[27]。由此可见,当在合适的剂量内,红曲黄色素可作为有效的功能物质用于保健食品或医药中。随着红曲黄色素这些生理活性功能的不断发掘,其应用范围将更加广泛。
2 对红曲黄色素国家标准变更的建议
中国于2015年年底颁布了红曲黄色素国家标准(GB 1886.66—2015)。但此标准中所说的红曲黄色素,并非天然红曲黄色素,而是由红曲红色素与含硫的磺化物在碱性溶液中反应后所制得的半合成色素(红曲红色素分子中的内酯被水解,同时在分子结构中引入了磺酸基团)。鉴于天然红曲黄色素发酵生产技术的日趋成熟,从事天然红曲黄色素生产与应用的行业人士都普遍认为,通过发酵法直接得到的天然红曲黄色素也应在红曲黄色素产品的国家标准中占有一席之地。现有国家标准中对于红曲黄色素的相关定义和指标等都值得展开进一步的讨论。
2.1 对国家标准中红曲黄色素的定义和生产方法相关内容的讨论
目前作为食品添加剂的该国家标准中(GB 1886.66—2015)中对红曲黄色素的定义范围是:以红曲米为原料,经碱液洗脱,分离制得红曲红(或直接以红曲红为原料),经硫化物磺化、干燥制成的食品添加剂红曲黄色素。目前市场上已经出现半合成的“红曲黄”色素,而且这一色素产品已经有了国家标准。
从该国家标准的定义来看,该“红曲黄”色素实际上属于半合成类的红曲黄色素,无法归于“天然”色素类。它是由红曲红色素与磺化物在碱性溶液中反应后(红曲红色素分子中的内酯被水解,同时在分子结构中引入了磺酸基团)所制得的,因此,严格意义上来说,它是一种半化学合成色素,并非由红曲菌直接发酵得来,不是纯天然的红曲黄色素,而且它是多种色素形成的混合物;故其检测波长并不在传统黄色素的检测波长范围内。
天然的红曲黄色素是直接由菌体生物合成代谢产生的,即通过红曲菌直接发酵、提取、浓缩、精制而得到的产品,未经体外化学修饰,是公认的天然色素。而且在20世纪20年代,就有通过提取法制备的天然红曲黄色素问世,更值得关注的是,在最近十多年来,天然红曲黄色素的生产也达到了较高的水平,产品近于定型,故“红曲黄”色素的国家标准中不应当排斥这种天然的红曲黄色素。在今后该产品的国家标准修改时,可以通过修改红曲黄色素的定义,将发酵法直接获得的天然红曲黄色素纳入国家标准中。
2.2 对国家标准中红曲黄色素检测方法相关内容的讨论
在现有的红曲黄色素国家标准中(GB 1886.66—2015),对红曲黄色素的描述是易溶于水,外观为橙红色或黄褐色的粉末,检测时经水稀释后使用分光光度计测定其在(476±10) nm处的吸光度值,进而计算出色价。但是476 nm这个波长,实际上是针对橙色素的。黄色素的最大吸收峰的波长一般都小于450 nm。
由于红曲黄色素种类的多样性,如果以高效液相色谱为基础来对红曲样品中的色素种类和含量进行检测分析,则需要所有的色素成分的标品,并建立方法进行分析,这样做的工作量太大,而且有些色素的含量很少,实用价值较低。因此,可以通过板层析等方法,找到样品中几种主要的有代表性的红曲黄色素,针对这几种主要的黄色素进行高效液相色谱的检测。除此之外,液相色谱-质谱联用技术在红曲色素产品的分析方面有着其独特的优势,将该技术应用于红曲色素的检测应该是今后国家标准发展的方向之一。
现有的红曲黄色素国家标准(GB 1886.66—2015)以及目前行业内习惯使用的仍是以分光光度计为基准的检测方法,该方法仍然适用于天然红曲黄色素的检测,在实际应用中也更为方便可行,但其关键是稀释溶剂种类及检测波长的确定。对于稀释溶剂的种类,由于存在疏水性和亲水性的红曲黄色素,并考虑到两种类型的黄色素在乙醇中的溶解度都较高,根据我们的实践,证明用一定浓度的乙醇水溶液作为溶剂仍是较好的选择。对于检测波长,根据文献报道的天然红曲黄色素种类较多的具体情况,检测波长应当设置在较大的范围内,天然红曲黄色素的乙醇溶液,在330~450 nm有最大吸收峰。因此检测波长可定于此范围内,这也有别于半合成的“红曲黄”的检测波长(476 nm)。
2.3 对现有红曲黄色素国家标准变更的建议
根据以上所述的情况,我们建议在现有的红曲黄国家标准中,宜增加天然红曲黄色素产品(疏水性和亲水性两大类)。建议该天然红曲黄色素的定义可修订为:采用红曲菌(Monascusspp.),利用固态基质或液态培养基,经发酵、提取、浓缩、精制而得到的天然黄色素。主要用于食品工业中作为着色剂。
现有的红曲黄色素国家标准中,红曲黄色素的检测主要是使用分光光度计检测其在476 nm处的吸光度值。因此,有必要在现有的红曲黄国家标准中添加天然红曲黄色素的检测方法,即仍采用分光光度法,但对稀释溶剂和检测波长做一定的修改,修订为:将红曲黄色素溶于乙醇溶液,检测时经乙醇溶液稀释后,使用分光光度计测定其在330~450 nm的最大吸收峰,通过最大吸收峰处的吸光度值,计算出色价。
综上所述,我们已经根据对红曲黄色素现有知识的掌握,对已有的国家标准进行了讨论,为读者进一步全面了解红曲黄色素提供方便,为今后红曲黄色素国家标准的修改提供参考。
