转录调节因子DeoT对大肠埃希氏菌多重耐药性的影响
2021-12-14刘洪蕾甄思慧王家伟程如楠
刘洪蕾,甄思慧,王家伟,程如楠,岳 亮,王 真
(北京农学院动物科学技术学院/兽医学(中兽医)北京市重点实验室,北京 102206)
抗菌药物在医学和农业领域的滥用导致了耐药菌及耐药基因(ARGs)的出现,并可在全球环境中检测到抗菌药物。尤其值得关注持续出现的“超级细菌”和无法治疗的感染的现象。大肠埃希氏菌是人类和动物中最常见的革兰氏阴性细菌。抗药性大肠埃希氏菌的感染在全球范围内呈上升趋势[1]。根据国家卫生与健康委员会细菌耐药性调查网(Mohnarin)2015年公布的官方数据,大肠埃希氏菌的耐药性排名最高[1]。近年来,由于大肠埃希氏菌抗菌药物耐药性的出现速度过快,缺乏针对高耐药菌株的治疗药物,使抗菌药物耐药和大肠埃希氏菌感染问题受到了广泛关注。此外,由于大肠埃希氏菌容易发生水平基因转移,常被认为是抗菌药物耐药性传播的载体[2]。长期以来细菌耐药性的传播促使人们通过各种方法寻找新的抗菌药物,如改变现有的抗菌药物,通过筛选化学药品[3-4]或肽库[5-6]以寻找特定的抑制剂,或靶向新的蛋白质并研究其作用[7-8]。近年研究还涉及通过基因组学检测新的靶点[9],利用生物信息学筛选肽类抗菌剂,以及通过宏基因组学寻找抗菌药物新来源[10]。
早期对相关耐药基因的筛选研究表明,大肠埃希氏菌转座子插入deoT基因(一种DeoR家族的编码转录调节因子DeoT的基因)会增加抗菌药物的敏感性。DeoR转录调节因子家族的成员存在于多种革兰氏阳性菌和阴性菌中[11]。据报道,DeoT作为一种调节因子还能影响其他不同调节子的多个无关基因的表达[11]。DeoR1被证明参与了布鲁氏菌virB基因转录的激活[12]。此外,DeoT抑制参与不同代谢途径的基因表达,包括糖的运输、肽的降解和脂肪酸的分解;还可能与细胞对环境变化的反应有关[11]。正如在大肠埃希氏菌对渗透压上调的早期反应中观察到的一样[13],DeoT抑制基因的方式可能反映了代谢途径的普遍下调,从而导致短暂的生长停滞。除上述报道外,DeoT是否参与了大肠埃希氏菌耐药基因的调控尚不清楚。
为了进一步了解DeoT对大肠埃希氏菌基因表达的调控作用,并证实DeoT对大肠埃希氏菌耐药性的影响,本研究构建了deoT基因缺失株,对其转录组进行了测序分析,并通过荧光定量PCR(real-time PCR)对deoT调控靶向基因作用进行了确认。
1 材料与方法
1.1 材料
1.1.1 菌株 本研究所用的大肠埃希氏菌E8亲本株为本实验室从河北省1头腹泻犊牛中分离得到的。药敏试验证实,该分离菌株E8对多种药物具有耐药性,尤其是对氨基糖苷类、四环素类和大环内酯类抗生素耐药。所有菌株在添加或不添加氨苄青霉素(100 mg/L)和氯霉素(30 mg/L)LB中培养。
1.1.2 试剂及仪器 细菌RNA提取试剂盒,北京天根生化科技有限公司产品;反转录试剂盒,赛默飞世尔科技有限公司产品;Agilent 2100生物分析仪,北京龙跃生物科技发展有限公司产品。
1.2 方法
1.2.1deoT基因缺失突变体及互补菌株的构建 为构建deoT基因缺失株,如文献所述进行基因消除[14]。引物如下:deoT-F(AGAGCGGATGATTTGTCAAACTGCAAATCATCCCGTAGAGAAGGGAAATGGTGTGTAGGCTGGAGCTGCTTCG),deoT-R(CGCGTCAGTATTTTTTTATTTAGTATTATAACGTTATAAGAATTACAGCGCATATGAATATCCTCCTTAG)。为构建E8ΔdeoT的基因互补株,将deoT片段扩增后连接到质粒pBBR1MCS中。将得到的重组载体pBBRdeoT电穿孔到E8ΔdeoT中,命名为E8CdeoT。
1.2.2 抗菌药物最小抑菌浓度测定 最小抑菌浓度(MIC)是指抑制细菌生长的抗菌药物所需最低浓度。为探究deoT对大肠埃希氏菌抗菌药物的敏感性,筛选出四环素、万古霉素、新霉素、氨苄青霉素、青霉素、诺氟沙星、大观霉素、头孢唑肟、庆大霉素、萘啶酸等10种抗菌药物。将菌株用LB培养基在37 ℃中培养过夜,调整活菌到106CFU/mL。在试管中用MH培养基分别将每种抗菌药物从2 048 μg/mL进行2倍稀释。随后,将1 mL细菌悬液分别加入到每种抗菌药物的不同浓度试管,充分混匀后在37 ℃下培养16 h~18 h。重复3组。
1.2.3 RNA的提取和测序 将菌株E8和E8ΔdeoT的单个菌落用LB培养基37 ℃培养16 h~18 h。用细菌RNA提取试剂盒分离每个样品的总RNA。使用2100生物分析仪验证RNA质量,通过无RNA酶琼脂糖凝胶电泳检测。提取的RNA样本用于cDNA文库的构建。cDNA文库在Illumina测序平台 (Illumina HiSeq 2000,Illumina,圣地亚哥,加利福尼亚州,美国)上使用配对末端技术进行测序。
1.2.4 转录组分析 以大肠埃希氏菌O157:H7基因组为参考序列,通过SeqPrep (https://github.com/jstjohn/SeqPrep)和sickle (https://github.com/najoshi/sickle)去除适配序列、低质量读数(Q值<20)、不明确的核苷酸“N”和长度小于20 bp的片段序列。以错误发现率(FDR<0.05)和log2FC≥2作为阈值来判断基因表达差异显著性。用GO[15]和KEGG[16]对差异表达基因进行注释和分类。
1.2.5 荧光定量PCR验证 为了验证RNA-seq的结果,对5个显著上调和5个显著下调的基因进行RT-qPCR。每个基因扩增用引物见表1。按照上述方法分离总RNA,然后根据(赛默飞世尔科技有限公司)说明书反转录成cDNA。然后使用Power SYBR Green PCR系统将1 μL所得cDNA进行qPCR。检测基因的正、反引物如表1所示,用16S rRNA基因对所有值进行标准化。使用2-△Ct方法计算相对表达水平[17],使用所有基因的平均Ct值进行分析以校正cDNA输入的差异。
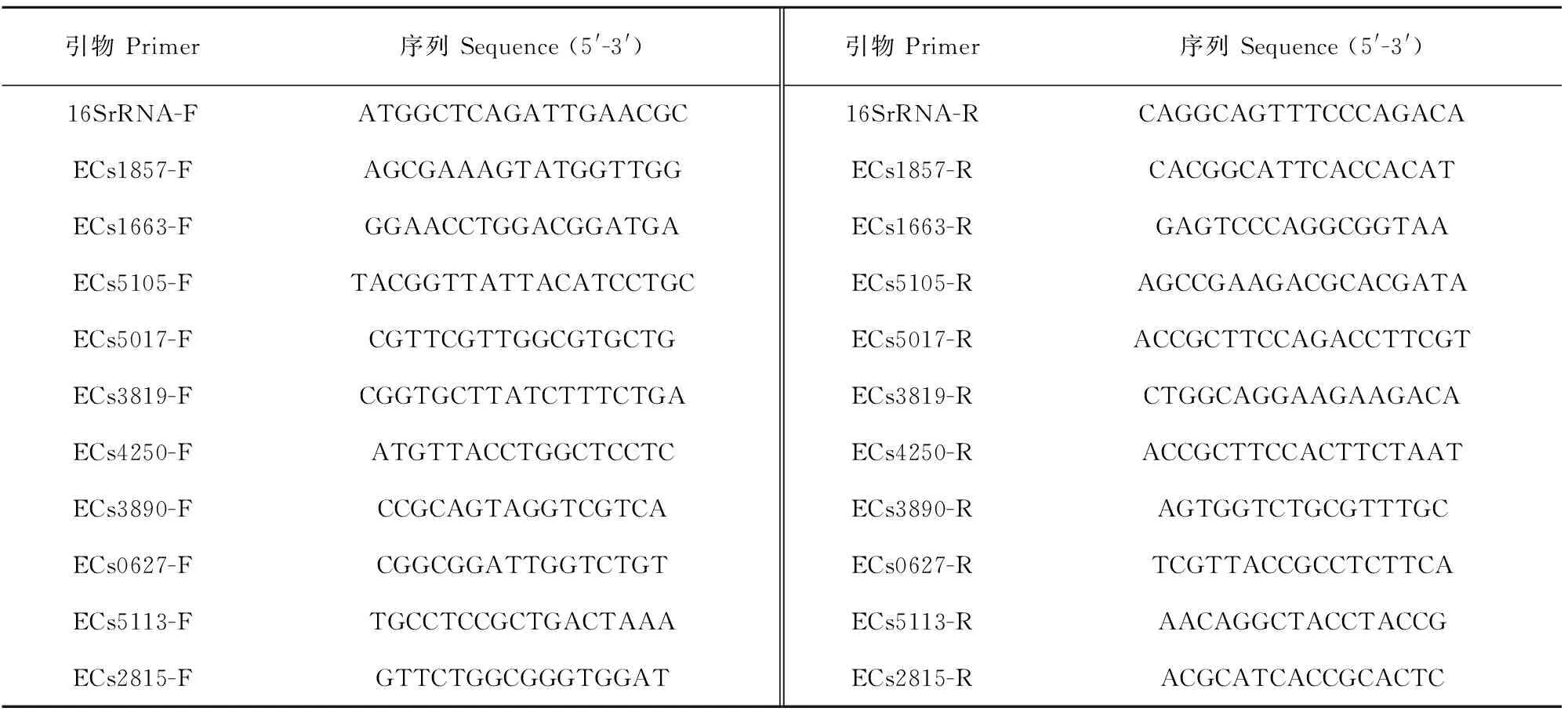
表1 RT-qPCR扩增所用引物
2 结果
2.1 突变株E8ΔdeoT对抗菌药物的耐药性
各菌株对抗菌药物的MIC测定结果如表2所示,E8ΔdeoT对四环素(4倍)、万古霉素(4倍)、萘啶酸(4倍)、氨苄青霉素(2倍)、大观霉素(2倍)和青霉素(4倍)的敏感性高于亲本菌株E8和互补菌株E8CdeoT。表明DeoT编码基因的缺失影响了大肠埃希氏菌E8株固有的多重耐药性。

表2 大肠埃希氏菌株的药物敏感性
2.2 DeoT对大肠埃希氏菌基因的表达调控
为了解deoT基因的功能,使用RNA-seq分析法测定了deoT缺失株基因的转录组。从E8和E8ΔdeoT的转录组测序结果中分别获得15234336和17645316个序列。将测序序列与大肠埃希氏菌O157:H7的基因组匹配。统计分析发现E8ΔdeoT与E8的差异表达基因共有118个,其中有76个基因表达下调,42个基因表达上调。
2.3 E8ΔdeoT差异表达基因的GO和KEGG分析
E8ΔdeoT差异表达基因的功能分类结果如图1所示,所有与调节生物过程、信号转导和受体活性相关的基因均上调;与生物黏附、细胞成分组织或生物转化、抗氧化活性和电子载体活性相关的基因均下调。除这些功能分类外,所有其他类别均包括上调和下调基因。在与细胞代谢、单个生物过程、细胞或细胞成分和催化活性相关的基因中,下调基因的数量与上调基因的数量相似。KEGG分析表明,差异表达基因涉及代谢途径,包括各种氨基酸、碳水化合物、脂质和能量代谢等多个途径。此外,还有多个基因涉及细胞膜转运、双组分系统和细菌趋化途径等。并且这些途径可能直接或间接地与大肠埃希氏菌耐药性有关。

图1 差异基因表达
2.4 DeoT对ABC转运蛋白和转运/膜蛋白的调控
转运蛋白通过参与化学物质的吸收、分布和消除来影响其在细胞内的分布。转录组分析结果显示,29个与ABC转运蛋白、转运蛋白和膜蛋白相关的基因在E8ΔdeoT中差异表达。如ABC转运蛋白编码基因malE、dcuB、malK和mglB在E8ΔdeoT中的表达显著降低。转运蛋白/膜蛋白编码基因,如tdcC、srlB、nanT、malG、rbsB、ompT、yeeE、fimD和galP下调,exbB、feoA、feoB、feoC、cysU、cysP、cysA、cysW和ydhC在E8ΔdeoT中显著上调。研究报道发现由exbB编码的生物聚合物转运蛋白ExbB是幽门螺旋杆菌的关键药物靶点[18]。一种在极端变性条件下具有活性的外膜蛋白酶OmpT能够提高大肠埃希氏菌对正丁醇的耐受性[19]。 参与铁转运的FeoA也被发现显著提高了对正丁醇-丁醇的抵抗力[19]。参与铁转运相关的基因在E8ΔdeoT中上调,表明铁转运途径受到破坏。
2.5 DeoT对新陈代谢的调节
转录组分析表明,许多与代谢相关的基因在E8ΔdeoT中有差异表达,如fumB、aceE、aceF、sucB、sucD、mdh、pckA、sdhB、pflD、ttuC、gapA、yiaY、tdcD、garR、srlB、srlD、nanE、nanA、lacZ、frdD、frdC、frdB等参与碳水化合物代谢。4种frd基因编码富马酸还原酶复合物的亚基,该复合物转录组受交替电子受体氧、硝酸盐和富马酸的细胞可用性的调控。[24]。据报道,frdD突变可能影响ampC启动子的强度,诱导ampC的表达增强,并导致大肠埃希氏菌对β-内酰胺类抗菌药物耐受性的增加[20]。从转录组结果来看,frdD在E8ΔdeoT中的表达下调。
此外,11个涉及氨基酸代谢的基因包括tnaA、katG、cadA、cysK、cadB、sdaA、cysM、trpGD、trpE、katG、speC和ansA,在E8ΔdeoT中均有差异表达。例如,cadA和cadB在E8ΔdeoT中表达显著上调;CadA是一种赖氨酸脱羧酶,可将赖氨酸转化为尸胺(一种多胺)。所有细胞类型的正常生长都需要多胺,它可以影响蛋白质、DNA和RNA的功能。反转运蛋白CadB吸收赖氨酸并排出尸胺,从而消耗质子[21]。然而,许多作为二级转运器的多药外排系统是由跨膜电化学质子梯度(ΔμH+)的质子动力(PMF)驱动的,而不是由ATP水解驱动的[22]。因此,E8ΔdeoT中显著上调的cadA和cadB基因导致质子减少,从而影响多药外排系统的功能,提高E8ΔdeoT对大多数抗菌药物的敏感性。
2.6 差异表达基因的RT-qPCR验证
为了验证RNA-seq分析的基因差异表达模式,选择显著差异调控的基因进行了RT-qPCR。在118个差异表达的基因中,根据基因功能及其在抗菌药物耐药性中的潜在作用选择了10个基因。如表3所示,RNA-seq和RT-qPCR结果具有良好的一致性;在E8ΔdeoT中有5个基因下调,5个基因上调。由此证实了RNA-seq和RT-qPCR数据之间的强相关性,以及基因表达的真实性。

表3 选择基因的RT-qPCR结果
3 讨论
DeoT是DeoR家族的一种转录调节因子,存在于多种细菌中。DeoT作为一种广谱调节因子,抑制多种代谢途径中基因的表达,包括麦芽糖转运、脂肪酸β-氧化和肽降解[11]。本研究发现,大肠埃希氏菌deoT基因缺失后对常用抗菌药物的MIC明显降低,表明DeoT在大肠埃希氏菌耐药性中起重要作用。
对大肠埃希氏菌亲本菌株E8和E8ΔdeoT突变体进行了转录组学分析。结果表明,在E8ΔdeoT中共鉴定出118个差异表达基因,其中76个下调基因和42个上调基因。其中,E8ΔdeoT的差异表达基因包括4个转录调节因子和29个运输/膜蛋白编码基因。转运蛋白通过参与化学物质的吸收、分布和消除来影响其在细胞内化学物质的分布。多重耐药(MDR)转运蛋白主动外排抗菌药物是引起细菌耐药的主要途径,使细菌感染的临床治疗复杂化[23]。例如,由exbB编码的生物聚合物转运蛋白ExbB被发现是幽门螺杆菌的关键药物靶点[18],且在E8ΔdeoT中出现显著上调,极有可能增加了E8ΔdeoT药物敏感性。
此外,RNA-seq结果显示,许多与代谢相关的基因在E8ΔdeoT中差异表达;参与氨基酸代谢的cadA和cadB在E8ΔdeoT中显著上调。此前已有报道称,cadA和cadB也可以间接影响多药外排系统的功能[21],从而提高E8ΔdeoT对大多数抗菌药物的敏感性。
综上所述,DeoT在大肠埃希氏菌多重耐药性中起着重要的作用,直接或间接调控多个基因的表达。本文为了解DeoT具体调控的相互作用以及与大肠埃希氏菌耐药性的关系提供了重要信息,但仍需要进一步的研究来分析DeoT参与的细菌多重耐药性调控机制。
