RNA干扰AC-cathB-1基因对广州管圆线虫Ⅰ期幼虫发育的影响
2021-12-14王兵丽刘琪龙
王兵丽,刘琪龙
(1.闽南师范大学生物科学与技术学院,福建漳州 363000;2.厦门大学生命科学学院,福建厦门 361005)
广州管圆线虫(Angiostrongyluscantonensis)入侵软体动物作为其中间宿主,人因食入含有广州管圆线虫幼虫的中间宿主而感染。广州管圆线虫病主要侵犯人体中枢神经系统,以嗜酸性粒细胞增多性脑膜炎为主要特征。近年来,随着人们饮食习惯的多样性和水陆交通的发展,广州管圆线虫病的流行呈上升趋势,有些地区甚至暴发流行,引起相关专家和学者的重视[1-3]。 然而,目前仍无有效的手段对广州管圆线虫病进行诊断和治疗。因此,对其深入研究很有必要。半胱氨酸蛋白酶是蛋白酶家族中的重要成员,广泛分布于哺乳类、鱼类和寄生虫等很多生物体内[4-6],是一类功能多样的蛋白水解酶。除了其蛋白水解活性外,由于该蛋白水解酶在寄生虫入侵宿主、营养摄取、水解宿主细胞内蛋白、蜕皮、免疫逃避等过程中发挥着不可替代的作用,与多种重要动植物疾病密切相关,是近年来备受关注的一类靶标蛋白酶[7-10]。但对于涉及其中的分子机制,特别是关键基因还不甚了解。广州管圆线虫的寄生宿主及其生活史和其他寄生虫差异较大,致使其分子机制目前研究进展缓慢。Ni F等[11]已克隆出3种广州管圆线虫半胱氨酸蛋白酶家族基因,分别是组织蛋白酶B样基因1(cathepsin B-like enzyme gene 1,AC-cathB-1)、组织蛋白酶B样基因2(cathepsin B-like enzyme gene 2,AC-cathB-2)和血红蛋白酶型半胱氨酸蛋白酶基因(hemoglobin-type cysteine protease gene,hem)。Ni F等[11]和余长茂[12]研究发现,AC-cathB-1基因的表达量在Ⅰ期幼虫中较高。广州管圆线虫的Ⅰ期幼虫通过被吞食或主动钻入福寿螺等中间宿主的体内而感染中间宿主,推测AC-cathB-1基因可能在广州管圆线虫Ⅰ期幼虫入侵中间宿主的过程中发挥着必不可少的作用。本研究通过RNA干扰(RNA interference,RNAi)技术抑制广州管圆线虫Ⅰ期幼虫的AC-cathB-1基因,观察AC-cathB-1基因被抑制后对广州管圆线虫入侵中间宿主的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 广州管圆线虫,厦门大学寄生动物学实验室保种;SPF级成年雌性SD大鼠,130 g~ 210 g,厦门大学实验动物中心提供,动物生产许可证SCXK(闽)2004-0001;福寿螺系厦门大学寄生动物学实验室繁殖的子代福寿螺。
1.1.2 主要试剂 胶回收试剂盒,生工生物工程(上海)股份有限公司产品;Taq酶、cDNA合成试剂盒、DNA标志物、T4 DNA连接酶和限制性内切酶,宝生物工程(大连)有限公司产品;动物组织总RNA提取试剂盒、质粒提取试剂盒,天根生化科技(北京)有限公司产品;蛋白酶K、β-巯基乙醇、荧光定量试剂盒,瑞士Roche公司产品。
1.1.3 主要仪器 荧光定量PCR仪(Q160 plus),ABI公司产品;PCR仪(QX200),伯乐公司产品;台式高速冷冻离心机(TGL-20M),湖南湘仪公司产品;微量分光光度计(NanoDrop 2000c),Thermo Scientific公司产品;高压灭菌锅(GF88DX),美国致微公司产品;生物显微镜(CX31RTSF),Leica公司产品。
1.2 方法
1.2.1 引物设计及dsRNA合成 参照GenBank中广州管圆线虫AC-cathB-1基因cDNA的序列和拟南芥Rubisco基因序列,利用Oligo 6软件设计扩增AC-cathB-1和Rubisco基因的特异性引物CathB1和Rubisco1。以广州管圆线虫的β-Actin基因作为内参基因。设计用于real-time PCR检测AC-cathB-1和Rubisco基因的特异性引物CathB2和Rubisco2,以及内参基因β-Actin的引物(表1)。引物由生工生物工程(上海)股份有限公司合成。
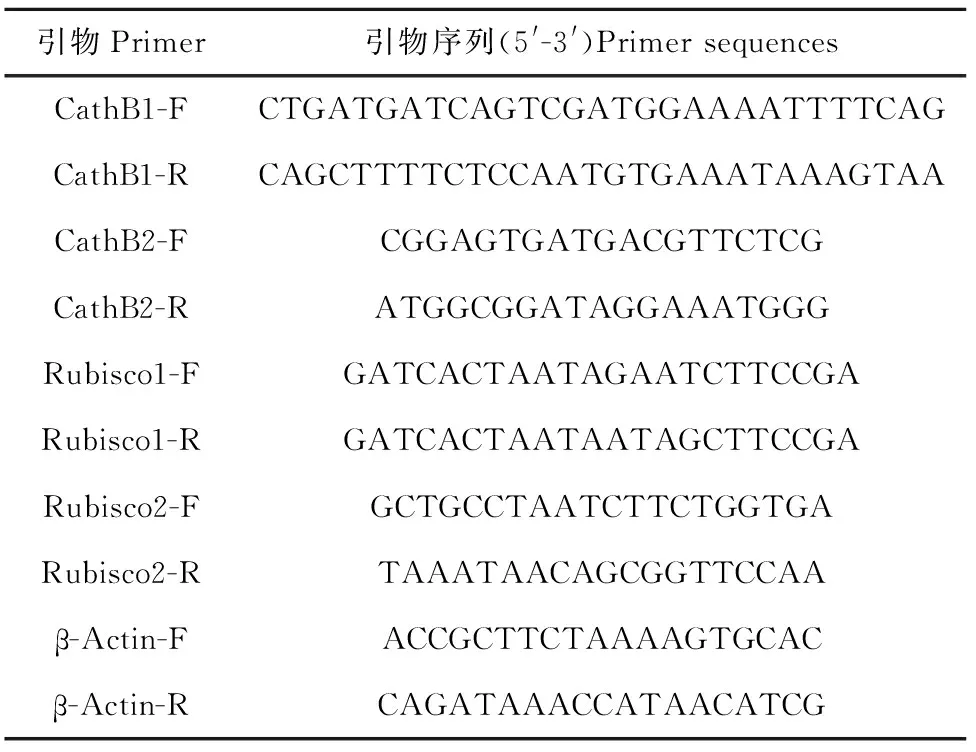
表1 dsRNA合成与real-time PCR检测的引物序列
1.2.2 广州管圆线虫Ⅰ期幼虫的收集 收集广州管圆线虫阳性SD大鼠的新鲜粪便,加入生理盐水充分调匀。取大鼠粪便液,2 500 r/min离心10 min,弃上清,室温过夜收集液体,过500目筛网,蒸馏水冲洗筛网,收集筛网上的Ⅰ期幼虫至离心管中。生理盐水润洗之后2 500 r/min离心10 min,重复3次,收集置冰箱备用。
1.2.3 目的片段的扩增与合成dsRNA 用β-巯基乙醇法,按RNA反转录试剂盒说明书的操作,提取广州管圆线虫Ⅰ期幼虫的总RNA。根据cDNA试剂盒说明书的操作步骤,将广州管圆线虫RNA反转录为cDNA。以合成的cDNA为模板进行PCR扩增,反应条件为:94 ℃预变性3 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃延伸8 min。按照切胶回收试剂盒使用说明书,对目标片段进行切胶回收,并克隆于pMD19-T载体上,转化入大肠埃希氏菌(Escherichiacoli)DH5α感受态细菌中,置于LB平板过夜培养。挑取阳性克隆送Invitrogen公司测序。拟南芥Rubisco的目的片段也按同样的方法制备,产物经测序验证后确定是目的片段。
以目的片段的PCR产物为模板,按照InvitroTranscription T7 Kit试剂盒使用说明书催化合成dsRNA。紫外分光光度计测定260 nm处的吸光值,计算产物浓度,将合成好的dsRNA置于-20 ℃保存。
1.2.4 RNA干扰AC-cathB-1基因对广州管圆线虫Ⅰ期幼虫的影响 将获得的广州管圆线虫Ⅰ期幼虫经2 000 r/min离心5 min,沉淀重悬于2 mL的蒸馏水,每组取样5次(10 μL/次),显微镜下计数Ⅰ期幼虫的数量。用3 mg/mL的AC-cathB-1-dsRNA、Rubisco-dsRNA和生理盐水分别浸泡Ⅰ期幼虫,置于摇床25 ℃、80 r/min缓慢摇20 h。
取福寿螺90只,随机分成3组,每组30只。将AC-cathB-1干扰组、Rubisco干扰组、生理盐水对照组的广州管圆线虫Ⅰ期幼虫(各2 000只)分别侵染各组的福寿螺。感染后3周,镜检福寿螺肺组织中的幼虫结节,并确定螺的感染率、死亡数。将福寿螺压碎去壳,加消化液,置于37 ℃消化液中消化3 h,过滤后取沉淀物[13]。显微镜下计数Ⅲ期幼虫数量、测量虫体长度,并记录幼虫的活力(“+++”表示虫体活跃,摆动呈缓慢S型,体态柔和,颜色呈无色透明状;“++”表示活动力略差,虫体略僵硬,颜色呈透明至半透明状;“+”表示虫体仅头部或者尾端活动轻微,虫体僵硬,常静止呈“C”状,颜色呈白色)。
1.2.5 Ⅰ期幼虫AC-cathB-1基因干扰后基因表达量的测定 提取试验各组的Ⅰ期幼虫RNA,将其反转录成cDNA后,进行real-time PCR反应。反应条件为:95 ℃预变性90 s;94 ℃ 15 s,60 ℃ 15 s,70 ℃ 15 s,共39个循环;78 ℃荧光采集10 s。用△Ct计算目的基因的相对表达量,2-△△Ct比较不同组间的基因表达情况。

2 结果
2.1 Ⅰ期幼虫AC-cathB-1基因的克隆及dsRNA的合成
用特异性引物对广州管圆线虫的cDNA进行扩增AC-cathB-1基因片段,片段大小约为1 100 bp;用特异性引物对拟南芥的cDNA进行扩增,得到片段大小约为500 bp的拟南芥Rubisco大亚基片段。均与预期大小相符。将PCR产物通过琼脂糖凝胶分离纯化,用胶回收试剂盒将AC-cathB-1片段和Rubisco片段进行回收,纯化作为模板合成dsRNA(图1)。
2.2 real-time PCR检测基因表达情况
通过real-time PCR检测AC-cathB-1基因表达的结果显示,AC-cathB-1干扰组、Rubisco干扰组、生理盐水对照组的基因相对表达量分别为10.9±1.1、62.1±3.1和75.0±4.5(图2)。AC-cathB-1干扰组的基因表达量显著下调,与Rubisco干扰组和生理盐水对照组的差异显著(P<0.05)。

M.DNA 标准DL 1 500;1.Rubisco基因; 2.Rubisco-dsRNA; 3.AC-cathB-1基因; 4.AC-cathB-1-dsRNA

图2 RNAi后AC-cathB-1基因的相对表达量
2.3 RNA干扰对Ⅲ期幼虫发育的影响
2.3.1 福寿螺感染率及幼虫活力 感染后3周,AC-cathB-1干扰组、Rubisco干扰组和生理盐水对照组的感染率依次为83.33%、93.33%和100%,各组螺的死亡率分别为3.33%、20%和16.67%(表2)。AC-cathB-1干扰组的幼虫大部分活动力略差,虫体略僵硬,颜色透明,Rubisco干扰组、生理盐水对照组虫体活跃,摆动呈缓慢S型,体态柔和,无色透明。
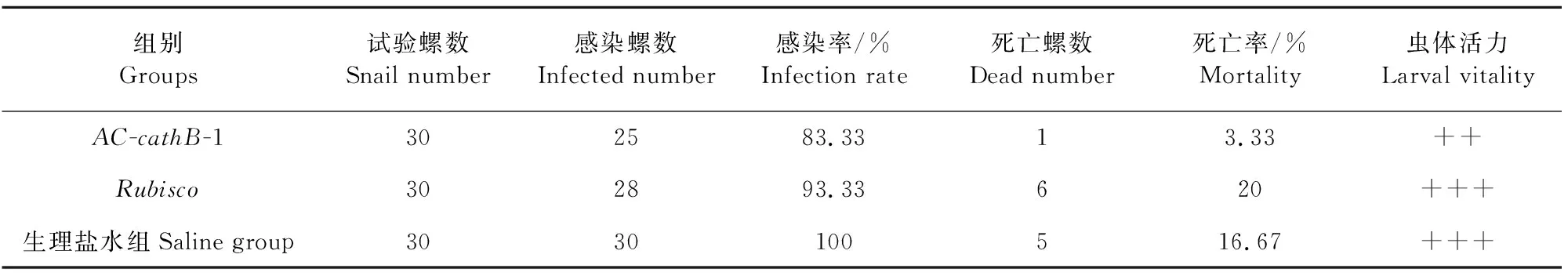
表2 福寿螺感染率、死亡率及幼虫活力
2.3.2 感染螺体内的幼虫数量AC-cathB-1干扰组、Rubisco干扰组和生理盐水对照组的Ⅲ期幼虫数量分别为21.2条±1.9条、32.6条±2.6条和36.3条±2.2条。AC-cathB-1干扰组与Rubisco干扰组和生理盐水对照组之间的差异显著(P<0.05)(图3)。

图3 RNAi对幼虫数量的影响
2.3.3 Ⅲ期幼虫体长 Ⅰ期幼虫感染中间宿主3周后经蜕皮发育为Ⅲ期幼虫。经测量AC-cathB-1干扰组、Rubisco干扰组、生理盐水对照组的Ⅲ期幼虫的长度分别为(471.3±11.8)μm×(25.5±1.1)μm、(475.3±14.3)μm×(25.4±1.3)μm、(476.31±11.5)μm×(25.7±2.0)μm(图4)。RNA干扰后,Ⅲ期幼虫体长有所减短,但差异不显著(P>0.05)。

图4 RNAi对幼虫体长的影响
3 讨论
半胱氨酸蛋白酶广泛分布在不同生物体内,是一类功能多样的蛋白水解酶。线虫的半胱氨酸蛋白酶在其体内行使水解的功能,是线虫的主要“消化酶”,主要存在于虫体的食道腺和肠细胞中[9]。除其蛋白水解活性外,已有大量报道证明半胱氨酸蛋白酶在寄生虫的不同发育阶段、对宿主的免疫、营养摄取等方面具有关键作用。疟原虫的半胱氨酸蛋白酶可催化降解宿主红细胞内的血红蛋白[14];肝片吸虫(Fasciolahepatica)的半胱氨酸蛋白酶能裂解宿主的免疫球蛋白[15];棘阿米巴(Acanthamoebacastellanii)的半胱氨酸蛋白酶能够抑制其早期的成囊过程[16];RNA干扰秀丽隐杆线虫(Caenorhabditiselegans)的半胱氨酸蛋白酶后,可致死95%的胚,说明半胱氨酸蛋白酶是其发育过程中的关键因子[17];半胱氨酸蛋白酶的寡肽B帮助利什曼原虫(Leishmaniaspp.)参与对宿主的免疫逃避过程[18]。
AC-cathB-1基因是广州管圆线虫半胱氨酸蛋白酶家族基因之一,Ni F等[11]证明广州管圆线虫的AC-cathB-1基因的表达量在Ⅰ期幼虫中较高;余长茂[12]通过免疫荧光定位证实AC-cathB-1从Ⅰ期幼虫发育至成虫的过程中都集中而且大量的分布于虫体的消化系统中,推测AC-cathB-1在广州管圆线虫中可能起降解宿主红细胞,与肠上皮细胞间发生相互作用,并参与食物泡形成等营养摄取的功能。本研究通过RNA干扰技术干扰广州管圆线虫Ⅰ期幼虫的AC-cathB-1基因,发现AC-cathB-1基因下调表达后,Ⅰ期幼虫在中间宿主福寿螺体内的发育受到一定程度的抑制,感染中间宿主福寿螺后,福寿螺的感染率、死亡率均下降、Ⅲ期幼虫的数量及活力也降低。推测这可能是由于AC-cathB-1基因被干扰后影响了幼虫与宿主肠上皮细胞间的相互作用,减弱了幼虫的营养摄取功能,进而增加了幼虫的死亡率,导致Ⅰ期幼虫发育成Ⅲ期幼虫的数量及活力下降,进一步减弱了对中间宿主福寿螺的致病力。研究结果表明,AC-cathB-1基因与Ⅰ期幼虫入侵中间宿主福寿螺体内的发育过程密切相关,该结果为揭示AC-cathB-1基因的功能提供了理论基础,为广州管圆线虫病的防治和了解广州管圆线虫与中间宿主的相互作用关系提供了一种靶标和思路,对深入研究广州管圆线虫的基因结构与功能具有重要意义。然而,关于AC-cathB-1基因对幼虫入侵过程的具体调控机制还不清楚,有待进一步深入研究。
