玉米赤霉烯酮致肝脏损伤机制研究进展
2021-12-14周鸿缘葛冰洁李春亭张雪梅
王 萌,周鸿缘,桑 锐,葛冰洁,赵 欣,李春亭,张雪梅
(延边大学农学院动物医学系,吉林延吉 133002)
玉米赤霉烯酮(zearalenone,ZEA)别名F-2毒素,首先从赤霉病玉米中提取出来,是一种真菌毒素,广泛存在于霉变的玉米、小麦、燕麦和高粱等谷物及动物饲料中。ZEA毒性很强,能造成动物急慢性中毒,严重时毒素会残留在动物组织中,引起动物机能异常甚至死亡。ZEA的分子质量是318 u,熔点高,热稳定性好,高温不易分解;ZEA在水和CC14中不易溶;易溶于NaOH等碱溶液,以及甲醇等有机溶剂中。ZEA通过食用被污染的肉类、奶类及污染谷类等动植物性食品等途径进入机体,引起腹泻、呕吐、头晕、乏力、四肢酸痛和中枢神经系统紊乱等中毒症状。目前大部分国家制定了法律法规以限制谷物、食品和饲料中的ZEN含量,我国饲料卫生标准规定了饲料中ZEA的含量要低于500 μg/kg,食品中真菌毒素的限量规定表明食品中ZEA不能超过60 μg/kg。但是全世界范围内的ZEA污染仍然存在,给动物和人类健康造成巨大的危害。在动物体内,ZEA代谢为玉米赤霉烯醇 (ZEL),且有α-ZEL和β-ZEL两种异构体,ZEA及其衍生物给人类和动物健康造成巨大威胁,表现在影响生长发育,破坏生殖系统、肝脏系统、免疫系统,造成氧化损伤,并引发肿瘤[1]。目前对ZEA生殖毒性的研究较多,但对肝脏毒性研究较少,本文针对ZEA引发肝脏损伤的机制研究进行了综述。
1 ZEA致肝脏损伤
肝脏是机体内主要的代谢解毒中心,极易受到有毒物质的侵害。当ZEA进入机体被吸收后,肝细胞最先受到ZEA的影响。有研究表明,ZEA(1 mg/kg)会导致仔猪肝脏、肾脏的重量显著增加[2]。Dong M等[3]研究发现,静脉注射ZEA的山羊体内,肝脏细胞肿大以及淋巴细胞浸润、肾脏淋巴浸润。姜淑贞等[4]研究发现,低剂量ZEA使断奶仔猪血清胆红素升高,肝细胞肿胀,颗粒变性、肝细胞膜上可见自噬体和中性粒细胞,表明ZEA导致肝脏功能严重损害。梁梓森等[5]研究也发现,感染的ZEA小鼠肝脏HE染色后可见肝细胞脂肪变性、局灶性坏死,表明ZEA能引发肝组织退化,造成肝损伤、肝功能紊乱。Gao X等[6]研究发现,大鼠ZEA染毒组出现肝小叶坏死,肝细胞变性和肿胀,同时肝脏氧化指标谷胱甘肽过氧化物酶(GPX)、总抗氧化能力(T-AOC)降低,MDA升高,表明ZEA诱导了肝损伤。Abbès S等[7]研究表明,在日粮中添加ZEA(40 mg/kg)的小鼠肝脏中观察到的肝局灶性坏死,颗粒变性,肾小管上皮肿胀等;口服ZEA的家兔血清中检测到天门冬氨酸氨基转移(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、L-γ-谷氨酰基转移酶(GGT)和乳酸脱氢酶(LD)活性显着增加,这表明ZEA的慢性作用可能会引起肝脏毒性。同时,ZEA会导致肝细胞中DNA及白蛋白含量下降,表明ZEA对大鼠肝细胞有损害作用[8-9]。
2 ZEA致肝损伤的机制
2.1 ZEA引起氧化应激损伤
Nrf2是细胞中与氧化应激有关的基本成分,为细胞抗氧化损伤的关键因子[4]。在氧化应激期间,Nrf2可以诱导各种保护蛋白如HO-1和NQO1的表达。一般情况下,Nrf2与其抑制蛋白Keap1以二聚体形式存在于细胞质中,蛋白表达量处于相对稳定状态。当受到外界氧化应激因子等刺激后,ROS升高,Nrf2与Keap1解离,增强了Nrf2的稳定性并转位进入细胞核,与小Maf等蛋白形成二聚体,活化的Nrf2与抗氧化反应元件(ARE)结合,从而启动下游抗氧化基因HO-1、NQO-1等的表达,并发挥抗氧化活性(图1)。因此,Nrf2信号通路的激活在机体抵御外源性或内源性氧化应激中发挥重要作用[10]。其中,HO-1广泛参与组织细胞的抗氧化应激损伤,是机体最重要的内源性保护系统之一[11]。NQO-1是一种诱导还原酶,也是机体抵抗ROS的关键酶。有报道通过免疫组化方法成功检测了糖尿病大鼠肾脏组织中HO-1、NQO-1和Nrf2的表达,发现HO-1和Nrf2水平显著升高[10]。有研究检测了HepG2细胞中HO-1、NQO-1和Nrf2的表达,发现ZEA能剂量依赖性下调Nrf2、HO-1和NQO1的表达[12],表明ZEA诱导产生氧化应激。正常肝细胞(L02)染毒24 h后,低剂量组(5 μg/mL)ZEA能够显著提高细胞内Keap1蛋白的表达,降低HO-1和NQO1蛋白表达,表明ZEA通过抑制抗氧化通路Nrf2-Keap1/ARE通路中部分基因的表达造成细胞氧化性损伤[13-14]。
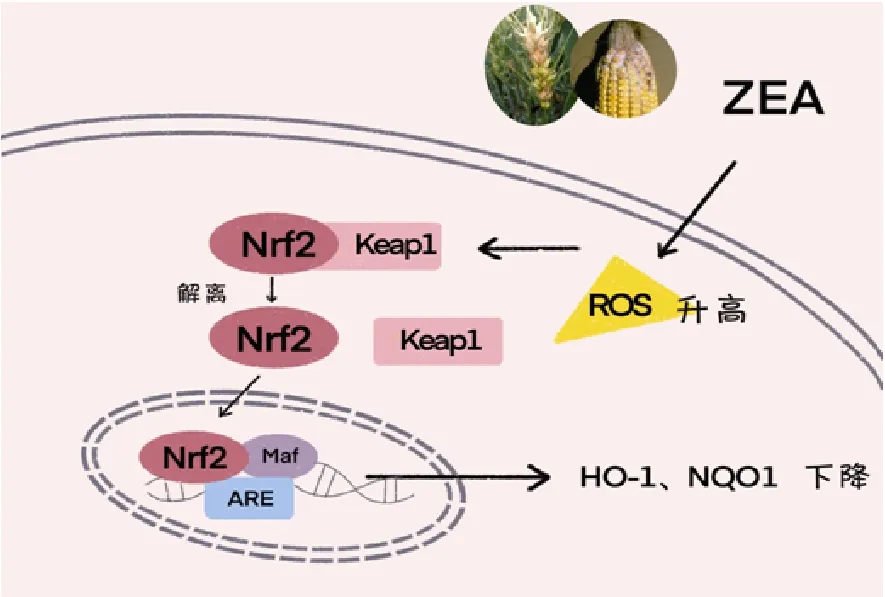
图1 ZEA通过氧化应激致肝损伤的机制
氧化应激是细胞和组织氧化和抗氧化系统之间的失衡,是氧化自由基和相关活性氧(ROS)过量产生的结果[15]。ROS是由磷酸肌酸3-激酶(PI3K)/Akt通路诱导产生的,该通路可以触发各种细胞内反应。研究发现,ZEA可以下调pPI3K/pAkt激活,从而导致氧化应激[12]。PI3K/AKT信号通路是一条与增殖、分化和凋亡相关的信号通路。磷脂酰肌醇3-激酶(PI3K)是由调节亚基p85和催化亚基p110构成的二聚体,分为IA和IB两个亚型,它们分别可以接收来自酪氨酸激酶连接受体和G蛋白偶联受体传递的信号,能够发挥类脂激酶和蛋白激酶的双重活性。AKT也叫做PKB,是PI3K的下游分子,包括AKT1、AKT2和AKT3等至少3种存在形式,在调控各种细胞生长代谢、增殖分化、转录以及蛋白质合成方面发挥重要作用。PI3K与生长因子受体(如EGFR)结合后,可改变Akt的蛋白结构并使其活化,并以磷酸化作用激活或抑制下游一系列底物如凋亡相关蛋白Bax、caspase-9活性,从而调节肝细胞的增殖、分化以及凋亡[12]。氧化应激与PI3K/AKT信号通路密切相关[16]。大量研究表明,PI3K/Akt等多种信号转导机制使Nrf2游离于Keap1,并促进随后的信号转导诱导抗氧化酶的激活[17-18],也表明持续的氧化应激导致PI3K/Akt信号的下调[19-21]。因此,调控PI3K/Akt信号通路可能是一种很有前景的预防ROS诱导肝细胞凋亡的策略。
2.2 ZEA诱导细胞凋亡
细胞凋亡是一种基本生物学现象,是细胞受损后应对机体损伤做出的一种主动的生理过程。凋亡受多基因严格控制,这些基因包括Bcl-2家族、caspase家族、抑癌基因p53等。凋亡是维持机体稳态的过程,能够提高免疫力,适应不良环境。正常凋亡不会引发炎症,但一旦凋亡过度就会引起炎症反应。ZEA诱导细胞凋亡的信号通路有很多,但主要诱导肝细胞凋亡的是线粒体凋亡信号通路(图2)。
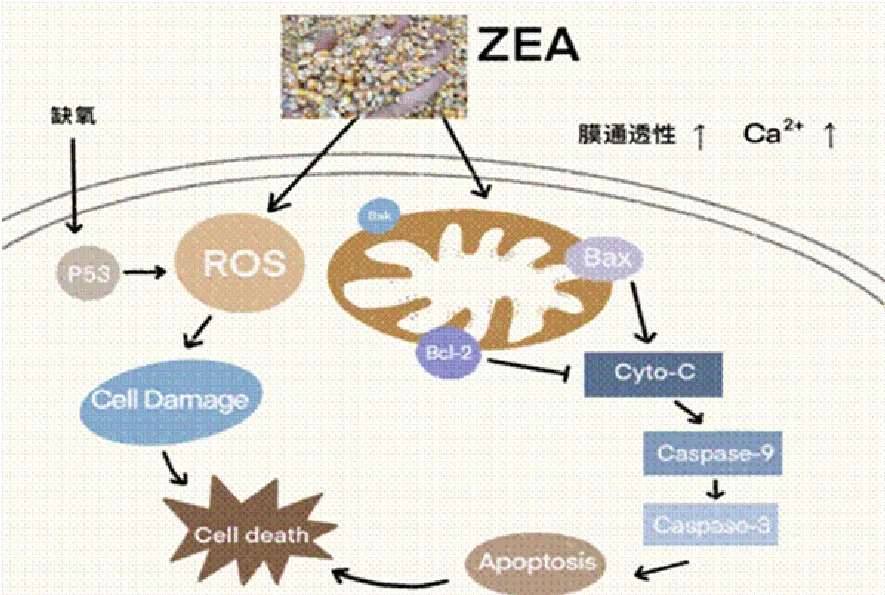
图2 ZEA通过诱导细胞凋亡致肝损伤的机制
线粒体引发的内在途径参与了ZEA诱导的细胞凋亡过程。研究发现,ZEA作用细胞后可使细胞膜通透性增加并增加细胞内钙离子水平,造成ROS累积引发细胞DNA损伤,最终诱导HepG2细胞出现凋亡[22]。caspase-3、Bax、Bcl-2、p53参与调节细胞的凋亡过程。其中,caspase-3被称为细胞凋亡的生化标志,被激活后能降解细胞内的蛋白质。而Bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放,具有凋亡作用。Bcl-2是进化相关蛋白家族。这些蛋白质控制线粒体外膜透性(MOMP),Bcl-2家族分为两类,一类是抗凋亡的主要有Bcl-2、Bcl-xl、Bcl-w和Mcl-1,一类是促进凋亡的主要包括Bax、Bak和Bok等。Bcl-2可阻止凋亡形成因子如细胞色素C等从线粒体释放出来,具有抗凋亡作用。p53是人体肿瘤抑制基因,由p53基因编码的蛋白质调控细胞周期的启动,p53介导的细胞信号转导途径在调节细胞正常生命活动中起重要作用。并且p53可以上调Bax的表达水平,以及下调Bcl-2的表达,从而促进细胞凋亡[23]。研究发现,在大鼠肝细胞中用ZEA处理后,胞浆中的细胞色素C增加,并且caspase-9和caspase-3被激活。经ZEA处理的肝组织中pPI3K、pAkt、Nrf2和Bcl-2蛋白质含量下降,这表明ZEA通过氧化应激诱导凋亡[11]。同时,ZEA显着抑制Bcl-2表达,并随后提高了裂解caspase-3、caspase-9和PARP的凋亡标记蛋白的水平,进一步导致蛋白酶级联切割放大,最终使细胞死亡[24]。另有相关研究表明,通过p53线粒体信号通路,ZEA会增加促凋亡因子/抗凋亡因子比值来诱导HepG2细胞中GSH和MMP水平下降[25],表明ZEA通过将细胞色素C释放到细胞质中的线粒体途径和caspase-3与caspase-9介导的线粒体通路导致肝脏凋亡坏死。
2.3 ZEA与细胞自噬
在正常的生理条件下,细胞可以保持非常低的自噬水平。但当细胞受到各种应激条件,如营养缺失、内质网应激和氧化应激时,为了生存,会自动触发自噬。自噬可以通过几种相互连接的信号通路触发,包括MAPK家族、PI3K-AKT-mTOR和ADP/ATP-AMPK信号通路(图3)。有研究表明,ERK和PI3K-Akt-mTOR信号通路参与了ZEA诱导的自噬过程。ERK信号通路通过抑制mTOR的磷酸化触发TM4细胞的自噬[26,27]。Wang Y等[28]研究发现,大鼠Leydig细胞暴露于ZEA后,上调了LC3-Ⅱ和Beclin-1的表达,表明ZEA诱导产生自噬。冯楠楠等[29]研究发现,一定浓度的ZEA可以通过PI3K/Akt/m TOR信号通路诱导睾丸支持细胞发生自噬。王雪[30]研究发现,ZEA可以上调大鼠胰岛β细胞中自噬相关蛋白的表达诱导自噬。目前,关于ZEA引起肝细胞自噬的机制研究尚不全面,因此研究ZEA的自噬机制仍有很大的空间。
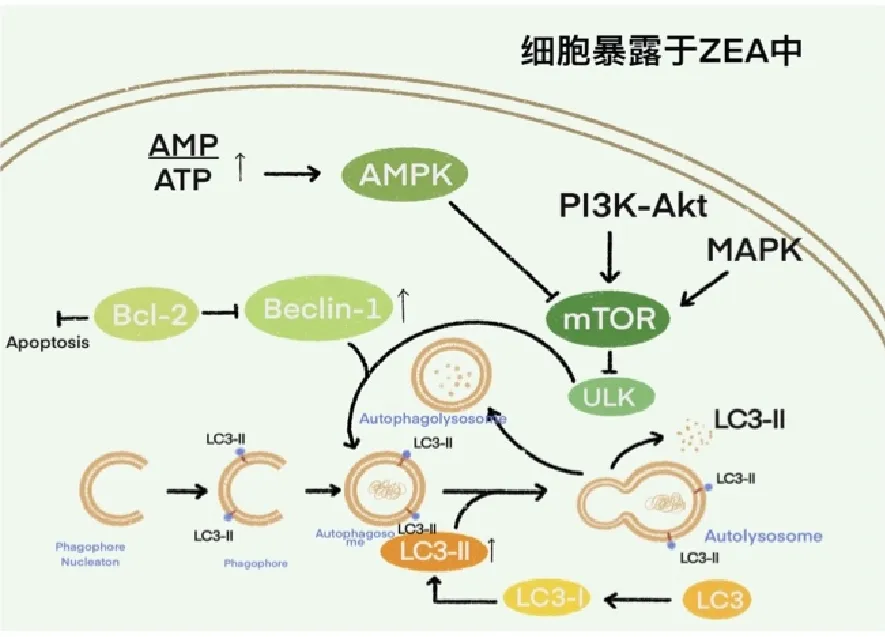
图3 ZEA诱导细胞自噬致肝损伤的机制
2.4 ZEA引发炎症
有研究发现,ZEA感染的小鼠肝脏中IL-6、TNF-α和IL-1β的水平明显升高,肝脏存在广泛的炎症灶,严重坏死,间质性水肿以及失去完整性,还发现了双核肝细胞、正弦空间的血肿、正弦和中央静脉的充血,以及肝细胞死亡[12],表明ZEA与炎症相关。ZEA感染的猪肝脏中促炎因子TNF-α、IL-8、IL-6、IL-1β和IFN-γ的含量升高,抗炎因子IL-4的含量降低,IL-10含量无明显变化,表明ZEA可以导致肝脏产生炎症反应[31]。MMP是参与与细胞因子网络密切相关的炎症过程的重要分子,Pistol等研究发现,MMP-2和MMP-9的含量,在喂食ZEA污染饮食的仔猪肝脏中有所下降,表明ZEA与炎症相关。
3 展望
玉米赤霉烯酮产自于发生霉变的玉米、小麦等谷物中,毒性强,不易代谢,耐热性强,高温也不容易破坏,ZEA在饲料中的污染十分严重,饲料污染后可对畜牧场造成巨大的经济损失和安全隐患,而且目前还没有安全有效环保的药物能够解决这一问题。因此,研究ZEA诱导肝损伤的具体机制有着极其重要的意义。目前对ZEA的研究大多集中在生殖系统方面,而对肝脏毒性的研究较少,个别研究集中在病理学方面。对肝脏的氧化应激与凋亡及其相关信号通路研究较少,本文就ZEA的氧化应激、凋亡自噬、炎症方面做了综述,旨在为探索绿色安全有效的药物提供理论基础,以期应用到ZEA中毒的临床防治中,以保证动物及人类的健康。可以预见的是,今后有关ZEA及其衍生物的综合毒性的相关研究将成为趋势。
