黄芪甲苷通过抑制卵泡颗粒细胞凋亡缓解糖尿病雌鼠生殖损伤
2021-12-14任雪华田佳卉雷安民
任雪华,文 扬,虞 莲,田佳卉,雷安民*
(1.西北农林科技大学动物医学院/陕西省干细胞工程技术研究中心,陕西杨凌 712100;2.西北农林科技大学动物科技学院,陕西杨凌 712100)
糖尿病作为一种慢性代谢性疾病,全球有超过6%的人口受到影响[1]。据国际糖尿病联合会报告,2019年全世界估计有4.63亿成年人患有糖尿病,预计2045年将上升到7亿。糖尿病患者体内高水平的血糖会对各种器官的结构和功能产生有害影响[2-3]。高血糖导致活性氧(reactive oxygen specie,ROS)的过量产生会促使细胞发生氧化应激进而对组织造成损伤。临床研究发现,糖尿病对女性卵巢功能的影响主要包括初潮延迟,多囊卵巢综合征,月经不调,无排卵和更年期提前以及卵母细胞质量下降[4]。另外,越来越多的动物模型表明,糖尿病会导致卵母细胞的内质网异常再分配,线粒体功能障碍,减数分裂装置解体,透明带厚度减小以及卵母细胞的表观遗传变化等问题[5-7],从而表现出糖尿病小鼠卵巢储备下降[8],卵母细胞质量下降和早期胚胎发育受损[9]。
黄芪甲苷(astragaloside Ⅳ,AS-Ⅳ)是提取自黄芪的三萜皂苷类单体成分,是黄芪主要的有效成分。药理学研究显示,黄芪甲苷具有降血糖、保护肝脏、充当利尿剂、并具有抗氧化、抗衰老、抗压力、抗高血压和广泛的抗菌性能[10-11]。药物动力学研究结果表明,小鼠在服用黄芪甲苷后,可以在肠道内转化为环黄芪醇[12],环黄芪醇在体外被证明拥有抗氧化功能并且能激活端粒酶保护端粒[13-14],而端粒长度与细胞增殖能力成正比,即端粒酶的激活可以增加细胞的增殖能力,抵抗细胞的凋亡[15]。
本研究通过使用链脲佐菌素(streptozocin,STZ)制造1型糖尿病(type 1 diabetes,T1D)模型小鼠,并按每次50 mg/kg对小鼠进行黄芪甲苷灌胃,每天2次,持续1周[16]。通过统计比较各组卵母细胞体内外发育情况、卵巢组织结构来探究灌胃黄芪甲苷对1型糖尿病雌鼠生殖系统的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄~8 周龄ICR系雌性小鼠,购自维通利华试验动物有限公司。
1.1.2 主要试剂 黄芪甲苷、链脲佐菌素,麦克林公司产品;Milrinone、M2培养基、TritonX-100、PBS、苏木精、伊红、矿物油、柠檬酸钠、柠檬酸,Sigma-Aldrich 公司产品;免疫荧光染色封闭液、免疫荧光染色一抗稀释液、免疫荧光染色二抗稀释液、免疫荧光染色抗荧光淬灭剂、α-Tubulin抗体、FITC标记的山羊抗鼠二抗、Tunel凋亡检测试剂盒、DAPI,碧云天生物技术有限公司产品;人绒毛膜促性腺激素(hCG,180428)、孕马血清(PMSG,120727),宁波三生药业有限公司产品。
1.1.3 主要仪器 血糖仪(GA-3)、一次性使用末梢采血针,三诺生物传感股份有限公司产品;二氧化碳培养箱,Thremo Fisher Scientific公司产品;体式显微镜,Olympus公司产品;荧光相差倒置显微镜、恒温加热台,Leica公司产品;电子天平,Mettler Toledo公司产品。
1.2 方法
1.2.1 雌性TID模型鼠制备 购买6周龄~8周龄体重在25 g以上的ICR雌鼠进行试验,试验前进行适应性喂养2周,药物注射前隔夜禁食。将STZ用0.1 mol/L pH为4.2的柠檬酸钠/柠檬酸缓冲溶液溶解,并按照每只230 mg/kg进行腹腔注射。给与充分的饲料与净水饲养3 d。3 d后空腹一晚,次日尾静脉采血并用血糖仪检测血糖,血糖值高于17 mmol/L的小鼠可以被认定为造模成功。对于造模不成功的小鼠,可按STZ 100 mg/kg再次腹腔注射造模。
1.2.2 实验动物分组与药物灌胃 将造模成功小鼠随机分成模型组(TID)和治疗组(TID+AS-Ⅳ),每组20只小鼠,另取20健康ICR雌性小鼠作为对照组。将黄芪甲苷用生理盐水配制成3.75 mg/mL的灌胃液,4 ℃保存,使用前室温平衡。每日早晚2次灌胃给药,空白对照组不进行灌胃,模型组灌胃等量生理盐水,治疗组按体重50 mg/kg灌胃黄芪甲苷溶液,持续1周。
1.2.3 卵母细胞收集与培养 采集GV期卵母细胞前44 h~46 h 按10 IU/只剂量对小鼠腹腔注射PMSG超数排卵。颈部脱臼处死小鼠取出卵巢,在体式显微镜下,用小镊子固定卵巢,通过1 mL注射器针头撕破卵巢上的卵泡,待卵巢上所有卵泡均被撕破后,用捡卵针迅速将卵丘-卵母细胞复合体(cumulus oocyte complexes,COCs)移入含有2.5 μmol/L Milrinone的M2培养基中放入培养箱,4 h后统计生发泡破裂(germinal vesicle breakdown,GVBD)率,12 h后统计第一极体(polarbody 1,PB1)率。
采集MⅡ卵母细胞前44 h~46 h按每只10 IU剂量对小鼠腹腔注射PMSG进行超数排卵,12 h~14 h前按每只10 IU剂量腹腔注射hCG促进卵母细胞排出。颈部脱臼处死小鼠取出其左右两侧的输卵管,在体式显微镜下通过1 mL注射器针头将膨大的输卵管壶腹部撕破,从而使得卵母细胞排出,用稍粗的捡卵针迅速将释放出来的COCs移入M2培养基中培养备用。
1.2.4 卵母细胞免疫荧光 分别收集各组GV期培养12 h后的卵母细胞,在10 mg/mL的PFA中4 ℃过夜固定;用PBS缓冲液洗涤3次,移入5 mL/L的Triton X-100 中室温透膜20 min;PBS洗涤3次,转入免疫荧光封闭液中室温封闭1 h;PBS洗涤3次,移入一抗(1∶200)中4 ℃孵育过夜;之后将卵母细胞在PBS中漂洗3次,每次5 min,移入二抗(1∶2 000)中室温避光孵育2 h;PBS漂洗3次,每次5 min,随后将卵母细胞移入Hoechst 33342中室温避光孵育5 min;PBS漂洗3次,每次5 min,将卵母细胞移入用凡士林划线并具有抗荧光淬灭剂的载玻片小格中,封片,最后用荧光显微镜观察并拍照。
1.2.5 卵巢石蜡切片制作与HE染色 小鼠断颈处死后,取出卵巢,PBS清洗,投入40 mg/mL的PFA中,过夜固定。将固定好的卵巢梯度脱水。随后将卵巢用二甲苯透明处理。处理好的卵巢在60 ℃烘箱中浸蜡,并调整好卵巢位置进行包埋。包埋好的蜡块在超薄切片机上切片,厚度一般为 5 μm~7 μm。将切好的切片在45 ℃预热的展片机上展片,待展开后用黏附载玻片捞取切片,并在显微镜下镜检,挑选形态结构清晰的切片并用铅笔在载玻片上相应位置标记,并进行脱蜡与复水,将复水后的切片用苏木精处理8 min,自来水浸泡蓝化20 min,伊红染液3 min,随后脱水。染完的切片用树胶封片并在显微镜下观察。
1.2.6 卵巢切片Tunel凋亡检测 在脱蜡与复水的切片上滴加20 μg/mL不含DNase的蛋白酶K,置于湿盒中 37 ℃作用30 min。在避光环境下,向组织上滴加50 μL 配制好的Tunel反应液,于湿盒中37 ℃避光孵育60 min。用抗荧光淬灭封片液封片后荧光显微镜下观察。激发波长范围为450 nm~500 nm,发射波长范围为515 nm~565 nm(绿色荧光)。
1.2.7 活性氧(ROS)检测 用卵母细胞体外操作液MEM稀释DCFH-DA使其终浓度为10 μmol/L,将培养的卵母细胞移入此检测液中清洗3遍,并移入新的检测液中,放置于二氧化碳培养箱中孵育20 min,随后用PBS清洗卵母细胞3遍后,将卵母细胞移入带有抗荧光猝灭剂并用凡士林划好小格的切片中,盖上盖玻片后在荧光显微镜下观察。荧光强度的灰度值分析用Image J进行。
1.2.8 数据分析 每个统计至少3个生物学重复,每个重复是由一个独立的试验在不同的时间完成。荧光强度用Image J进行分析,试验数据使用GraphPad Prism 6.0进行方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 黄芪甲苷对T1D雌鼠卵母细胞发育能力的影响
T1D模型小鼠制备与药物处理时间如图1所示。对成功建模的模型小鼠进行超数排卵,收集各组各时期的卵母细胞,其卵母细胞形态以及各个阶段卵母细胞数量如图2所示。T1D雌性小鼠的MⅡ期卵母细胞在形态上与正常卵母细胞相比有明显的差距,其胞质碎片增多,并且透明带形态也不完整(图2A)。在使用黄芪甲苷灌胃后,治疗组雌鼠排卵数相较模型组T1D雌鼠有了大的提升,每只12.6枚±1.7枚,显著高于模型组每只1.6枚±1.2枚(P<0.05),并且卵母细胞形态接近于对照组雌鼠。同时发现灌胃黄芪甲苷也可以提高T1D雌鼠GV期卵母细胞体外发育能力,治疗组GVBD率为32.9±5.9、PB1率为13±4.1,均高于模型组GVBD率(13±2.3)、PB1率(0.8±0.79)(P<0.05)(图2B、图2C、图2D)。这说明黄芪甲苷处理可以挽救T1D雌性小鼠的生殖潜力,帮助其改善高血糖对卵巢的损伤,恢复卵巢一定的功能。

图1 模型小鼠药物处理示意图
2.2 黄芪甲苷对T1D雌鼠卵母细胞纺锤体及ROS水平的影响
为了进一步探究黄芪甲苷改善T1D雌鼠生殖潜力的机理,将各组收集的GV期卵母细胞体外培养12 h,通过DAPI与Tubulin免疫荧光染色观察各个组的纺锤体形成情况。如图3A所示,对于T1D组,其纺锤体形成似乎受到了抑制,这可能是T1D组体外发育过程中没有卵母细胞发育到MⅡ期的原因。但对于黄芪甲苷处理组,虽然成功形成了纺锤体,但其纺锤体形态相较于正常组更为短小,而且染色体排列也不均匀。同时,收集了GV、GVBD、PB1三个时期的卵母细胞,并对其进行了ROS染色,结果如图3B所示。通过量化荧光强度,发现模型组GV期卵母细胞的ROS含量高于其他组,而后荧光强度快速下降;治疗组的ROS水平在GVBD期较GV期上升,且高于其他2组,在PB1时期又下降;而对照组的ROS水平从GV期开始上升,在PB1期高于其他2组。这说明T1D雌鼠与正常小鼠卵母细胞ROS的变化规律不同,而黄芪甲苷可以改变这种差异。由于细胞内ROS的产生与线粒体活性相关这可能在暗示T1D会使得卵母细胞中线粒体提前进入激活状态,而黄芪甲苷则会推迟T1D的这种作用。由于在卵母细胞成熟过程中,第一次减数分裂阻滞依赖于颗粒细胞cGMP进入卵母细胞[17]。因此,推测这种异常的激活可能与颗粒细胞相关。
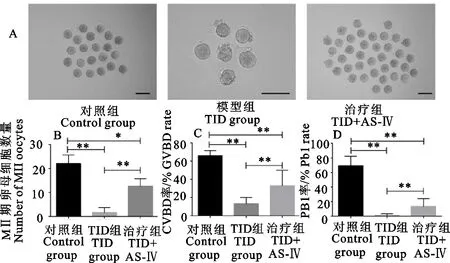
A.MⅡ期卵母细胞形态;B.MⅡ期卵母细胞数量;C.PB1率;D.GVBD率。比例尺100 μm。*(P<0.05),**(P<0.01)
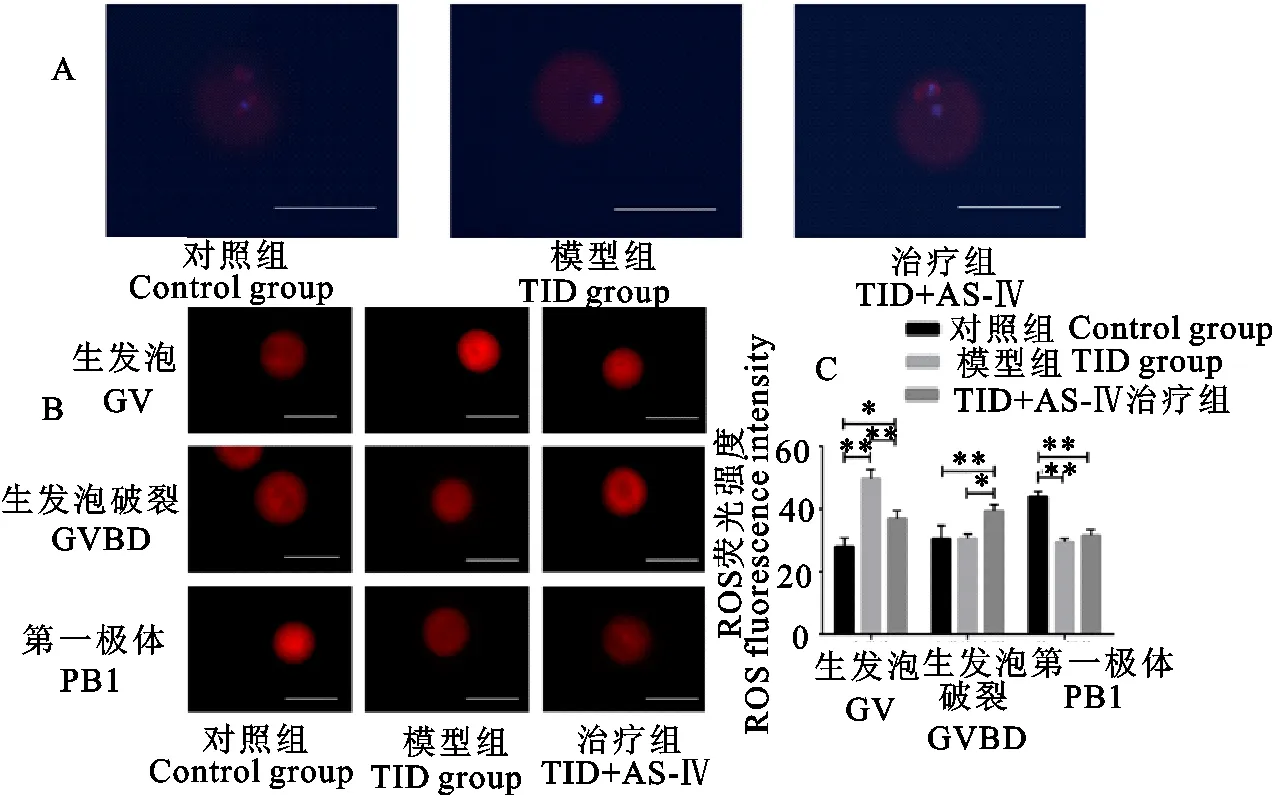
A.体外培养12h后,各组卵母细胞Tubulin与DAPI染色;B.各组卵母细胞各个阶段DCFH-DA染色;C.各组DCFH-DA染色后荧光强度。比例尺100 μm
2.3 黄芪甲苷对T1D雌鼠卵巢结构的影响
为了验证前面所提出的是颗粒细胞异常导致卵母细胞异常激活,从而引发T1D雌鼠生殖缺陷的推测,采集了3组雌鼠的卵巢并通过HE染色与凋亡染色进行了探究,结果如图4所示。从图4A~图4C可以发现,对于T1D雌鼠卵巢而言,几乎没有格拉夫氏卵泡与黄体。这与前面模型组MⅡ期排卵数数据显示的结果一致,模型组雌鼠几乎不排卵。通过进一步观察卵巢上的颗粒细胞,发现如图4E所示,对于T1D雌鼠,卵泡中卵母细胞上的颗粒细胞层数要明显少于对照组D和治疗组F。由于高糖介导细胞凋亡已有众多的报道,据此我们推测这种颗粒细胞层数的减少可能与颗粒细胞的异常凋亡有关,为了验证这个猜想,我们对卵巢组织进行了Tunel凋亡染色,如图4G~图4J所示,通过Tunel凋亡染色,发现T1D雌鼠卵巢中颗粒细胞异常凋亡卵泡所占比例远高于对照组G和治疗组I。
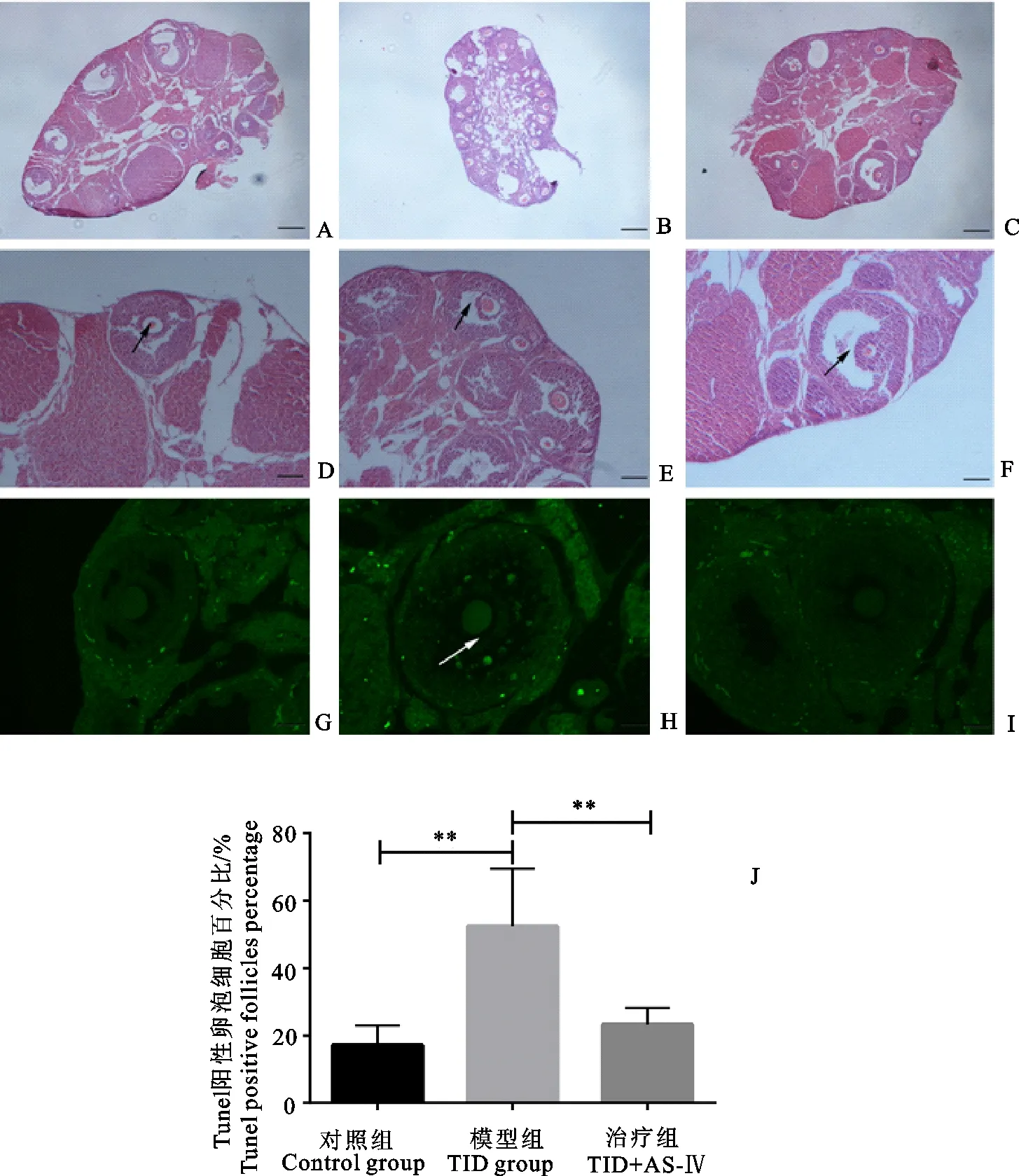
A~F.卵巢切片的HE染色图;G~I.卵巢切片的Tunel染色图;J.各组凋亡卵泡数与总卵泡数比值。A、B、C比例尺为1 mm;D、E、F比例尺为100 μm;G、H、I比例尺为50 μm。**(P<0.01)
3 讨论
在前人对糖尿病导致卵母细胞损伤的研究中,发现对于糖尿病小鼠而言,其排卵数量明显较少,卵母细胞ROS含量上升,表观遗传发生改变,后续发育潜力受损[18],在本研究也重现了这一点。有趣的是在对T1D雌鼠卵母细胞抑制过程的研究中,发现对于T1D雌鼠卵母细胞,其极易被阻滞在GV期,并且细胞核和细胞质出现了明显不统一的发育节奏,这可能是其卵母细胞发育不良的重要原因。另外,高血糖使得细胞内ROS的上升[19],如图3B所示,T1D雌鼠的GV期卵母细胞相较于对照组与黄芪甲苷治疗组其在GV期时就表现出高的ROS水平,而正常组卵母细胞ROS水平要到PB1之后才有明显升高,这说明对于T1D雌鼠而言,其胞质内的线粒体在其启动减数分裂以前就已充分激活。在关于ROS与细胞周期的研究中,人们发现ROS会使得细胞内一些关键性的蛋白如MAPKS异常的磷酸化,而这些蛋白的磷酸化会使得一些细胞内通路的异常开启或者关闭,从而引发细胞周期的紊乱等,如MAPK通路的持续激活就可以使得停滞在G1期[20]。此外,ROS含量与DNA损伤也息息相关,端粒DNA被认为特别容易受到ROS介导的切割和碱基修饰的影响[21],从而造成DNA损伤进而激活了p53蛋白的活性,上调周期激酶抑制剂p21蛋白的水平或者凋亡通路蛋白水平,最终导致细胞G2/M期阻滞甚至细胞凋亡。颗粒细胞在卵母细胞减数分裂恢复中也发挥着重大作用,颗粒细胞中的cGMP能够进入卵母细胞抑制cAMP-磷酸二酯酶活性,维持cAMP浓度,并使细胞质成熟促进因子(maturation promoting factor,MPF)处于非活化态,维持减数分裂阻滞,在T1D雌鼠中我们观察到其卵泡中的颗粒细胞凋亡比例要远远高于正常组,因此这种T1D雌鼠的提前激活也可能是由于其颗粒细胞过度凋亡而引起的。采用黄芪甲苷治疗T1D雌鼠,可以发现对比模型组,治疗组在GV期的ROS含量虽然比正常组要稍微高一点,但是却比模型组要低,提示黄芪甲苷可以通过减少细胞内ROS的积累从而减少ROS对细胞周期的影响。且黄芪甲苷灌胃之后卵泡颗粒细胞的凋亡明显较少,这也助于抑制因颗粒细胞凋亡引发的卵母细胞激活。除此之外,黄芪甲苷的体内代谢物环黄芪醇是目前已知的一种端粒酶激活剂,其可以在体外培养的细胞中激活端粒酶从而修复因细胞分裂或者外部影响导致的端粒变短与受损[22]。据此推测环黄芪醇在这个过程中可能也起到了一定的作用。
在本研究中,通过链脲佐菌素建立T1D雌鼠模型,并对模型小鼠进行黄芪甲苷灌胃,研究黄芪甲苷对T1D雌鼠生殖系统的影响。结果发现黄芪甲苷可以抵抗T1D对小鼠卵巢造成的损伤,但是并不能完全的逆转,其可能是通过帮助颗粒细胞抵抗凋亡而实现的。本试验研究黄芪甲苷对糖尿病小鼠雌性生殖系统的影响,一方面能为临床上应用黄芪甲苷治疗糖尿病奠定基础,另一方面也为黄芪甲苷对糖尿病的治疗效果以及作用机理研究提供新的理论依据。
