酸浆苦味素B在大鼠体内的药代动力学参数及组织分布研究
2021-12-14张炯怡谢明军宋晓宁张志勇
王 勇,张炯怡,谢明军,宋晓宁,马 莹 ,张志勇
(1.贵州省食品药品检验所,贵州贵阳 550004;2.贵州省食品检验检测院,贵州贵阳 550004;3.贵州省药品监督管理局,贵州贵阳 550004)
在新药的研究与开发过程中,临床前药代动力学研究具有重要的意义,良好的药代动力学性质和较低毒副作用是药物通过临床试验的关键,也是先导物筛选、结构优化的重要参考依据。统计数据显示,药物研究过程中,由于药代动力学参数不理想而淘汰的药物,占到新药开发的50%。因此,在药物研发早期进行药代动力学研究,可更快捷地获得安全有效的活性药物,并通过药物在体内的吸收、分布及消除特点,为活性药物的结构改造提供科学依据。
酸浆属茄科酸浆属植物PhysalisalkekengiL.var.franchetii,又名红姑娘、 挂金灯、 灯笼草等[1]。酸浆性寒味苦,归肺经,具有清热解毒、利咽化痰、利尿通淋等功效,常用于咽痛音哑、痰热咳嗽、小便不利、热淋涩痛、天疱疮和湿疹治疗[2]。我国酸浆的野生资源丰富,全国大部分地区均有分布,北方较多,吉林、河北、新疆等地为主要产区[3]。据研究报道,锦灯笼具有抗炎、抗菌、利尿、抗癌等多种药理作用[1]。酸浆的化学成分早期已被广泛报道[4-5],目前为止,从酸浆中已经分离出120多种成分[6],包括生物碱、甾体、黄酮和苯丙素类等。其中,甾体(主要为酸碱苦味素类)被广泛认为是酸浆的特征活性物质。
本课题组长期致力于研究酸浆在治疗胃溃疡方面的应用,前期结果显示,酸浆超微粉以及酸浆乙酸乙酯萃取部位均具有显著的抗炎和抗胃溃疡活性,而且对幽门螺杆菌(Hp)具有一定抑制活性[7-8]。通过进一步研究,发现酸浆苦味素B是酸浆抗胃溃疡活性的物质基础,具有显著的体内抗胃溃疡活性[9],有一定的开发价值。为了进一步了解酸浆苦味素B在体内的吸收和分布规律,本研究对其药代动力学参数及组织分布进行系统的研究。
1 材料与方法
1.1 材料
1.1.1 药物和试剂 酸浆苦味素B,贵州省食品药品检验所科研室自制;安西萘德(批号:510020-201401,纯度为99.5%),中国食品药品检定研究院产品;甲酸(色谱纯)和羧甲基纤维素钠(分析纯),天津市科密欧化学试剂有限公司产品;乙酸乙酯(色谱纯),上海安谱实验科技股份有限公司产品;乙腈(色谱纯),德国默克股份两合公司产品;氯化钠(优级纯),国药集团化学试剂有限公司产品。
1.1.2 实验动物 SD大鼠(180 g~220 g),购自贵州医科大学实验动物中心(证书编号:SCXK 2002-0001,中国贵阳)。试验前适应实验室环境3 d,在相对温度25 ℃±2 ℃和相对湿度50%±5%,12 h光照与12 h黑暗的标准条件下用聚丙烯鼠笼分开饲养。动物试验方法经贵州医科大学动物委员会认可。试验前禁食12 h,自由饮水。
1.1.3 仪器设备 液质联用仪(UPLC-MS,型号:Xevo TQ,MassLynx V4.1工作站),沃特世科技有限公司产品;电子天平(XS105DU)、精密度酸度计(SevenExcellence),梅特勒-托利多国际有限公司产品;离心机(RPM/RCFX1000),丹麦ScanSpeed公司产品;涡旋混合器(Stander vortex mixer),美国Talboys公司产品;超声波清洗仪(KQ500DE),昆山市超声仪器有限公司产品;电热鼓风干燥箱(GZX-9240MBE),上海博讯实业有限公司医疗设备厂产品;纯水-超纯水一体机系统(明澈D24UA),德国默克密理博公司产品。
1.2 方法
1.2.1 分析条件的建立
1.2.1.2 质谱条件 离子源:ESI;检测方式:正离子模式;扫描方式:多反应监测MRM;选择监测离子对:酸浆苦味素B为m/z 493.33/475.255,安西奈德为m/z 338.9/321;毛细管电压:4 000 V;锥孔电压:酸浆苦味素B为28 V,安西奈德为20 V;去溶剂温度:500 ℃;离子源温度:120 ℃;脱溶剂气流量:1 000 L/Hr;反吹气流量:50 L/Hr;碰撞能量:493.33为16 V,475.255为18 V,338.9为10 V,321为10 V。
1.2.2 试验准备
1.2.2.1 内标的选择 在进行液相质谱分析时,对于理想内标物的选择,应具有稳定、结构与待测物相似、质量数差别不大、色谱行为也能接近,如保留时间应尽量接近待测物等特征,其中待测物的同位素普遍认为是最理想的内标物,但本研究中酸浆苦味素B的氘代物难以制备。因此,通过对与酸浆苦味素B结构相似的41种糖皮质激素类甾体化合物进行筛选,以寻找最佳的内标物质。
1.2.2.2 溶液的配制 酸浆苦味素B标准溶液的配制:精密称取10.4 mg酸浆苦味素B,置于10 mL容量瓶中,甲醇溶解并定容至刻度,摇匀,得1.04 mg/mL的储备液。精密取适量储备液,用甲醇稀释得5 200、2 600、520、260、52、26、5.2 ng/mL浓度的系列标准工作溶液,置-20 ℃保存。
安西萘德内标溶液的配制:精密称取10.9 mg酸浆苦味素B,置于10 mL容量瓶中,甲醇溶解并定容至刻度,摇匀,得1.09 mg/mL的内标储备液。精密量取内标储备液100 μL,置于100 mL容量瓶中,甲醇稀释得1.09 μg/mL的内标溶液,置-20 ℃保存。
1.2.2.3 生物样品的采集与制备
(1)给药方案 药代动力学研究:取SD大鼠15只,雌雄各半,体重180 g~230 g,分为高、中、低3个剂量组,每组5只,试验前禁食1 d,自由饮水。试验时,3组给药剂量分别为4.968、9.935、19.87 mg/kg。
组织分布研究:取SD大鼠18只,雌雄各半,体重180 g~230 g,分为3组,每组6只,试验前禁食1 d,自由饮水。 试验时, 3组给药剂量均为19.87 mg/kg。
(2)血浆的采集与制备 每个剂量组在灌胃后不同时间点分别于尾静脉取血,收集于含肝素钠的玻璃离心管,3 000 r/min离心10 min,分离得上清即为血浆,置-80 ℃保存。
(3)组织的采集与匀浆液的制备 经给药后不同时间点,分别处死一组大鼠,立即取脑、心、肝、脾、肺、肾、胃、十二指肠、小肠、大肠、直肠、卵巢、脂肪和肌肉组织各2 g,表面用生理盐水将血液清洗干净后,用滤纸吸干水分,称重,至于玻璃匀浆管中,加入3倍生理盐水进行研磨匀浆,即得各组织匀浆液,置-80 ℃保存。
1.2.2.4 大鼠血浆与组织样品的预处理 取血浆或组织匀浆液300 μL于1.5 mL EP管中,加入内标溶液400 μL,涡旋2 min,加入800 μL乙酸乙酯,涡旋2 min,超声提取10 min,12 000 r/min离心5 min,精密吸取400 μL上层乙酸乙酯提取液,至新的EP离心管中,40 ℃氮气吹干,残留物以800 μL 500 mL/L甲醇水溶液复溶,12 000 r/min离心5 min,上清液经0.22 μm滤膜过滤,装进样小瓶,备用。
1.2.3 方法学验证 本研究的分析方法通过欧洲药品管理局(European Medicine Agency,EMA)关于生物分析方法验证指导方针进行验证[1],依次考察方法的专属性、线性范围、检出限、定量限、日内精密度、日间精密度、准确度、提取回收率、基质效应和稳定性。
1.2.3.1 方法的专属性 取大鼠空白血浆或空白组织匀浆液200 μL,除内标安西奈德用200 μL甲醇代替外,氮气吹干后按“血浆与组织样品的预处理”项下方法操作,进样5 μL,得色谱图;取200 μL一定浓度的酸浆苦味素B和安西奈德内标混合溶液,氮气吹干后,加入200 μL空白血浆或空白组织液,依同法操作,得色谱图;取大鼠口服灌胃酸浆苦味素B后的血浆样品或组织匀浆液,加入200 μL内标溶液,同法操作,得色谱图。通过分析比较,考察酸浆苦味素B和内标物质的专属性。
1.2.3.2 线性范围、检出限和定量下限 分别取400 μL系列浓度对照品溶液,按“血浆与组织样品的预处理”项处理,配制成相当于酸浆苦味素B血浆、脑匀浆液、心匀浆液、肝匀浆液、脾匀浆液、肺匀浆液、肾匀浆液、小肠匀浆液、大肠匀浆液、直肠匀浆液、卵巢匀浆液、脂肪匀浆液和肌肉匀浆液质量浓度分别为1.3、6.5、13、65、130、650、1 300 ng/mL的系列标准溶液, 以及相当于酸浆苦味素B胃匀浆液和十二指肠匀浆液质量浓度分别为1.3、6.5、13、65、130、650、1 300、6 500 ng/mL的系列标准溶液,12 000 r/min离心10 min,上清过0.22 μm的滤膜,取5 μL进行UPLC-MS/MS分析。按色谱峰信噪比约等于3∶1时酸浆苦味素B的浓度为最低检出限,信噪比约等于10∶1时酸浆苦味素B的浓度为定量限。
1.2.3.3 精密度与准确度 取空白血浆和空白组织匀浆液300 μL按上述“血浆与组织样品的预处理”制备低、中、高3个浓度质控样品,每个浓度进行5样本分析,连续测定3 d,根据随行标准曲线计算QC样品的浓度,浓度值的相对标准偏差(RSD)即为精密度,准确度则通过相对误差表示(RE),即(实测浓度-加入标准浓度)/加入标准浓度×100%,准确度应在±15% 范围内,日内精密度和日间精密度不能超过15%,定量限附近的RSD和RE应小于20%。
1.2.3.4 提取回收率与基质效应 取高、中、低3个浓度对照各400 μL,按“血浆与组织样品的预处理”操作制备不同浓度的血浆和组织样品,进样5 μL,记录峰面积A2。同时另取大鼠空白血浆或空白组织匀浆液各300 μL,除不加系列浓度对照和内标混合溶液外,按“血浆或组织样品预处理方法”项下操作,在获得的400 μL空白血浆或空白组织匀浆液的乙酸乙酯萃取液中加入200 μL高、中、低浓度的对照和内标混合溶液,氮气吹干,残留物用800 μL 500 mL/L甲醇水溶液复溶,取5 μL进样分析,记录峰面积A3。取高、中、低3个浓度对照各200 μL,置于1.5 mL离心管,氮气吹干后直接用800 μL 500 mL/L甲醇水溶液复溶,记录分析得峰面积为A1。各浓度制备平行样5份。计算公式为:
提取回收率=(A2/A3)×100%
基质效应=(A3/A1)×100%
1.2.3.5 稳定性 取相应浓度对照溶液400 μL,按“血浆与组织样品的预处理”制备高、中、低3个浓度血浆和组织匀浆液样品各5份。用于考察含药血浆或组织样品处理好后溶液中分析物在自动进样器放置12 h、室温放置12 h、-20 ℃储存4周和反复冻融3次的稳定性。以测得值占QC样品已知浓度的百分率表示待测物的稳定性。
1.2.4 数据分析 采用药代动力学处理软件DAS2.0非房室模型法,计算药代动力学参数,运用SPSS对试验数据进行统计分析。
2 结果
2.1 内标物质的选择
选择内标时,先后考察了41种糖皮质激素类甾体化合物,其中安西奈德与酸浆苦味素B结构相似、分子质量相近、具有相似的物理化学性质、峰形和出峰时间相接近且化学性质稳定,并且其在后续各基质中的提取回收率与基质效应较一致,综合考虑,选择安西奈德作为本研究的内标物质。
2.2 方法学考察结果
2.2.1 专属性 采用上述试验所优化的LC-MS/MS条件,酸浆苦味素B和安西奈德的保留时间分别为3.96 min和4.32 min。如图1和图2所示,酸浆苦味素B和内标安西奈德互不干扰,空白血浆和空白组织液中的内源性物质不干扰待测物和内标的测定,锋形良好,无杂峰,基线平稳,说明该方法具有良好的专属性。

A.空白大鼠血浆;B.空白大鼠血浆加入酸浆苦味素B和安西奈德;C.大鼠灌胃给药后的血浆样品
2.2.2 线性范围、检出限和定量下限 以对照峰面积与内标峰面积的比值为纵坐标y,酸浆苦味素B血浆或组织匀浆液质量浓度为横坐标x,采用最小加权二乘法(W=1/X2)进行线性回归,求得标准曲线的方程为:y=ax+b。结果表明,酸浆苦味素B血浆样品及各组织样品在1.3 ng/mL~1 300 ng/mL和1.3 ng/mL~6 500 ng/mL范围内呈良好的线性关系,相关系数均大于0.99。同时,定量限均为1.3 ng/mL,检出限均为0.325 ng/mL。
2.2.3 精密度和准确度 3个不同浓度质控样的日内精密度,日间精密度和准确度结果显示,酸浆苦味素B日内精密度的RSD范围是0.68%~12.42%,日间精密度的RSD范围是2.89%~12.31%,且准确度的相对误差范围在-8.34%~+9.41%之间,说明所使用的方法对于血浆和组织匀浆液中酸浆苦味素B的测定是准确和可重复的,符合生物样品分析方法的要求。

A.空白大鼠胃组织匀浆液;B.空白大鼠胃组织匀浆液加入酸浆苦味素B和安西奈德; C.大鼠灌胃给药后的胃组织匀浆液样品
2.2.4 提取回收率与基质效应 试验结果显示,高、中、低3个浓度血浆和组织匀浆液样品提取回收率范围为91.7%~112.22%,内标物质安西奈德在各基质的提取回收率为94.17%~118.77%,RSD<15%。同时,3个浓度LC-MS/MS基质效应范围为91.68%~109.70%,内标安西奈德在各基质中的基质效应为93.50%~106.03%。说明血浆或不同组织匀浆液样品中酸浆苦味素B和安西奈德的测定没有显著的基质效应,符合生物样品分析方法的要求。
2.2.5 稳定性 血浆和组织液样品在自动进样器放置12 h、室温放置12 h、-20 ℃储存4周和反复冻融3次的稳定性分析数据显示,RSD均在14.19%以内,说明各化合物的稳定性良好。
2.3 血药浓度数据的测定及浓度时间曲线
大鼠口服灌胃4.968、9.935、19.87 mg/kg 3个剂量酸浆苦味素B后,于不同时间点采集大鼠血液,运用经过方法学验证后的UPLC-MS/MS方法对收集的血浆进行测定,计算每个时间点对应的血药浓度,绘制浓度时间曲线(图3)。
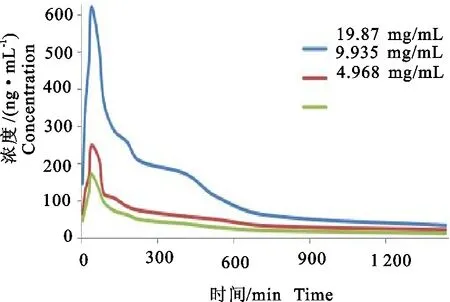
图3 口服灌胃各剂量组酸浆苦味素B后大鼠血浆中的药物浓度-时间曲线(n=6)
2.4 酸浆苦味素B在大鼠体内的药代动力学参数
本研究运用DAS2.0软件,通过非房室模型对酸浆苦味素B在大鼠体内的血药浓度进行拟合,求算其药代动力学参数。主要药代动力学参数见表1。由分析结果可知,3个剂量组的平均血药浓度峰值Cmax分别为(169.086±6.641)μg/L、(247.513±23.434)μg/L和(619.567±28.201)μg/L,达峰时间Tmax均为0.667 h,终末半衰期t1/2z分别为(8.975±2.966)h、(10.022±3.196)h和(5.912 h±2.271)h,清除率CLz/F分别为(5.722±0.796)L/h·kg、(7.001 7±1.196)和(6.277±0.693)L/h/kg,药时曲线下峰面积AUC(0-24)分别为(748.735±47.13)μg/L·h、 (1 189.897±100.436)μg/L·h和(2 963.312±176.7)μg/L·h,表观分布容积Vz/F分别为(71.599±17.172)L/kg、(97.046±21.549)L/kg和(51.917±15.641)L/kg,平均驻留时间MRT(0-24)分别为(6.811±0.372)h、(7.342±0.401)h和(6.304±0.381)h。结果显示,酸浆苦味素B灌胃后在大鼠体内吸收迅速,与之前文献[5]报道的酸浆苦味素D、酸浆苦味素G和4,7-二脱氢新酸浆苦味素B的大鼠药动参数相似,这可能与酸浆苦味素B的结构相关。

表1 3个剂量下酸浆苦味素B的药动学参数
2.5 酸浆苦味素B在大鼠体内的组织分布情况
大鼠在20、50、180 min 3个时间点以19.87 mg/kg剂量灌胃酸浆苦味素B后,在脑、心、肝、脾、肺、肾、胃、十二指肠、小肠、大肠、直肠、卵巢、脂肪和肌肉14个组织中均有检出相应浓度,表明酸浆苦味素B经灌胃后,可迅速分布于各组织中(表2),分布顺序如下,给药20 min后:胃>十二指肠>肺>卵巢>脂肪>肾>肝>小肠>直肠>大肠>脾>心>肌肉>脑;给药50 min后:胃>十二指肠>小肠>肾>脂肪>卵巢>肝>脾>直肠>心>肺>大肠>肌肉>脑;给药180 min后:十二指肠>胃>肝>小肠>脂肪>大肠>直肠>肺>心>卵巢>肌肉>肾>脾>脑。由表中的数据可以看出,脑、心、肝、脂肪、肌肉和直肠中酸浆苦味素B的含量随着时间的增加浓度逐渐增高;脾、肾、胃、十二指肠和小肠组织中酸浆苦味素B的浓度在50 min时达到峰值,180 min时浓度出现下降的趋势;卵巢中酸浆苦味素B的浓度随时间的增加浓度逐渐降低;20 min时,肺、大肠和脂肪组织中酸浆苦味素B浓度高,50 min时浓度降低,180 min时有所增加;肺在20 min时浓度达到峰值,大肠在180 min时达到峰值。综合各数据,酸浆苦味素B主要分布于胃、十二指肠和小肠组织,而脑中的含量在3个时间点均最低。

表2 大鼠口服灌胃19.87 mg/kg酸浆苦味素B后不同时间点药物在各组织中的分布情况
3 讨论
液相色谱-质谱-质谱联用技术(LC-MS/MS)技术自20世纪70年代问世以来,经过快速的发展和更新换代,技术已趋于成熟[10],目前被广泛运用于中药的鉴别、质控、筛选,以及药代动力学方面的研究[11-12]。进行药物的药代动力学研究,是为了从具有复杂基质的生物样本中定量检测出需要的微量目标物,但由于生物样品基质复杂,待测物浓度较低,待测样本数量大,因此在药代动力学研究中,建立准确、快速、灵敏和高通量的生物样品定量分析方法是关键点,而LC-MS/MS以其对多种药物的通用性,检测的专属性,高灵敏度和快速的分析时间方面的优势,已迅速成为一种在药代动力学研究中不可或缺的测量工具[13-15]。现已有关于源自酸浆的酸浆苦味素D、酸浆苦味素G和4,7-二脱氢新酸浆苦味素B在大鼠体内进行药代动力学研究的文献报道[16],但关于酸浆苦味素B的药代动力学考察,目前只有1篇静脉注射给药方式的相关研究[17]。对于口服给药方式的研究,目前尚未见报道。
本研究应用DAS2.0软件对测定数据进行了一房室模型,二房室模型和非房室模型计算,结果发现相比较一房室模型和二房室模型,非房室模型的拟合值更接近于真实值,因此,本研究选择非房室模型对测定血药浓度时间值进行计算。试验结果显示,灌胃不同剂量的酸浆苦味素B,血浆的含药量随给药剂量的增加而增高,呈剂量依赖关系。对于AUC来说,也呈现成比例的剂量依赖关系,剂量增长比例为1.0∶2.0∶4.0时,AUC值的比例为1∶1.6∶4.0。药物在血浆中的达峰时间均为0.667 h,一方面,表明药物经灌胃后吸收较快,另一方面,说明达峰时间与用药剂量无关。将3个剂量的半衰期进行t检验,低剂量与中剂量之间无显著差异(P>0.05),低剂量与高剂量之间无显著差异(P>0.05),但中剂量与高剂量之间差异显著(P<0.05),说明药物半衰期与剂量有关。酸浆苦味素B在体内的半衰期 t1/2z较长,表观分布容积Vz/F较高,驻留时间MRT长,说明酸浆苦味素B存在组织器官蓄积的潜在可能,结合本课题组前期研究发现[9],酸浆苦味素B在灌胃24 h后造模,仍对胃溃疡具有较好的保护作用,说明酸浆苦味素B各剂量给药后,作用于机体的时间较长,体内代谢较慢,能较好地发挥其抗胃溃疡作用。
大鼠静脉注射酸浆苦味素B(5 mg/kg)后,血药浓度于给药后5 min达到峰值[17],本试验通过口服低浓度酸浆苦味素B(4.968 mg/kg)后,达峰时间为0.667 h,明显慢于静脉注射,半衰期t1/2z(8.975 h±2.966 h) 也明显慢于静脉给药方式(321.2 min±29.5 min),结果说明,静脉注射酸浆苦味素B的吸收速率明显大于口服给药,这可能是因为静脉注射给药后,药物可直接通过血液循环分布到各组织器官,而口服灌胃给药时,药物会受到各种酶的降解[18]、或者食物吸收的影响。
由于机体个体差异、各组织器官生理特征的差异以及药物的理化性质,致使药物在体内的分布具有一定的差异性。而这种差异性与药物的疗效和毒副作用相关,因此对药物的组织分布进行研究,寻找药物的作用靶点具有重要意义。进行酸浆苦味素B组织分布研究时,在药代动力学参数测定的基础上,根据药时曲线确定了20、50、180 min 3个分别代表分布相、平衡相和消除相的时间点进行组织取样测定。试验结果表明,本试验几乎所有时间点的血药浓度均高于相应时间点的组织浓度,此结果有助于理解前期的研究发现[9],为何低血药浓度酸浆苦味素B仍能发挥显著的抗胃溃疡作用。此外,从组织分布数据可以看出,胃、十二指肠和小肠含量明显高于其他组织,其中胃组织中的含量在20 min和50 min时均高于其余组织,180 min时略低于十二指肠,说明胃和十二指肠可能是酸浆苦味素B口服后的主要吸收部位,表明酸浆苦味素B在胃肠吸收较慢且不完全,结合前期研究发现酸浆苦味素B具有较显著的抗胃溃疡作用,推测胃和十二指肠可能是酸浆苦味素B作用的靶器官和组织,多次服用后导致药物在胃和十二指肠中蓄积,增加药物浓度,可能是酸浆苦味素B发挥药效的一个重要原因。另外,大鼠体内血流量较丰富的组织器官如脑、心、肝和肾,酸浆苦味素B浓度较低,几乎与胃和十二指肠相差一个数量级,说明组织血流量对药物的分布影响不大,脑中的浓度最低,但仍有明显分布,说明药物可能会透过血脑屏障,这与文献[17]报道相吻合。这些都提示了酸浆苦味素B潜在的良好的药物开发前景,为药物的进一步开发提供了有价值的参考。
