高山兀鹫肠道有益菌的分离鉴定与生物学特性研究
2021-12-14海佳怡郑思思候建平朱丽琳
海佳怡,郑思思,候建平,龙 鑫,王 稳*,朱丽琳
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016;2.西宁市野生动物疫源疫病监测站,青海西宁 810001)
高山兀鹫(Gypshimalayensis)也称喜马拉雅兀鹫,隶属于鹰形目(Accipitriformes)、鹰科(Accipitridae),为国家Ⅱ级保护鸟类。世界自然保护联盟(International Union for Conservation of Nature,IUCN)在2014年将其列入濒危物种红色名录,保护等级为近危(Near threatened,NT)。高山兀鹫作为大型猛禽,体重可达8 kg~12 kg,在长期进化过程中,形成以腐肉为食的独特食性。该食性有助于降低腐肉中细菌和病毒在自然环境中的扩散,对维持生态系统平衡有重要意义[1]。高山兀鹫对腐食的适应性机制历来是研究的重点和热点。Blumstein D等[2]总结食腐动物适应腐食的8种可能机制中,特化的肠道微生物组(gut microbiome)被认为在腐食适应中发挥重要作用。Roggenbuck M等[3]通过分析红头美洲鹫(Cathartesaura)和黑头美洲鹫(Coragypsatratus)的肠道微生物组,发现这两种鹫类的肠道微生物多样性非常低,主要由隶属于梭菌属(Clostridium)和梭杆菌门(Fusobacteria)的微生物构成。而这两种类型的微生物对于其他动物而言,通常具有致病性。研究者推论,大量定植于这两种鹫类肠道的微生物,与其他病原菌形成种间竞争关系,进而抵御腐食中其他病原菌的生长。本研究将探究高山兀鹫肠道细菌与腐食适应性的关系。
肠道菌群作为近年来生命科学研究的热点之一,发现肠道菌群与宿主的神经系统、内分泌系统、免疫系统存在相互调控,进而与宿主的生理(发育、免疫稳态、营养物质代谢及维生素合成等)及众多疾病的发生存在关联,甚至影响着宿主的情绪及行为[4-5]。关于鸟类,一系列的研究表明,肠道微生物从羽毛护理到卵的孵化等多个层面影响着鸟类宿主的生理过程[6]。我们利用16S rDNA高通量测序技术发现,高山兀鹫的肠道菌群主要由梭杆菌属(Fusobacterium)、狭义梭菌属1(Clostridium-sensu-stricto-1)、鲸杆菌属(Cetobacterium)、Epulopiscium属和拟杆菌属(Bacteroides)构成,包含大量病原菌,也存在一定种类的有益菌(数据待发表)。本研究利用M17培养基和乳酸杆菌选择性培养基(Lactobacillusselection media)对高山兀鹫新鲜粪便中的有益菌进行分离与鉴定,并对获得的菌种进行耐药性检测、耐酸以及耐胆盐测试、病原菌抑菌测定。研究结果有助于进一步丰富我们对高山兀鹫可培养肠道微生物的认识,还可为高山兀鹫对腐食适应性机制的研究增添新内容。
1 材料与方法
1.1 材料
1.1.1 样本采集 在青海省果洛藏族自治州甘德县(北纬33.904 125°,东经99.811 977°,海拔4 170 m)境内,采集到野生高山兀鹫新鲜粪便数枚。将采集的新鲜粪便样本放入车载冰箱中运回实验室。
1.1.2 主要试剂和培养基 细菌基因组DNA提取试剂盒、2×TaqPCR Master Mix、DNA标准DL 2 000 Marker,宝日医生物技术(北京)有限公司产品;盐酸以及牛胆盐,青海优宁生物科技有限公司产品;M17和LBS(乳酸杆菌选择性培养基)琼脂以及M17和LBS肉汤,青岛高科技工业园海博生物技术有限公司产品;大肠埃希氏菌(EscherichiacoliATCC8099)、肠炎沙门氏菌(SalmonellaenteritidisCMCC 50041)以及金黄色葡萄球菌(StaphylococcusaureusATCC6538),购自北京医田生物技术有限公司;细菌生理生化鉴定管,杭州微生物试剂有限公司产品;药敏纸片,上海源叶生物科技有限公司产品。
1.1.3 主要仪器 SW-CJ-1FD无菌超净台,KG-SX-500高压灭菌锅,NRY-2102C恒温培养箱与摇床,ProFlex PCR仪,UV-3600Plus紫外可见分光光度计,牛津杯,PHS-3C型pH计,DYY-10C型核酸电泳仪,ChemiDoc MP凝胶成像系统。
1.2 方法
1.2.1 细菌分离与纯化 在无菌条件下,取高山兀鹫新鲜粪便样本,放入1 mL无菌生理盐水中,3 000 r/min离心5 min。取混匀后的悬液100 μL,在无菌水中按10-1~10-9梯度进行10倍梯度稀释。分别吸取其中10-1、10-3、10-5、10-7、10-9的稀释液涂布在M17和LBS琼脂培养基表面,在有氧条件下,培养箱37 ℃培养24 h~ 48 h。然后挑取颜色、大小、形状不同的单菌落于M17和LBS肉汤中,在有氧条件下37 ℃培养12 h。然后将M17和LBS肉汤中的菌液涂布到对应的M17和LBS琼脂培养基中,在有氧条件下进行第2轮的纯化培养。如此反复,经过5轮后,最终获取在M17和LBS琼脂中纯化的单一菌落。
1.2.2 16S rRNA基因的扩增与鉴定 按照细菌基因组DNA提取试剂盒的操作步骤,提取细菌总DNA,利用细菌的16S rRNA基因通用扩增引物对(上游引物7F:5′-CAGAGTTTGATCCTGGCT-3′;下游引物1540R:5′-AGGAGGTGATCCAGCCGCA-3′)进行PCR扩增,引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系为:2×TaqPCR Master Mix 25 μL,上、下游引物各1 μL,模板DNA 2 μL,ddH2O 21 μL,总体积50 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 1 min,57 ℃ 1 min,72 ℃ 2 min,共35个循环;72 ℃ 10 min;4 ℃结束反应。阳性对照,用实验室保存的大肠埃希氏菌菌株的DNA作为模板;阴性对照,用ddH2O作为模板。分别取10 μL上述PCR产物,用10 g/L琼脂糖凝胶电泳进行检测,若检测结果中出现约1 500 bp的条带则为阳性。将上述PCR扩增阳性的产物送往生工生物工程(上海)股份有限公司进行测序。
将测序结果利用NCBI的Blast程序进行序列同源性比对,找到同源性最高的序列,进而确定细菌的分类水平。然后,将属于同一种细菌的最长序列作为代表性序列提交至NCBI的GenBank数据库。运用MEGA X软件,以Maximum composite likelihood模型计算遗传距离,采用邻接法(Neighbor-Joining,NJ)对上述提交至NCBI的16S rRNA基因序列构建系统进化树,Bootstrap自展1 000次检验进化树拓扑结构置信区间,以痰液弯曲菌(Campylobactersputorumstrain ATCC 33709)为外类群。
1.2.3 生化鉴定 挑取纯培养的单菌落置于生理盐水管中,调节麦氏度为0.5,取0.5 mL菌液接种到细菌生理生化鉴定管中,放入培养箱37 ℃培养24 h~38 h,判定结果。判定依据为《常见细菌系统鉴定手册》。
1.2.4 药敏试验 采用药敏纸片琼脂扩散法(K-B法),将麦氏度为0.5的菌液均匀涂在琼脂培养基上,贴上34种药敏纸片,每一种类的药敏纸片贴3片作为重复,放入培养箱中37 ℃培养16 h后测量抑菌圈直径,并依据抗菌药物敏感性试验的技术要求(WS/T 639-2018)判定结果。
1.2.5 生长曲线测定 将所分离的代表性菌株按5%体积比接种到LBS肉汤中,37 ℃进行摇床培养。以无菌LBS肉汤为空白对照,每隔2 h,测定代表性菌株的OD 600 nm值,持续测定至28 h,每个菌株重复3次,取平均值。以培养时间为横坐标,OD 600 nm值为纵坐标,绘制不同菌株的生长曲线。
1.2.6 耐酸试验 按5%的体积比例接种所分离的代表性菌株到pH分别调为6.0、5.0、4.0、3.0、2.0、1.0的LBS肉汤中,37 ℃摇床培养,培养14 h后测定OD 600 nm值。以正常LBS肉汤培养各菌株14 h的OD 600 nm值为对照,分析菌株在不同pH下的存活率,来判断其耐酸性。
1.2.7 耐胆盐试验 在LBS肉汤中加入质量体积比(m/V)分别为1、2、3、4、5 mg/mL的牛胆盐溶液。将所分离的代表性菌株菌液按5%接种量接种至上述培养基中。37 ℃摇床培养,培养14 h后测定OD 600 nm值,以正常LBS肉汤培养各菌株14 h的OD 600 nm值为对照,根据其在不同牛胆盐浓度下的存活率,判断其耐胆盐能力。
1.2.8 抑菌试验 利用牛津杯法测定所分离的代表性菌株对大肠埃希氏菌、肠炎沙门氏菌以及金黄色葡萄球菌3种病原菌的抑菌圈大小。超净工作台中,在LB(Luria-Bertani)琼脂平板上加入50 μL病原菌菌液,并将菌液涂布均匀。在培养基表面等距离摆放牛津杯并轻轻按压,使其与培养基接触无空隙。在牛津杯中加入所分离的代表性菌株菌液各200 μL,培养24 h后,测定抑菌圈的大小。每种菌株做3次重复。
2 结果
2.1 细菌分离与纯化
分别利用M17和LBS培养基,在有氧条件下,对高山兀鹫新鲜粪便样本中的微生物进行分离与纯化。经过5轮纯化后,根据单菌落形状、颜色和大小等特征的差异,最终获得64个单菌落。其中,M17培养基挑选出33个单菌落,LBS培养基挑选处31个单菌落。
2.2 16S rRNA鉴定结果
对上述64个单菌落菌株提取基因组DNA,PCR扩增16S rRNA基因后,用10 g/L琼脂糖凝胶电泳对扩增产物进行检测。所有扩增产物均在1 500 bp左右检测到电泳条带,与预期大小相符。经生工生物工程(上海)股份有限公司一代测序后,将所有测序结果利用NCBI的Blast程序进行序列相似性比对,发现这些菌株隶属于4个属、6个种,分别是蜡样芽孢杆菌(Bacilluscereus)、地衣芽孢杆菌(Bacilluslicheniformis)、简单芽孢杆菌(Bacillussimplex)、屎肠球菌(Enterococcusfaecium)、表皮葡萄球菌(Staphylococcusepidermidis)和林地土壤芽孢杆菌(Solibacillussilvestris)。然后,将上述每个种的最长序列作为代表性序列提交到NCBI的GenBank数据库获得登录号。上述6种细菌的登录号分别为MW092227、MW092228、MW092226、MW092229、MW092514、MW092231。最后,用上述6个种的最长序列构建系统进化树(图1)。

种名后为此种细菌16S rRNA登录号;▲为本次分离的菌株;分枝上数字表示自展值为1 000时的置信度;标尺为碱基替换率
2.3 分离菌的生化鉴定
对上述分离到的6种细菌进行生化鉴定,结果见表1。表1中的6种细菌的生化鉴定结果与各自16S rRNA鉴定结果一致。

表1 分离菌株生化鉴定结果
2.4 分离菌的药敏试验
对上述6个种的代表性菌株进行34种抗菌药物的药敏试验(表2)。蜡样芽孢杆菌对13种抗菌药物表现出耐药性。地衣芽孢杆菌对11种抗菌药物表现出耐药性。简单芽孢杆菌对22种抗菌药物表现出耐药性。屎肠球菌对21种抗菌药物表现出耐药性。表皮葡萄球菌对9种抗菌药物表现出耐药性。林地土壤芽孢杆菌对20种抗菌药物表现出耐药性。由此可见,这6种菌株对9种~22种不等的抗菌药物表现出耐药性。其中,简单芽孢杆菌、屎肠球菌以及林地土壤芽孢杆菌可耐受高达20多种的抗菌药物。表皮葡萄球菌、地衣芽孢杆菌以及蜡样芽孢杆菌可耐受的抗菌药物种类较少。进一步从抗菌药物抑制细菌的角度进行分析,发现,有7种抗菌药物能够抑制本研究中分离到的5种~6种菌株,分别是哌拉西林、左氧氟沙星、强力霉素、四环素、氧氟沙星、诺氟沙星以及环丙氟哌酸。而氨曲南则对所有分离到的6种菌株均无抑制作用。
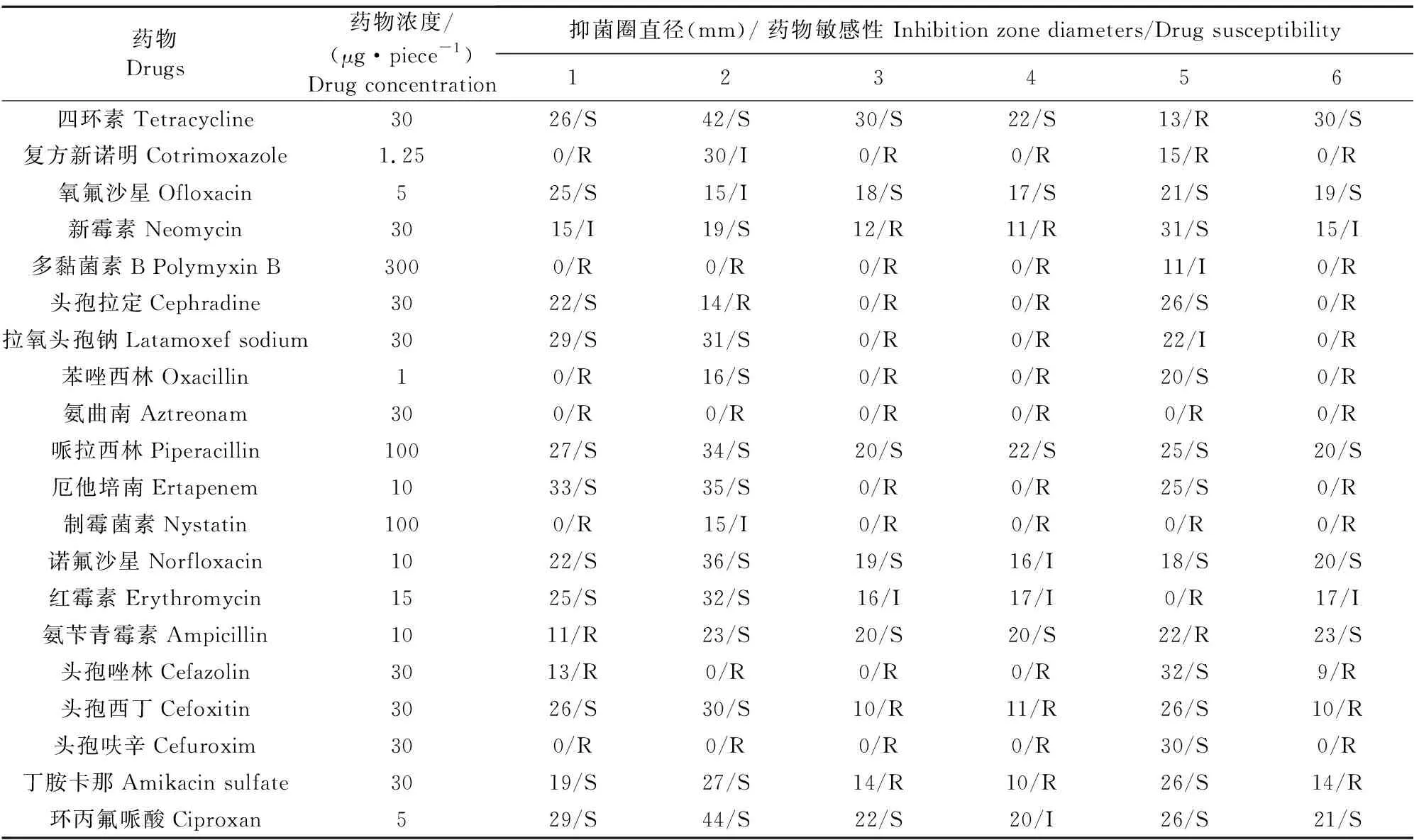
表2 分离菌株药敏试验结果
2.5 生长曲线、耐酸、耐胆盐的测定
对蜡样芽孢杆菌、地衣芽孢杆菌、简单芽孢杆菌、屎肠球菌4种菌株的生长曲线、耐酸、耐胆盐特征进行测定。由图2可知,4种菌株生长周期中潜伏期较短,仅2 h。2 h后开始进入对数生长期,生长速度较快。屎肠球菌、蜡样芽孢杆菌以及简单芽孢杆菌在2 h~4 h时间段生长快速;6 h~18 h时间段生长速率缓慢,进入稳定期。地衣芽孢杆菌在2 h~16 h时间段快速生长;16 h后生长速率缓慢,进入稳定期。
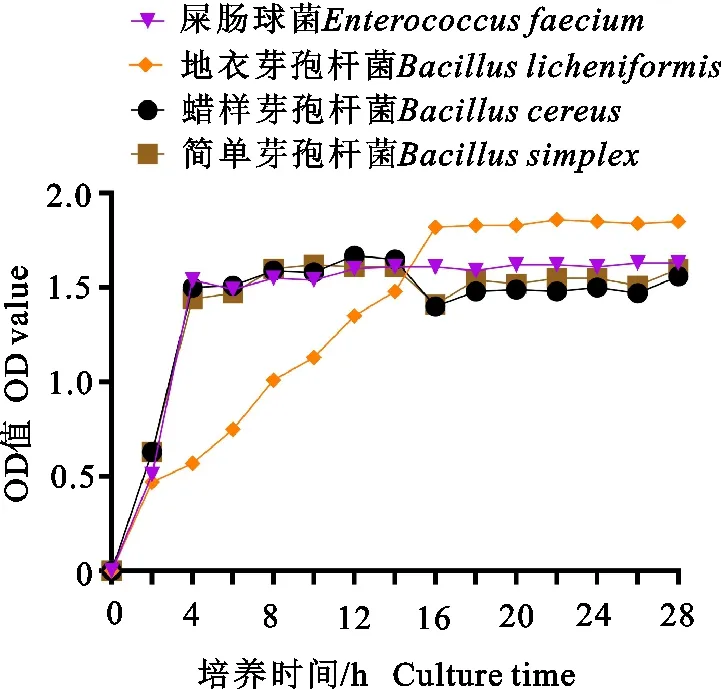
图2 4种菌株的生长曲线
进一步设置6个pH梯度和5个胆盐梯度模拟胃肠道环境,测试这4种菌株的存活率。如图3所示,4种菌株在pH为1~4时,存活率维持在20%左右,说明4种菌株在低pH环境中,生长受到抑制。但另一方面,在pH为1~2时,仍然能保持生长,说明4种菌株可以抵抗高山兀鹫胃酸环境,进而进入到肠道中实现定植。当pH为5~6时,存活率明显恢复,维持在60%以上。
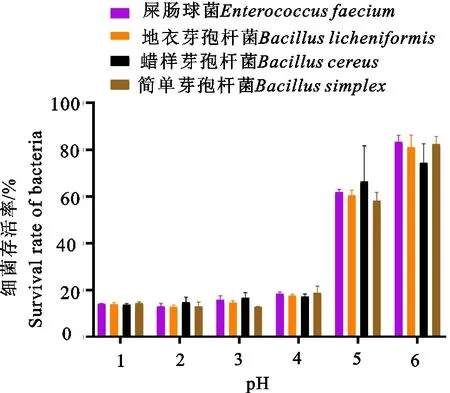
图3 4种菌株在不同pH下的存活率
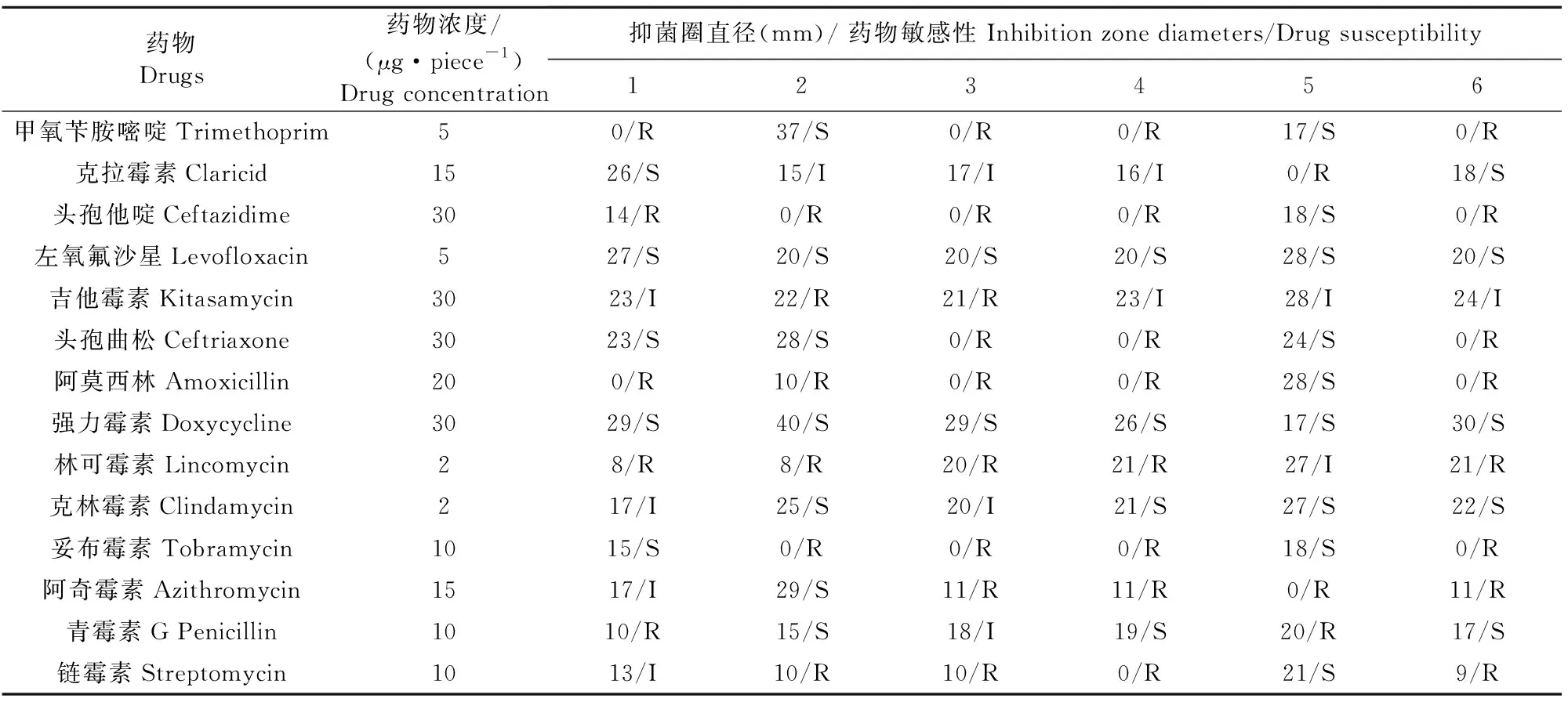
续表2
不同胆盐浓度下菌株的存活率如图4所示。胆盐浓度为5 mg/mL时,4种菌株存活率均在40%以上,说明具有良好的胆盐耐受能力。当胆盐浓度降低至1 mg/mL时,屎肠球菌、地衣芽孢杆菌以及蜡样芽孢杆菌存活率恢复至70%以上,而简单芽孢杆菌存活率也恢复至60%左右。结果表明,4种菌株可以抵抗肠道中的胆盐环境。
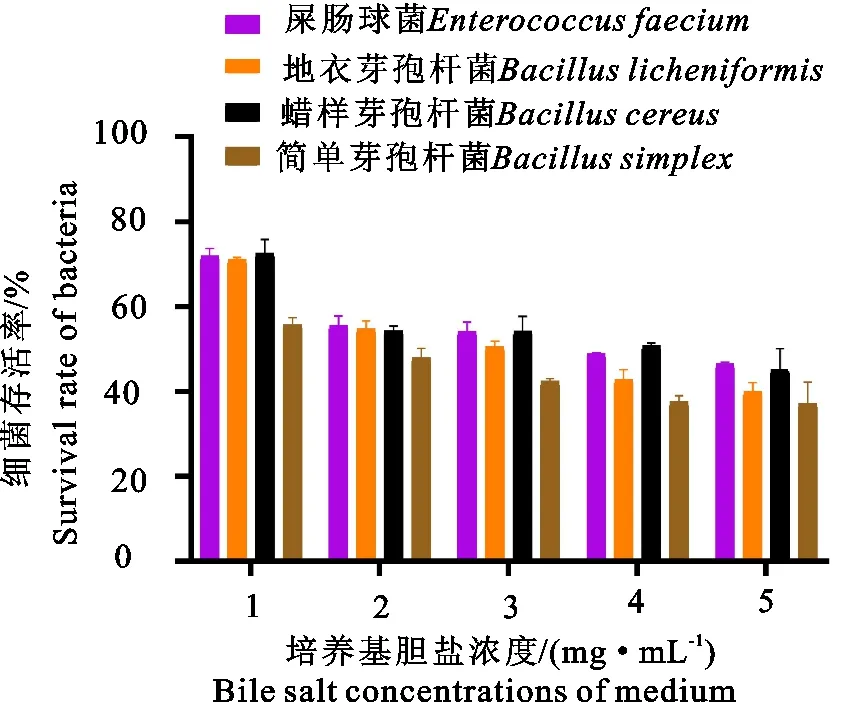
图4 4种菌株在不同胆盐浓度下的存活率
2.6 抑菌测定
4种分离菌株对大肠埃希氏菌、肠炎沙门氏菌以及金黄色葡萄球菌的抑菌结果详见表3。经测定,4种分离菌株对对上述3种常见肠道致病菌均表现出一定的抑制效果,其中,屎肠球菌对大肠埃希氏菌的抑菌效果最好,简单芽孢杆菌对金黄色葡萄球菌与肠炎沙门氏菌的抑菌效果最好,但简单芽孢杆菌对大肠埃希氏菌无抑菌性。
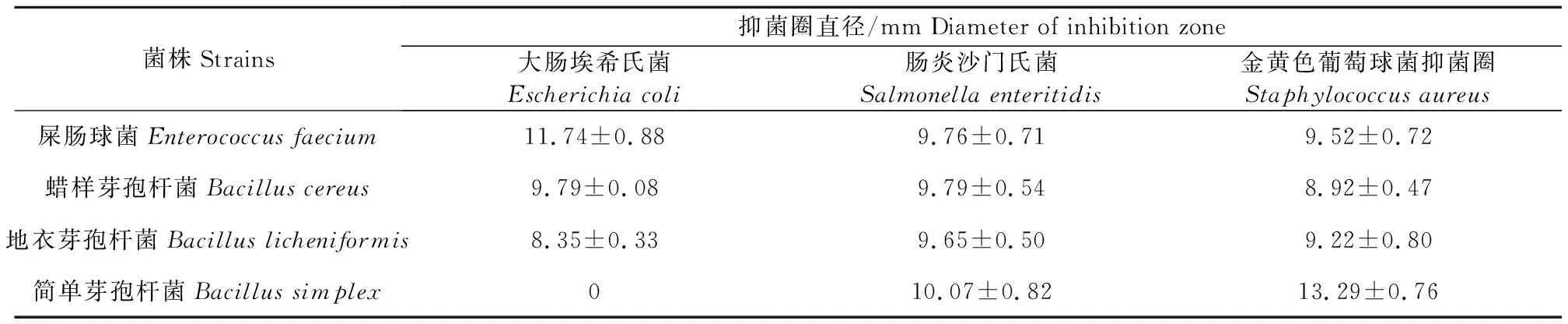
表3 4种分离菌株对大肠埃希氏菌、肠炎沙门氏菌以及金黄色葡萄球菌的抑制效应
3 讨论
关于食腐鹫类肠道微生物组的研究,有助于探究鹫类腐食适应性的肠道微生物组新机制。我们课题组通过对不同类型的腐肉以及高山兀鹫肠道微生物进行高通量测序,发现一定种类的有益菌存在于腐肉以及高山兀鹫肠道中,提示腐食以及高山兀鹫肠道并不是完全被病原菌占据。为了验证这些有益菌是否具有辅助高山兀鹫宿主抵抗病原菌的能力,本研究对高山兀鹫肠道有益菌进行分离、培养与鉴定、耐药性检测、耐酸以及耐胆盐测试、病原菌抑菌测定。分别利用M17培养基和乳酸杆菌选择性培养基,共分离到64株细菌。根据16S rRNA以及生化鉴定结果,鉴定出6种细菌,隶属于4个属。
药敏试验结果显示,这些菌株对9种~22种不等的抗菌药物表现出耐药性。这些存在于高山兀鹫肠道内的耐药菌株,很可能来自于腐尸,尤其是家养动物的腐尸。青藏高原地区高山兀鹫的食物主要包括家牦牛、藏羊、马、驴、狗等5种家养动物。推测兽药的使用可能导致家养动物本身的细菌产生耐药性,进一步通过腐食食物链传递给高山兀鹫等食腐动物。本研究选用的34种抗菌药物,发现其中7种抗菌药物能够抑制本研究中分离到的5种~6种菌株,增加了对高山兀鹫菌株耐药性的新认识。
目前研究认为,肠道有益菌与宿主在协同进化过程中,形成互惠互利的共生关系,在维持肠道健康、促进消化吸收营养物质、抵御病原菌侵袭、免疫机制调节等方面发挥重要作用[7]。经抑菌试验测定,本研究分离的4种潜在有益菌株(蜡样芽孢杆菌、地衣芽孢杆菌、屎肠球菌以及简单芽孢杆菌)对常见肠道致病菌大肠埃希氏菌、肠炎沙门氏菌和金黄色葡萄球菌具有一定的抑制作用。有研究表明蜡样芽孢杆菌在肠道定植后,消耗大量氧气进而维持肠道厌氧环境,支持生理性厌氧菌大量增殖,从而抑制致病菌或条件致病菌[8]。此外,蜡样芽孢杆菌在肠道中将淀粉转化为单糖,再由其他菌种将单糖转化为乳酸,降低肠道pH,从而起到抑制病原菌繁殖的作用[9]。地衣芽孢杆菌在生长代谢过程中产生蛋白多肽类物质和大量溶菌酶,可直接抑制和杀伤病原菌[10]。屎肠球菌作为肠道共生菌,具有多种优良生物学特性[11-12],比如,可在肠道中通过定植抗力作用抑制病原菌黏附肠道,形成肠道屏障;代谢过程中产生乳酸、细菌素和过氧化氢等物质,降低肠道pH,不利于病原菌生存;诱导机体产生细胞因子、干扰素、白介素等,增强机体非特异性免疫,提高抗病能力。简单芽孢杆菌在生物防治中发挥重要作用,对植物具有促生长和拮抗病原菌的作用[13]。据此推测,这些有益菌可能发挥辅助高山兀鹫宿主抵抗病原菌的作用,进而有助于高山兀鹫更好适应腐食。未来,值得深入开展关于这些有益菌的代谢产物,尤其是抑菌活性物质的分离鉴定工作。
可在酸性与较高浓度胆盐的消化道环境中生存是有益菌在体内存活与发挥生理功能的先决条件。耐酸、耐胆盐试验结果表明,上述4种潜在有益菌具有较好的耐酸、耐胆盐特性,pH 1时,仍然能保持生长;胆盐浓度5 mg/mL时,存活率均高于40%。这为进一步将有益菌株转入其他模式动物宿主进行更加深入的生理功能研究奠定了基础。
