番鸭细小病毒和鸭3型腺病毒的分离鉴定及其全基因组序列分析
2021-12-14陈长福刘荣昌程龙飞傅光华施少华陈红梅万春和傅秋玲
张 瑞,陈长福,刘荣昌,程龙飞,傅光华,施少华,陈红梅,万春和,傅秋玲,黄 瑜*
(1.福建省农业科学院畜牧兽医研究所,福建福州 350013;2.福建农林大学动物科学学院(蜂学学院),福建福州 350002;3.龙岩市动物疫病预防控制中心,福建龙岩 364000)
番鸭细小病毒病是由番鸭细小病毒(Muscovy duck parvovirus,MDPV)引起的一种传染性疫病,由我国学者林世棠等[1]首次报道。MDPV主要侵害3周龄以内的雏番鸭,患病鸭表现以呼吸困难、厌食、腹泻等为特征的临床症状[2]。但自2008年以来,在我国安徽、山东、河北、江苏、湖南等多地的鸭场流行一种新型番鸭细小病毒(new genotype Muscovy duck parvovirus,NMDPV),其宿主范围更广,涉及番鸭、半番鸭、中国台湾白改鸭等多个品种。该病感染鸭后主要可以造成鸭喙萎缩变短和生长不良,发病率介于10%~100%,致死率为2%~10%,残淘率可高达80%,给我国养鸭业造成严重经济损失[3-4]。
禽腺病毒(Fowl adenovirus,FAV)属于禽腺病毒科(Adenoviridae)禽腺病毒属(Aviadenovirus),是一类侵害禽类的病毒群。根据其抗原结构不同分为3个群,即Ⅰ群禽腺病毒(禽腺病毒属,Aviadenovirus)、Ⅱ群禽腺病毒(唾液腺病毒属,Siadenovirus)和Ⅲ群腺病毒(腺胸腺病毒属,Atadenovirus)[5]。鸭3型腺病毒(Duck adenovirus 3,DAdV-3)属于Ⅰ群腺病毒属成员,感染鸭后主要以肝脏的肿大、出血和坏死为特征,是近年来鸭群中的新发疫病[6]。
1 材料与方法
1.1 材料
1.1.1 病料来源 广东省湛江市某鸭场饲养的20日龄发病雏番鸭。
1.1.3 主要仪器 高速离心机,Gene公司产品;PCR仪、电泳仪和凝胶成像系统(Versa Doc 2000),Bio-Rad公司产品。
1.2 方法
1.2.1 细菌分离 无菌采集送诊鸭的脑及肝脏组织,将肝脏和脑组织无菌接种于不同培养基平板上,37 ℃恒温培养24 h~48 h,观察有无细菌生长。
1.2.2 RT-PCR检测 无菌采集病死鸭肝脏、脾脏、胰腺等组织,用于鸭常见病毒RT-PCR检测,参照文献[7-8],对处理后临床样品进行H9亚型禽流感病毒、新城疫病毒、鸭肝炎病毒、禽坦布苏病毒、水禽细小病毒、鸭3型腺病毒、禽4型腺病毒等鸭常见病毒进行RT-PCR检测。
1.2.3 病毒分离鉴定 将采集的组织剪碎、匀浆,加入PBS制成1∶5组织悬液,反复冻融3次,6 000 r/min离心10 min,加双抗作用30 min后,用0.22 μm滤器过滤,过滤后的匀浆液分2份,1份以0.2 mL/枚尿囊腔接种10日龄番鸭胚分离MDPV,连续观察7 d,无菌收集死亡鸭胚尿囊液,盲传4代,收集尿囊液,标记为GD-1。另1份加入NMDPV高免血清后接种番鸭胚成纤维细胞,每日观察1次,于72 h后收获细胞,连续盲传6代,标记为GD-2;对收获病毒液按照1.2.2方法,进行鸭常见病原检测。
1.2.4 动物回归试验 3日龄番鸭42只,随机分成3组,每组14只。第1组为GD-1感染组,每只腿部肌肉注射0.5 mL GD-1病毒液;第2组为GD-2感染组,每只腿部肌肉注射0.5 mL GD-2病毒液;对照组腿部肌肉注射0.5 mL无菌生理盐水。相同饲养管理条件隔离饲养14 d,每日观察,对病死鸭进行剖检,采集病死鸭病变组织,按1.2.2方法进行鸭常见病原检测。
1.2.5 病毒全基因组扩增 按照Easy Pure Viral DNA/RNA提取试剂盒说明,提取样品中病毒核酸。参照文献说明,利用两组特异性引物分别扩增MDPV和DAdV-3的全基因组[9-10]。获得的DNA样品用Easy Script One-Step PCR Super Mix试剂盒按说明书进行PCR扩增,2株病毒的PCR反应均按50 μL体系进行扩增:2×EasyTaqPCR Super Mix 25μL,ddH2O 17.5 μL,上、下游引物各1.25 μL,DNA模板5 μL。MDPV PCR反应程序为:94 ℃预变性5 min;94 ℃ 30 s,57 ℃ 60 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。DAdV PCR反应程序为:94 ℃预变性5 min;94 ℃ 30 s,59 ℃ 90 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。扩增产物送福州铂尚生物技术(上海)有限公司进行测序,利用SeqMan软件组装DAdV-3和MDPV分离株的基因组,获得了2株病毒的全基因组序列,将DAdV-3分离株命名为GDZJ201901,MDPV分离株命名为GDZJ1901,将获得的全基因组序列上传至NCBI数据库,获得的GenBank数据库登录号分别为MN923205(GDZJ201901)和MN824419(GDZJ1901)。
1.2.6 遗传进化树构建和MDPV分离株重组分析 利用MegAlign软件分别对GDZJ1901株和GDZJ201901株进行同源性比对分析。采用MEGA5.05程序构建遗传进化树。重组分析软件SimPlot version 3.5.1和RDP4 v.4.43用于检测GDZJ1901株可能发生的重组事件。本研究所选取的参考毒株信息见表1和表2。
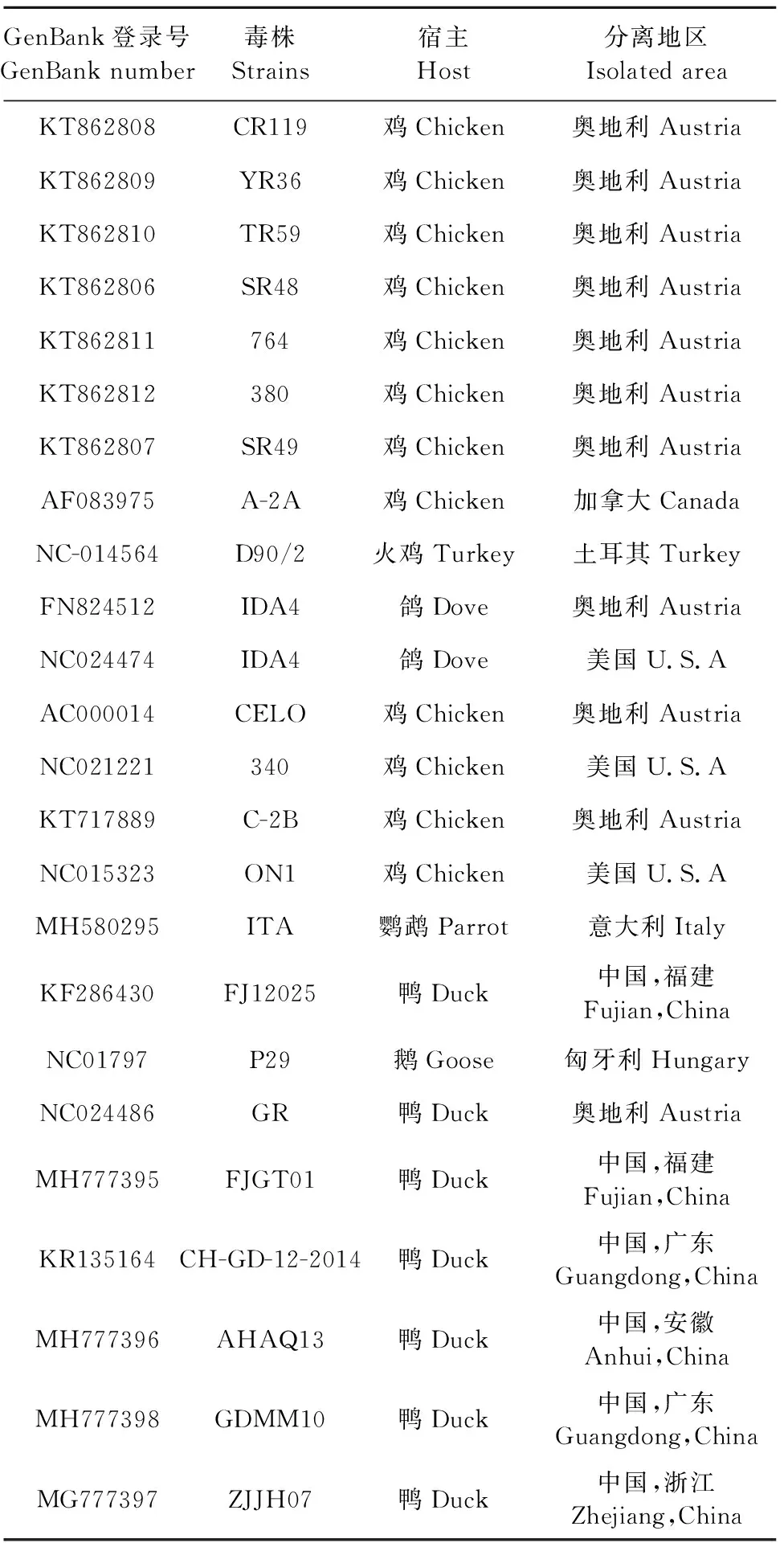
表1 本研究选取的腺病毒参考株
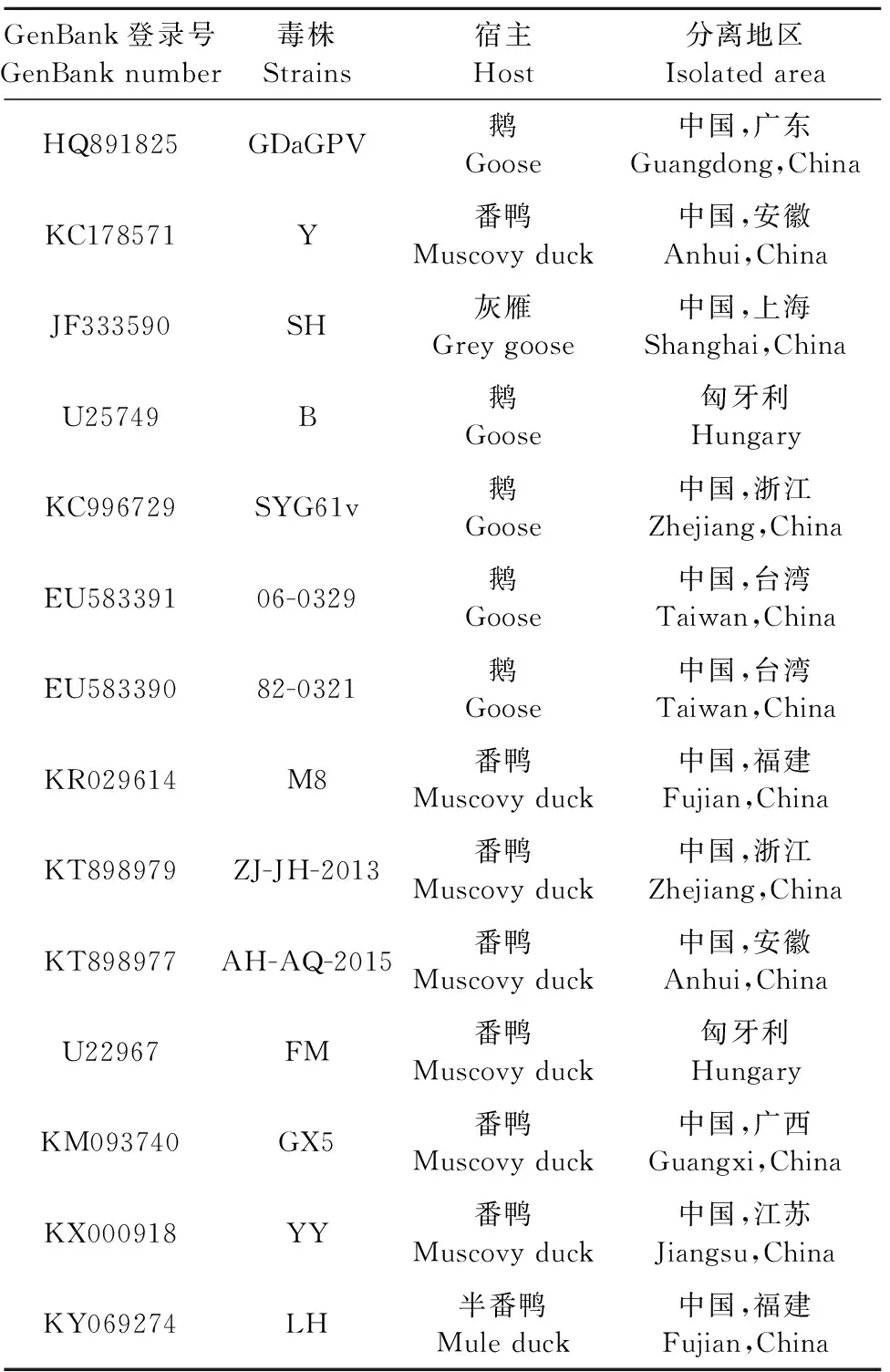
表2 本研究选取的细小病毒参考株
2 结果
2.1 发病情况、临床症状和剖检病变
2019年9月,广东省湛江市某鸭场饲养的雏番鸭群于15日龄左右开始发病,发病鸭起初表现为精神沉郁,采食量下降,张口呼吸;感染后期可见腹泻,拉黄白色稀便,部分鸭呈急性死亡。发病率约为50%,至20日龄,病死率高达40%,期间使用多种抗生素治疗无效。对病鸭进行剖检主要可见:肝脏出血,部分鸭肝脏表面可见大量弥漫性白色坏死点,呈现肝黄化或者白化;脾脏肿大出血;肺淤血;肾脏肿大、出血;胰腺出血、表面可见白色针尖状坏死点;胆囊肿大、胆汁充盈。
2.2 细菌分离结果
所接种平板均未见菌落生长,因此可排除细菌感染。
2.3 RT-PCR检测结果
对临床样品进行H9亚型禽流感病毒、新城疫病毒、鸭肝炎病毒、禽坦布苏病毒、水禽细小病毒、鸭3型腺病毒、禽4型腺病毒等鸭常见病原检测,结果仅水禽细小病毒(图1)和DAdV-3为阳性(图2),其余病原检测均为阴性。初步判断该病例为DAdV-3与MDPV共感染。
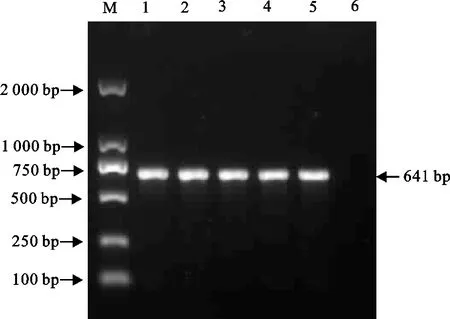
M.DNA 标准DL 2 000;1.番鸭细小病毒阳性对照;2~5.临床样品;6.阴性对照
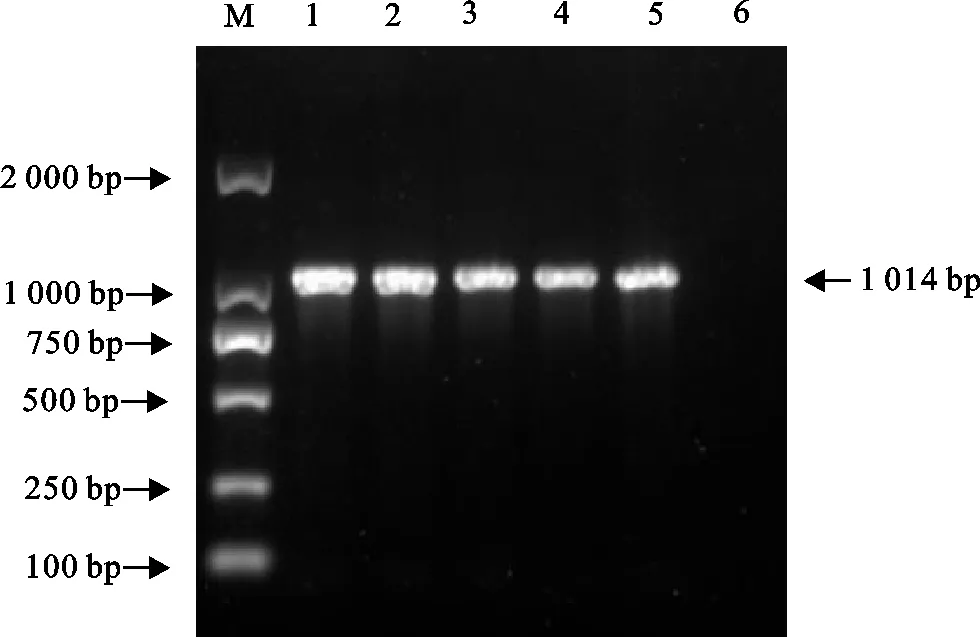
M.DNA 标准DL 2 000;1.鸭3型腺病毒阳性对照;2~5.临床样品;6.阴性对照
2.4 病毒分离结果
收集接种后死亡鸭胚尿囊液,对收集尿囊液和胚体进行RT-PCR检测,结果均为MDPV阳性;接种的细胞于第3天出现病变,RT-PCR检测显示其仅为DAdV-3阳性。
2.5 动物回归试验结果
对上述分离病毒肌肉注射3日龄番鸭,结果显示,GD-1感染组于攻毒后第3天开始出现症状,共死亡4只,死亡率为28.6%;GD-2感染组于攻毒后第4天开始出现症状,共死亡3只,死亡率为21.4%;对照组无异常现象。分别采集2个组病死鸭肝脏等组织进行PCR检测,结果GD-1感染组为MDPV阳性,GD-2感染组为DAdV-3阳性。
2.6 全基因组序列分析
2.6.1 DAdV分离株全基因组序列分析 DAdV分离株全基因组长度为43 860 bp,含27个开放阅读框(ORF),与其他腺病毒相似。同源性分析表明,GDZJ201901株与4株DAdV-3分离株(AHAQ13、GDMM10、CH-GD-12-2014、ZJJH07)有近100%(99.89%~99.91%)的核苷酸同源性,与上述4株DAdV-3分离株在Hexon、fiber1和fiber2基因分别有着99.3%~100%、98.9%~99.04%和99.93%的核苷酸同源性,然而与DAdV-2代表株GR株的Hexon基因的核苷酸同源性仅为77.12%。GDZJ201901株的hexon、fiber基因与GR株的序列同源性分析表明,新分离株与GR株的最大差异是新分离的DAdV含有fiber1和fiber2基因,而GR株只有1个fiber基因,这是区分DAdV-3和DAdV-2的重要依据。对分离到的DAdV绘制了全基因进化树(图3),分析表明其与4株DAdV-3属同一进化分支。这些数据进一步表明了新分离的腺病毒是DAdV-3。

图3 DAdV分离株全基因组遗传进化分析
2.6.2 MDPV分离株全基因组序列分析 MDPV分离株命名为GDZJ1901,全基因组长度为5 067 bp,G+C含量为45.69%。GDZJ1901株末端重复倒置序列长度为382 bp,序列对比发现ITR区有个别碱基对的缺失,但均处在互补位置,不影响其他碱基互补配对形成发卡结构。GDZJ1901包含2个大的开放阅读框(ORF),左侧的ORF编码NS1、NS2蛋白,包含627个氨基酸;右侧的ORF编码VP1、VP2、VP3蛋白,包含732个氨基酸,对表面蛋白潜在糖基化位点分析后发现,在NS1中有4个潜在的N-糖基化位点,分别位于150-153 aa、225-228 aa、360-363 aa、433-463 aa,在VP1中也有4个潜在的N-糖基化位点,分别位于219-222 aa、331-334 aa、582-585 aa、703-705 aa。将本分离株和GenBank登录的MDPV和GPV代表株进行核苷酸同源性比较,结果表明,GDZJ1901与数据库中的MDPV分离株的同源性高达98.1%~99.51%,其中与福建的MDPV分离株M8株的核苷酸同源性最高,为99.51%,与鹅源GPV分离株的核苷酸同源性在84.3%~85.6%之间。将本分离株与MDPV和GPV代表株利用MEGA5.0绘制遗传进化树(图4)。结果显示,GDZJ1901株与5株MDPV分离株处于同一进化分支,其余番鸭源和鹅源细小病毒处于另一分支。综合以上数据,可判断新分离株GDZJ1901为MDPV。
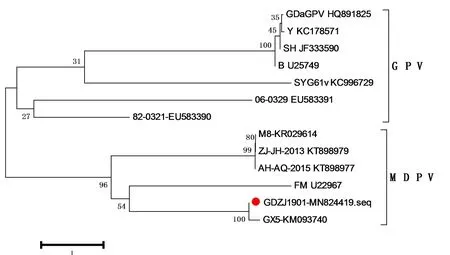
图4 MDPV分离株全基因组遗传进化分析
2.6.3 MDPV分离株重组分析 经Simplot 3.5.1和RDP4软件对GDZJ1901株基因组进行重组分析,结果显示在其基因组的2个位置检测到明显的重组信号(图5)。GDZJ1901株以经典MDPV YY株为骨架,第1个重组信号产生在P9启动子区(421-613),由MDPV YY株与GPV鹅胚化活疫苗株SYG61v之间发生重组;第2个重组信号产生在VP3区域(3 119-4 249),由MDPV YY株与经典GPV毒株(包括SYG61v、匈牙利GPV强毒株B、国内GPV强毒株LH)之间发生重组,以上结果表明GDZJ1901株是重组型MDPV。结构蛋白基因的重组可以使重组毒株的抗原性发生改变,可能导致以经典MDPV所制的弱毒苗难以产生有效的保护力。
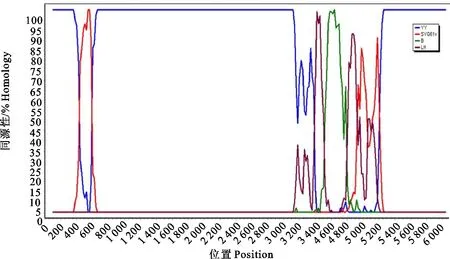
图5 MDPV分离株重组分析
3 讨论
近年来,有关水禽细小病毒基因组间的自然重组和致病性改变的现象被陆续报道。最早有学者在美国的番鸭群中发现1株新型MDPV,经遗传进化分析发现,其虽属于MDPV亚群,但又与传统的MDPV毒株处于不同分支[11]。在国内,黄瑜等[12]发现并报道了在基因组和致病性上与经典MDPV均有较大差异,可致患鸭发生“短喙侏儒”的MDPV毒株。Zhu Y等[13]从我国上海某发病雏番鸭群中首次分离鉴定了重组型MDPV,之后福建等地陆续报道了MDPV与GPV发生重组现象[14-15]。本研究对分离到的细小病毒株在全基因水平上进行了遗传进化分析,发现其属于MDPV,且与新型番鸭细小病毒M8株有较高的同源性,重组分析发现,GDZJ1901株P9启动子和编码结构蛋白的VP3区域结合了GPV毒株的相应序列,结合动物试验结果,最终确定其本质上是一种基因重组型的新型番鸭细小病毒。
家禽中DAdV的感染最早要追溯到1976年的荷兰,其主要是引起蛋鸡的产蛋下降综合征(ESDV)。1977年,DAdV-2的代表株GR株由Bouquet J F等[16]于法国的患病番鸭群中分离到,但受限于当时的科研条件,其全基因组直到2014年才通过高通量测序获取。2014年,周镇海[17]从广东地区20日龄~30日龄番鸭表现为精神沉郁,剖检肝脏黄化和出血的番鸭组织中分离鉴定1株病毒,经血凝试验、理化试验、透射电镜观察及基因组序列测定及分析,确定该病病原为DAdV-3,命名为CH-GD-12-2014株。该研究同时发现,CH-GD-12-2014株与GR株同源性高达92.3%,但与GR株不同的是CH-GD-12-2014含有2个fiber基因,而GR株只有1个,这是DAdV-2和DAdV-3基因组结构上最大的不同。本次分离到的DAdV与CH-GD-12-2014株相似,与GR株有较高的同源性(93.33%),且含有2个fiber基因,结合遗传进化关系分析及动物回归试验结果,确定分离株为DAdV-3。
本研究中动物试验的病死率均低于此次的临床病例,临床上的高病死率是否与两种疫病的共感染有关还需进一步研究。随着养禽业不断发展,个体散养逐步转变为大规模、集约化饲养,饲养密度也不断上升,经济效益增长的同时也加大了疫病流行的风险,且多种疾病共感染的现象时有发生,给临床诊断和防治带来诸多困难。新型MDPV和DAdV-3感染均为近年来我国鸭群中的新发疫病,本文首次对两者共感染病例的研究进行系统报道,提示临床上存在重组型的新型MDPV和DAdV-3共感染现象,相关从业者需重视对该病的诊断、防控和研究。
