花生果腐病拮抗菌贝莱斯芽胞杆菌Hsg1949鉴定与防效
2021-10-22曹伟平鹿秀云臧卫平
曹伟平,陆 晴,鹿秀云,臧卫平,宋 健*
(1.河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业部华北北部作物有害生物综合治理重点实验室,保定 071000;2.唐山市农业科学研究院,唐山 063001;3.保定市龙潭公园管理处,保定 071000)
果腐病是花生生产上最为严重的病害之一,主要症状表现为花生荚果腐烂,感病较轻的荚果为褐色或黑色,果仁小而硬实,严重的整个荚果果皮和果仁均腐烂,染病地块轻者减产20%,严重的减产可达50%以上,对花生产量和品质构成了极为严重的威胁[1]。在生产上,抗病品种选育[2]、农艺措施[3]和化学农药防治[4]是目前生产上防控花生果腐病最常用的措施,但目前花生抗性品种有限,同时由于果腐病病原体的宿主范围较广[5,6],土壤传播特性也加重了药剂防治的难度;长期使用化学杀菌剂也使得花生果腐病容易产生抗性,同时对土壤微生态环境容易产生不良影响[7]。利用拮抗微生物防治农作物病害是一种有效且绿色环保的防治途径,近年来已得到广泛的重视和应用,寻找一种安全、环境友好并具有良好防治效果的新型生防菌对花生产业的可持续发展具有重要意义。
利用芽胞杆菌防治植物病害是目前农业生产上最常用的生物防治技术之一[8]。芽胞杆菌 Bacillus种类和数量众多,抗逆性强,繁殖速度快,大多芽胞杆菌可在植物体内外定殖,而且芽胞杆菌发酵工艺成熟,便于生产应用。芽胞杆菌能产生多种不同结构的抗菌物质,如脂肽、聚酮化合物、细菌素和铁载体等[9],具有广谱的抑菌活性,同时对生态环境无污染,可以与环境中的其他微生物互作,诱导植株产生抗病性。赵昱榕等[10]在黄瓜植株中分离到一株对黄瓜棒孢叶斑病具有明显拮抗作用的贝莱斯芽胞杆菌 Bacillus velezensis ZF2,防效达90.81%,同时对多种植物病原菌具有显著拮抗作用。沙月霞等[11,12]应用短小芽胞杆菌B.pumilus S09、解淀粉芽胞杆菌B amyloliquefaciens S170、贝莱斯芽孢杆菌E69和枯草芽胞杆菌B.subtilis E66防治稻瘟病,田间防治效果与化学农药防效相当。枯草芽胞杆菌B1409对番茄早疫病和辣椒疫霉病的预防效果良好,同时可促进番茄和辣椒植株生长,增强植物体内超氧化物歧化酶、过氧化物酶和过氧化氢酶的活性[13]。但是将生物防治应用于花生果腐病的研究尚处于探索阶段,孙伟明等[14]报道从花生根际土壤中分离获得了2株解淀粉芽胞杆菌,可有效降低侵脉新赤壳菌Neocosmospora sp.引起的花生果腐病的发病指数。
生防菌与病原菌之间有相同的生态位,具有共存、相随关系,在有病原菌存在的土壤中,筛选出较强生防作用的菌株可能性较大[15,16]。基于此,我们在河北省多个花生主产区采集了荚果感染果腐病的花生根际土壤,通过平板对峙法从分离的细菌中筛选出一株芽胞杆菌Hsg1949,其菌悬液和无菌滤液对花生果腐病主要病原菌镰孢菌Fusarium spp.的生长均有拮抗活性,结合形态学观察、Biolog微生物自动鉴定系统及16S rDNA和gyrA序列分析对其进行分类鉴定,测试了该菌株对其他4种植物病原菌的拮抗作用,田间小区试验评价了菌株Hsg1949对花生果腐病的防治效果,以期为花生果腐病的有效防治提供新的绿色植保资源。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 果腐病供试菌种:镰孢菌菌株LX、DM、XT分离自感病花生荚果,采用直接挑取分离法[17],并通过柯赫氏法则进行致病性回接试验和菌种鉴定。其他供试病原菌:花生白绢病菌 Sclerotium rolfsii、棉花立枯病菌Rhizoctonia solani、棉花枯萎病菌Fusarium oxysporum和棉花黄萎病菌Verticillium dahliae均由河北省农林科学院植物保护研究所分离提供。
1.1.2 供试培养基 马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g/L,葡萄糖20 g/L,琼脂粉15 g/L,pH自然。LB液体培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0。LB固体培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,琼脂粉15 g/L。
1.2 拮抗菌株的分离筛选
1.2.1 细菌分离 土样采集自河北邯郸、石家庄、保定、秦皇岛、唐山等县市花生主产区的花生根际土,上述采集地点花生果腐病平均发病率15%~30%。称取1 g土样放到装有99 mL无菌水的灭菌三角瓶中,170 r/min振荡培养30 min,静置30 min,取上清液10 mL加入50 mL灭菌离心管中,然后在80 ℃恒温水浴30 min,取1 mL加无菌水9 mL,制成10 mL 10-3倍土壤微生物悬液,取两种浓度的微生物悬液100 μL分别涂布于LB培养基平板上,每个浓度重复3次,在30 ℃恒温培养3~5 d,待平板长出菌落后,根据《常见细菌系统鉴定手册》[18]中芽胞杆菌的形态特征进行菌落筛选,镜检后采用划线分离纯化,直至得到单菌落的纯培养物。
1.2.2 拮抗菌初筛 采用平板对峙法[19]对1.2.1中单菌落分离株进行拮抗活性筛选。在PDA培养基平板(Φ=9 cm)中心接入直径为5 mm活化的果腐病菌饼,然后在距中心30 mm处4个方向分别接种不同分离株,以不接种分离株的平板为对照,每个处理 3次重复。28 ℃下恒温培养,待空白对照即将长满整个培养皿时,观察抑菌效果,测量抑菌带(Hsg1949菌落边缘和和镰孢菌边缘之间的透明带距离)大小。
1.2.3 拮抗菌的复筛 选取抑菌圈宽度大于6 mm的分离株,利用平板对峙培养方法对其进行复筛,每处理重复 3次,以接无菌水为对照,28 ℃下恒温培养。采用十字交叉法测量对照组直径和处理组直径,采用菌丝生长速率法[20]计算抑菌率。 抑菌率(%)=[(对照菌落生长量-处理菌落生长量)/对照菌落生长量]×100%,生长量(mm)=菌落平均直径-菌饼直径。
1.3 菌株Hsg1949鉴定
1.3.1 形态特征及生物化学特性分析 参照《常见细菌系统鉴定手册》对上述分离筛选的高效生防菌株Hsg1949进行形态特征鉴定。应用Biolog微生物自动分析系统(美国Biolog公司)对菌株Hsg1949进行71种碳源利用测试和23种化学敏感性测试[10,21],挑取菌株Hsg1949单菌落接种在Biolog推荐的BUG培养基上,33 ℃活化培养24 h,然后在B接种液中制成菌悬液,用Biolog 浊度仪将菌悬液浓度调至95%~98% T(T为所测得的透光率),将调好的菌悬液倒入V型加样水槽中,用8通道电动移液器按每孔100 μL的量将菌悬液加入96微孔板的所有孔中,将微孔板放入OmniLog的孵育读数仪中,33 ℃培养24 h后读板,根据Biolog微生物鉴定系统给出的相似值判断菌株Hsg1949的分类地位。
1.3.2 分子生物学鉴定 依据细菌DNA提取试剂盒(AXYGEN)步骤提取菌株Hsg1949的DNA,以细菌 16S rDNA 基因的特异引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′- TACGGCTACCTTG TTACGACTT-3′)以及细菌持家基因 gyrA 的引物 GyrA-F(5′-CAGTCAGGAAATGCGTACGTCCTT-3′)和GyrA-R(5′-CAAGGTAATGCTCCAGGCATTGCT-3′)进行PCR扩增。PCR扩增反应体系50 μL,反应体系为:基因组 DNA 2 μL,10×PCR buffer 5.0 μL,27F 引物 2 μL,1492R 引物 2 μL,dNTPs 4 μL,Taq酶(5 U/μL)0.5 μL,ddH2O 34.5 μL。反应条件:94 ℃预变性 3 min;94 ℃变性 30 s,54 ℃退火 30 s,72 ℃延伸1.5 min,循环30次;72 ℃10 min。PCR产物用1%琼脂糖凝胶进行电泳检测,送上海派森诺基因科技有限公司测序,利用NCBI网站的BLAST功能对所测的16S rDNA和gyrA序列进行同源性比对,确定亲缘关系,利用MEGA6.0软件构建系统发育树。
1.4 拮抗菌株继代培养稳定性
将拮抗作用最强的菌株Hsg1949在LB培养基上采用划线法进行传代培养,培养40代后,采用平板对峙法测定菌株Hsg1949对花生果腐病镰孢菌的拮抗效果,测量菌落直径大小,采用菌丝生长速率法计算抑菌率,方法同1.2.3。
1.5 抑菌活性物质的稳定性
将菌株Hsg1949 接种于LB培养液中,30 ℃摇床(180 r/min)培养40 h,得到发酵液,将发酵液10000 r/min离心10 min,收集上清并用0.22 μm微孔滤膜过滤,获得无菌发酵上清液,取无菌发酵上清液分别在40 ℃、60 ℃、80 ℃、100 ℃和120 ℃处理30 min,冷却至室温后,将无菌上清液和PDA培养基按1:4(v/v)混匀倒平板,于平板中央接直径为5 mm的果腐病菌饼,以未经高温处理的无菌发酵上清液为对照,每处理3个重复,27 ℃培养7 d,采用菌丝生长速率法计算抑菌率,方法同1.2.3。
在无菌发酵液原始pH值的基础上,分别用1 mol/L的HCl和1 mol/L NaOH将无菌发酵液pH分别调至 3、5、7、9和11,静置3 h,然后再调到pH 7,将处理后的上清液用0.22 μm微孔滤膜过滤,按1:4(v/v)与PDA培养基混匀倒平板,以未处理的无菌发酵上清液为对照,每处理3个重复,27 ℃培养7 d,采用菌丝生长速率法计算抑菌率,方法同1.2.3。
1.6 菌株Hsg1949抑菌谱测定
采用平板对峙法,以花生白绢病菌、棉花立枯病菌、棉花枯萎病菌和棉花黄萎病菌4株病原菌为指示菌,测定菌株Hsg1949的抑菌活性。用打孔器取直径5 mm活化的供试病原菌菌块置于PDA平板中央,在距中心30 mm处4个方向分别接种菌株Hsg1949,以不接种菌株Hsg1949的平板为对照,每处理重复3次,采用菌丝生长速率法计算抑制率,方法同1.2.3。
1.7 菌株Hsg1949 对花生果腐病的田间防效试验
对花生果腐病的田间小区试验在河北省滦州市百信花生种植专业合作社进行,该合作社常年种植花生,往年花生果腐病发病率为10%~40%,土质为沙壤土。2020年5月4日进行播种,花生品种为冀花11(由滦州市百信花生种植专业合作社提供),田间采用常规农事管理,于花生下针期(7月2日)和荚果初期(7月23日)在茎基部喷淋施药[22,23]。菌株Hsg1949浓度设定为1×108、2×108、5×108cfu/mL[10,24];设定化学农药50%多菌灵(河北冠龙农业有限公司)(施用量为100 g/亩)和清水对照,各处理药液用水量均为60 kg/亩,每个处理3次重复,每个重复20 m2。将相应剂量的菌(药)剂按照设定浓度分别放入15 L背负式手动喷雾器中,加水配成菌(药)液,去掉喷头,对准花生茎基部逐一喷淋,每穴喷10~15 mL。喷淋结束后,立即用大水浇灌试验小区。于花生收获时调查花生果腐病的发病情况。每处理采用5点取样法,每点调查1 m2,记录总荚果数和被害荚果数。荚果发病率(%)=被害荚果数/总荚果数×100,防治效果(%)=(对照区荚果发病率-处理区荚果发病率)/对照区荚果发病率×100。
1.8 数据统计与分析
采用Excel计算平均值±标准差,采用SPSS18.0软件中的Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 拮抗菌株的分离筛选
从1523份土样中共分离获得芽胞杆菌232株,初筛结果表明有17株对花生果腐病菌镰孢菌具有拮抗作用。复筛结果显示其中4个芽胞杆菌分离株对3株镰孢菌具有稳定的抑菌活性,以Hsg1949的抑菌活性最强,抑菌率可达77.4%(表1),选择Hsg1949开展后续研究。
初始菌株Hsg1949对3株镰孢菌XT、LX和DM的抑制率分别为77.4%、69.3%和62.4%;抑菌带宽1.2~8.2 mm;继代培养40代抑菌结果显示,菌株Hsg1949表现出良好的稳定性,不易发生变异(表1)。
2.2 菌株Hsg1949的鉴定
2.2.1 菌株Hsg1949形态学和Biolog生物化学鉴定 28 ℃恒温培养24 h,菌株Hsg1949在LB固体培养基上的菌落为圆形或近圆形,边缘啮蚀状,菌落隆起呈馒头状,表面湿润;培养后期,表面干燥有皱褶,颜色为乳白色,无光泽不透明,有黏性,与培养基结合不紧密(图1A),革兰氏染色为阳性,短杆状,能够产生芽胞,芽胞为椭圆形(图1B)。采用GenIII型96孔板及Biolog自动微生物鉴定系统对Hsg1949的94种(71种碳源利用和23种化学敏感性)表型进行测试(表2)结果表明,菌株Hsg1949可以利用α-D-葡萄糖、D-甘露糖、D-果糖、1%乳酸钠、D-山梨醇、D-甘露醇、L-谷氨酸、L-天冬氨酸、L-丙氨酸;不能利用丙三醇、D-丝氨酸、D-天冬氨酸、万古霉素、D-松二糖、水苏糖、α-D-乳糖、N-Acetyl-β-D甘露糖胺、D-半乳糖、D-海藻糖、肌苷、D-阿拉伯醇,与已报道的贝莱斯芽胞杆菌特征一致[10,25]。
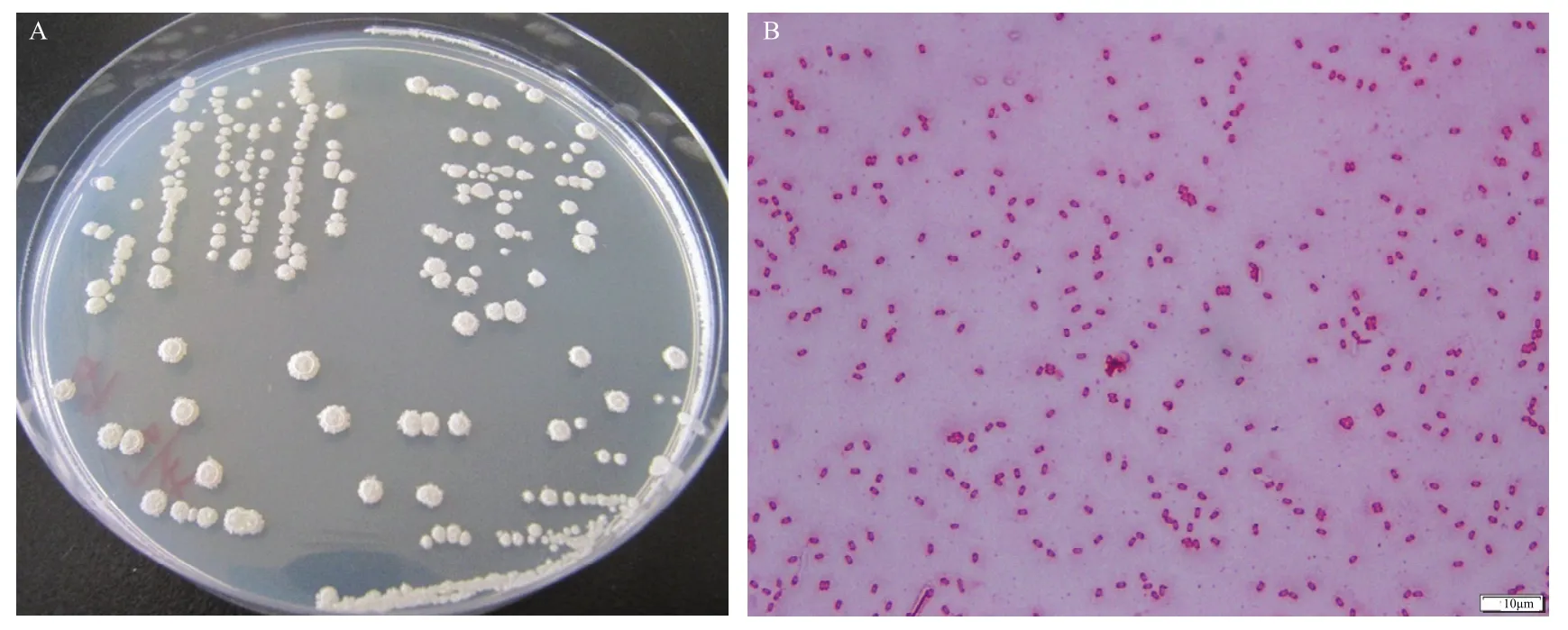
图1 菌株Hsg1949形态学特征Fig.1 Morphological characteristics of strain Hsg1949

表2 菌株Hsg1949生理生化特征测定Table 2 Characters of physiology and biochemistry of strain Hsg1949
2.2.2 分子生物学鉴定结果 为了进一步明确菌株Hsg1949的分类地位,将 Hsg1949的16S rDNA序列在NCBI中进行BLAST分析,结果显示,菌株Hsg1949与贝莱斯芽胞杆菌FJ17-4(MT103089.1)、枯草芽胞杆菌ME-1(JQ900635.1)、解淀粉芽胞杆菌 SB1(MF171193.1)、蜡样芽胞杆菌B.cereus TJ(JX506728.1)、暹罗芽胞杆菌B.siamensis ICMP 20282(MF682396.1)等菌株的16S rDNA同源性达到99.79%,系统发育树显示,Hsg1949与贝莱斯芽胞杆菌、枯草芽胞杆菌、解淀粉芽胞杆菌处于同一分支(图2A)。进一步利用gyrA基因序列在NCBI中进行Blast分析,结果显示Hsg1949与贝莱斯芽胞杆菌NRRL B-41580的gyrA基因序列同源性最高,达到99.40%。系统发育树结果(图2B)显示,菌株Hsg1949与贝莱斯芽胞杆菌处于同一个分支,综合上述结果,确定菌株Hsg1949为贝莱斯芽胞杆菌。
2.3 菌株Hsg1949发酵上清液抑菌活性及稳定性
菌株Hsg1949发酵上清液具有良好的热稳定性(表3),与常温(25 ℃)相比,上清液经40 ℃~100℃处理对3株镰孢菌分离株的拮抗活性无显著影响(P>0.05),120 ℃高温处理后,上清液的抑菌活性显著下降(P<0.05),对3株镰孢菌分离株的抑制率分别为0.90%、4.24%和10.56%,基本失去对镰孢菌的抑制活性。酸性环境(pH 3.0~5.0)和中性环境(pH 7.0)未降低菌株Hsg1949发酵上清液对镰孢菌的抑菌活性,碱性环境(pH 11)显著降低了Hsg1949上清液的抑菌活性(表4)。
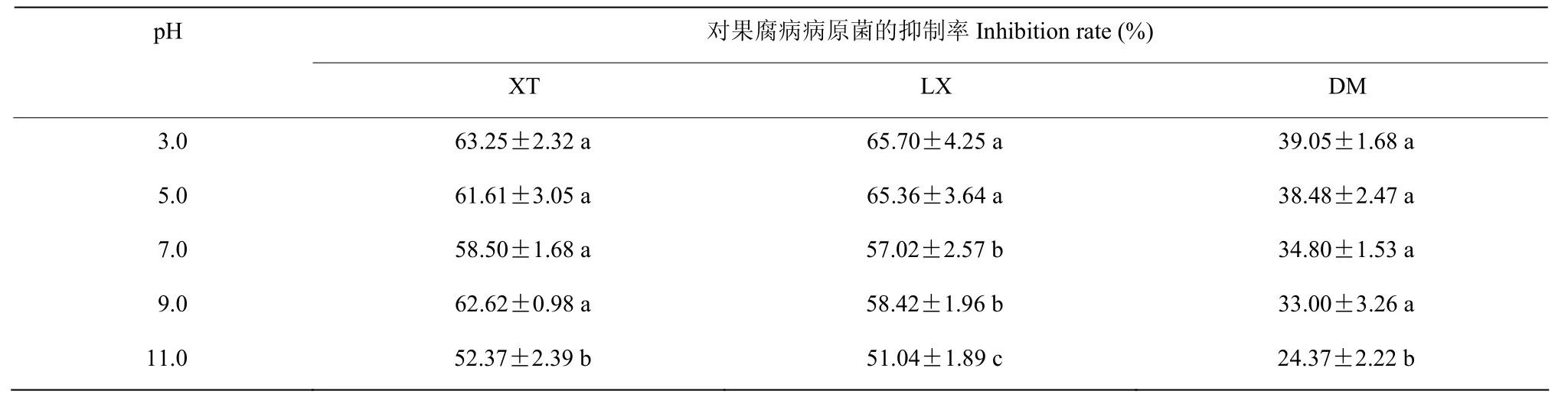
表4 菌株Hsg1949发酵滤液pH稳定性检测结果Table 4 The pH stability assay results of strain Hsg1949 cell-free fermentation supernatant
2.4 菌株Hsg1949对4种植物病原菌的抑制作用
抑菌谱测定结果(图3,表5)表明,菌株Hsg1949对白绢病、黄萎病、枯萎病和立枯病4种土传病原真菌有较好的抑制效果,抑菌率为 54.4%~79.3%,其中对黄萎病病菌的抑制活性明显,抑菌率达到了79.3%。
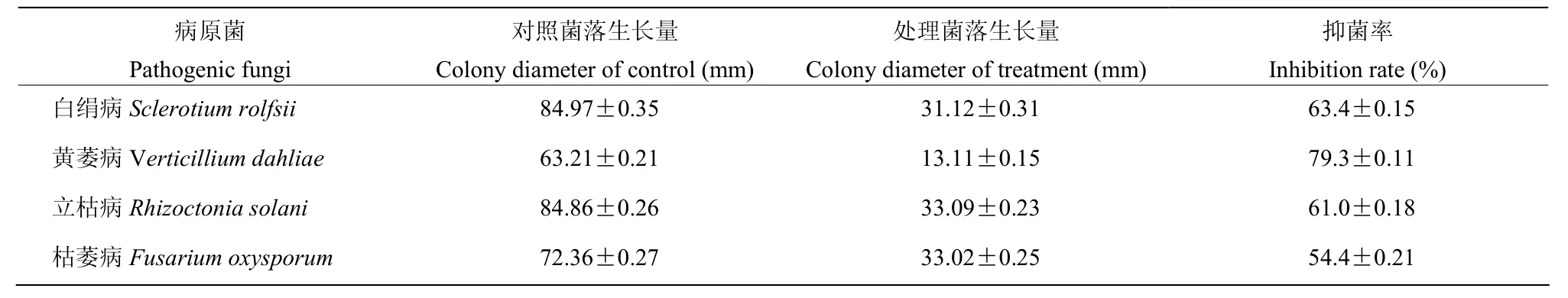
表5 菌株Hsg1949对植物病原菌抑制活性Table 5 Inhibition of pathogenic fungi by strain Hsg1949
2.5 菌株Hsg1949对花生果腐病的田间防效
田间小区防病试验表明,菌株 Hsg1949对花生果腐病具有良好的防治效果(表 6)。Hsg1949菌剂1×108~5×108cfu/mL处理和多菌灵处理的花生荚果发病率差异不显著(P>0.05),均显著低于清水对照(P<0.05);Hsg1949菌剂2×108、5×108cfu/mL处理对花生果腐病的防效分别为66.54%和71.27%,与化学药剂多菌灵防效(75.11%)相当,菌剂1×108cfu/mL处理的防效(56.35%)显著低于多菌灵(75.11%)(P<0.05)。

表6 不同菌剂对花生果腐病的防治效果Table 6 Control efficiency of the strain Hsg1949 against pod rot of peanut
3 讨论
国内外研究表明,花生果腐病由镰孢菌属[26]、腐霉属Pythium spp.[27]、丝核菌属Rhizoctonia spp.[28]、丽赤壳属Calonectria spp.[29]和侵脉新赤壳菌[14]等多种病原引起,不同区域的主要致病菌有所不同[30]。目前我国山东[31]、河北[32]、海南[33]、河南[34]等地均有花生果腐病病菌分离鉴定的相关报道,表明我国花生果腐病的主要病原菌为镰孢菌。本研究在多年种植且果腐病发生较为严重的花生田根际土中分离到一株对花生果腐病原菌镰孢菌具有较明显拮抗作用的芽胞杆菌Hsg1949。根据菌落形态特征、Biolog生理生化检测及利用16S rDNA和gryA序列分析,鉴定菌株Hsg1949为贝莱斯芽胞杆菌。
贝莱斯芽胞杆菌是芽胞杆菌属的一个新种,与枯草芽胞杆菌和解淀粉芽胞杆菌亲缘关系密切,最早报道于2005年[35],近年来已用于防治水稻稻瘟病[11]、棉花黄萎病[36]、水稻条斑病[18]、甘蔗赤霉病[37]、生菜软腐病菌核病[38]、烟草赤星病[39]、番茄青枯病和香蕉枯萎病[40]、黄瓜棒孢叶斑病[10]和桑断枝烂叶病菌[41]、罗非鱼源无乳链球菌[42]等几十种动植物病害的生防研究,表现出良好的防效,具有成为新型生防微生物农药的潜力。近年来,芽胞杆菌的生防机理成为国内外研究的热点,拮抗蛋白和酯肽类抗生素等次生代谢产物可以使拮抗菌株对多种病原菌具有抑制作用[43,44],代谢产物中含有的蛋白酶和纤维素酶对病原细菌也表现出拮抗作用[10]。菌株Hsg1949次生代谢物拮抗作用稳定,下一步有必要定性测定其代谢产物中的抗菌物质,明确其致病机制。
生防菌株的防治效果与植物种类、土壤性质及农事管理等因素密不可分,不同的菌株对特定的土壤环境存在着不同的适应力。供试菌株对目标病原菌抑菌圈的大小并不能代表田间的防治效果,要想达到较好的田间防治效果,还需室内筛选与温室防效测定相结合[45]。本研究结果与这一观点相吻合,相对于前人研究中芽胞杆菌对镰孢菌等病原菌的抑菌带,Hsg1949对镰孢菌的抑菌带较小,低于10 mm,但对病原菌的抑菌率达到了70%左右,田间小区试验表明Hsg1949对花生果腐病表现出较好的防治效果,与多菌灵的防治效果相当。Hsg1949对花生白绢病等其他土传病原真菌也具有较明显的抗菌活性,可为花生土传病害生防菌剂的开发应用提供一定的理论基础和技术支持。
