丹参根腐病拮抗细菌筛选、鉴定及生防机理研究
2021-10-22王子强刘丽娜洒荣波
许 乐,王子强,张 爽,邢 倩,刘丽娜,洒荣波
(山东第一医科大学(山东省医学科学院)生命科学学院,泰安 271000)
丹参Salvia miltiorrhiza为多年生草本药用植物,以根入药,具有祛瘀止痛、活血调经、养心除烦等功效,广泛用于心脑血管病的治疗[1,2]。丹参是栽培面积较大的药材之一,在人工栽培条件下,由于种植生态环境中生物群落多样性差、丰富度低,常常发生严重的病虫害,影响到丹参植株的生长发育,导致药材产量下降,品质变劣[3]。丹参根腐病是由腐皮镰刀菌Fusarium solani引起的一种土传病害,近年来传播蔓延较快,染病后的丹参植株长势衰弱,严重时地上部枯死,根的木质部完全腐烂成黑褐色,产量显著降低,其外观性状和品质均不符合药用要求[4]。对丹参根腐病的防治,目前主要采用化学农药防治,但防效甚微[5];而利用有益微生物菌剂防治丹参真菌病害是解决中药材土传病害的最佳选择[6]。
药用植物内生菌作为宝贵的微生物资源库,在植物病害生物防治方面越来越引起研究者们的关注。根据Partida-Martínez等[7]的研究表明,任何植物物种中均会分离到内生菌。药用植物内生细菌、真菌及放线菌均具有一定的抑菌活性,这 3类内生菌都是重要的植物病害生防菌种的重要资源[8]。毕江涛等[9]从药用植物沙冬青中分离出32株内生细菌,通过平板对峙试验,发现其中有23株对枸杞黑果病菌具有明显抑菌活性,18株对小麦全蚀病菌具有不同程度的抑菌活性。宋利沙等[10]从广西青天葵植株中分离得到23株内生真菌,以 15种病原真菌为指示菌株,用平板对峙法对分离的内生真菌进行抑菌试验,发现内生真菌MQY-1对多种病原真菌指示菌具有较强的抗菌活性。祖丽皮亚木·木沙尔[11]从新疆药用植物百里香中分离到126株内生放线菌,通过对指示菌的抗菌活性结果显示,有54株菌株对一个或多个指示菌表现出了抑制能力,说明百里香内生放线菌具有抑菌广谱性,对苹果腐烂病菌、番茄早疫病菌、肠炎沙门氏菌等病原菌具有较好的拮抗效果。
对丹参这一重要中药材内生菌的相关研究也陆续有报道。Li等[12]从山东产区的丹参根、茎和叶中分离到14株内生真菌,经形态学和分子鉴定,将分离到的内生真菌分为4个属:链格孢属、镰刀菌属、裂褶菌属和曲霉菌属,并对链格孢属菌株Sa-F2和镰刀菌属菌株Sa-R2次级代谢产物进行了抗氧化活性研究;颜华等[13]从健康丹参植株中进行内生菌分离,共分离得到69株内生菌,其中真菌62株、放线菌7株,病原菌拮抗性试验表明,有12株内生菌对2种及以上靶标病原菌具有拮抗活性,表明丹参内生菌具有一定的广谱抗菌性;唐坤等[14]分析了我国河南产区丹参内生真菌的多样性,从野生、栽培、仿野生3种生境的丹参内分离到277株内生真菌,经形态学和分子生物学鉴定分属于25个属。前人报道多是从丹参植株分离内生真菌,而具有拮抗效果的丹参植株内生细菌的分离却鲜有人报道。本研究中,对山东省泰安市丹参种植基地的丹参植株进行了内生细菌的分离、纯化、培养,以丹参根腐病病原菌腐皮镰刀菌为靶标菌,分离到一株对腐皮镰刀菌有较强抑菌效果的细菌并对其进行了鉴定,并对此细菌对腐皮镰刀菌的抑菌机制进行了初步研究。本研究对开发新的中药丹参资源,降低丹参真菌病害,提高丹参产量具有指导意义。
1 材料与方法
1.1 供试材料
1.1.1 丹参植株采集 于山东省泰安市泰山脚下某丹参种植基地采集长势健康的3年生丹参植株,采样时将整棵植株连根拨出放入无菌袋中带回实验室进行内生细菌分离。
1.1.2 病原真菌 腐皮镰刀菌Fusarium solani、立枯丝核菌Rhizoctonia solani、链格孢菌Alternaria alternata、尖孢镰刀菌Fusarium oxysporum、炭疽病菌Colletotrichum orbiculare、禾谷镰刀菌Fusarium graminearum、葡萄座腔球菌Botryosphaeria ribis和假禾谷镰刀菌Fusarium pseudograminearum均由本实验室保存。
1.1.3 培养基 马铃薯葡萄糖琼脂培养基(PDA)和LB培养基[15]。抗菌活性物质发酵培养基:葡萄糖20.0 g,玉米粉10.0 g,黄豆饼粉20.0 g,硫酸铵0.5 g,磷酸二氢钾1.5 g,碳酸钙1.0 g,水1000 mL。
1.2 丹参内生拮抗细菌分离
取长势良好的丹参健康植株,用流水清洗干净,对材料表面按以下流程进行消毒:75%乙醇浸泡1 min,无菌水冲洗3次;0.1%升汞中浸泡3 min,无菌水冲洗3次。在无菌操作台中将处理过的丹参根、茎、叶等组织分别用研钵研磨成浆状,无菌水稀释10倍后涂布于LB培养基上,37 ℃培养3 d。待培养基上长出可见菌落时,及时挑取菌落,经多次划线分离获得纯培养物[16]。取最后一遍冲洗丹参植株的无菌水,涂布于LB培养基上,37 ℃下培养3 d后无菌落长出,表明样品表面消毒彻底。
1.3 平板对峙试验筛选拮抗细菌
参照宋光桃等[17]报道的方法,以腐皮镰刀菌为靶标病原菌,筛选丹参内生拮抗细菌。采用两点平板对峙法将分离到的丹参内生细菌进行病原真菌拮抗性能测试,取培养7 d的腐皮镰刀菌,用直径5 mm的打孔器打孔,将5 mm的菌饼接种于PDA平板中央,距菌饼2.5 cm处上下平行划线接种分离到的丹参内生细菌,以不接拮抗细菌的真菌平板作为对照,置于30 ℃培养箱中恒温培养。待对照组病原菌菌落长满皿底时,测量处理组抑菌带宽度,每个处理3次重复。
1.4 内生细菌的鉴定
1.4.1 形态学和生理生化鉴定 将菌株DS-R5接种于LB平板上,置于37 ℃恒温培养箱内培养24 h,观察其菌落形态特点,进行常规革兰氏染色,利用光学显微镜和透射电镜对菌体形态进行观察。菌株的生理生化鉴定参考《常见细菌系统鉴定手册》进行。
1.4.2 16S rDNA 序列分析 参考陈奕鹏[18]的方法进行16S rDNA基因序列PCR扩增,以菌株DS-R5的总DNA 为模板,利用通用引物(8F:5′-AGAGTTTGATCCTGGCTCAG-3′,1513R:5′-ACGGCTACCTTGTTA CGACTT-3′)扩增细菌的16S rDNA序列,扩增产物交上海铂尚生物技术有限公司测序,序列测定结果在NCBI网站进行BLAST同源序列比对,选取相似度高的菌株序列构建系统发育树。
1.5 菌株DS-R5抑菌谱的测定
采用对峙培养法进行菌株DS-R5对8种常见植物病原真菌抑菌试验。将供试真菌制成直径5 mm的菌饼,置于PDA平板中央,然后将菌株DS-R5划线接种于距供试病原菌菌饼 2.5 cm处,30 ℃恒温培养7 d后测定抑菌带宽度,每个处理3次重复。
1.6 拮抗细菌抑菌机制研究
1.6.1 菌株DS-R5产生的抗菌活性物质对病原真菌孢子萌发的抑制作用 取一菌环菌株DS-R5接种至LB培养基中,200 r/min、37 ℃条件下过夜培养,以2%接种量接入抗菌活性物质发酵培养基中,200 r/min、37 ℃条件下发酵72 h,6000 r/min离心取上清液。分别采用硫酸铵沉淀和酸沉淀法提取发酵液抗菌活性物质,试验中发现硫酸铵沉淀法不能将全部活性物质提取出来,而酸沉淀法可以将活性物质完全沉淀,因此试验中采取将发酵液用6 mol/L盐酸调节pH至2.0,4 ℃过夜后6000 r/min离心10 min收集沉淀,用无菌水冲洗3次后冷冻干燥,得到淡黄色粉末,此为抗菌活性物质粗提物[19]。
孢子萌发平板试验:将上述制备的抗菌活性物质粗提物用pH值为6.8的磷酸缓冲液(PBS)配制成浓度分别为5和10 mg/L的抗菌活性物质溶液备用。将病原真菌孢子在2%葡萄糖溶液中制成孢子悬浮液,浓度为1×106孢子/mL。将配好的PDA培养基在121 ℃、0.1 Mpa条件下灭菌20 min,冷却至50 ℃左右还未凝固时,按孢子悬浮液:PDA培养基=1:100的比例向PDA培养基中加入配好的孢子悬浮液,混合均匀后倒平板,待平板凝固后距平板中央2 cm处均匀放置3个灭菌的牛津杯,向其中2个牛津杯中加入200 μL浓度分别为5和10 g/L的抗菌活性物质溶液,以加入200 μL的PBS溶液作为对照。
孢子萌发镜检试验:将10 mg/L的抗菌活性物质溶液与孢子悬浮液等体积混和,取10 μL混和液滴于凹玻片上,盖上盖玻片后将凹玻片放于灭菌培养皿中,30 ℃培养箱中保湿培养,每隔8 h镜检观察孢子萌发数,连续观察至32 h[20]。计算萌发率、抑制率,萌发率(%)=已萌发的孢子数/孢子总数×100%,抑制率(%)=(对照萌发率-处理萌发率)/对照萌发率×100%。
1.6.2 菌株DS-R5对病原真菌菌丝的抑制作用 用无菌牙签挑取对照组病原菌正常生长菌丝,以及处理组受菌株DS-R5抑制的腐皮镰刀菌菌丝制片,在光学显微镜下观察拮抗菌株DS-R5对腐皮镰刀菌菌丝形态的影响。
参照赵欣[21]报道的方法进行,流程如下:取正常生长及受抑制菌丝样品,先用戊二醛固定 24 h,接着用PBS缓冲液处理后OsO4固定5 h;45%和55%乙醇溶液分别处理30 min,70%乙醇处理过夜;85%、95%、100%乙醇溶液分别处理30 min;醋酸异戊酯处理1 h;CO2临界点干燥、粘贴、喷金镀膜,进行扫描电镜观察。
参照康振生[22]报道的方法进行,流程如下:取正常生长及受抑制菌丝样品,先用戊二醛固定24 h,接着用PBS缓冲液处理后OsO4固定5 h;45%和55%乙醇溶液分别处理30 min,70%乙醇处理过夜;85%、95%、100%乙醇溶液分别处理30 min;环氧丙烷处理1 h后,纯树脂处理9 h;换纯树脂和环氧树脂(DMP-30)过夜处理;树脂包埋后36 ℃存放10 h、45 ℃存放14 h、60 ℃存放36 h后取出,进行透射电镜观察。
1.7 菌株DS-R5的盆栽防效试验
选取长势良好的盆栽丹参幼苗60株,每盆1株,分成健康对照组(不接菌种)、病原菌对照组(接种病原真菌)和试验组(接种病原真菌和拮抗细菌)3组,每组20株。向对照组和试验组中分别灌根接种20 mL(孢子浓度为1×106孢子/mL)腐皮镰刀菌孢子悬浮液,以接等量无菌水为空白组对照;10 d后向对照组和试验组中分别灌根接种20 mL菌株DS-R5发酵液,以接种20 mL未接种的灭菌培养基为空白组对照。60 d后统计分析菌株DS-R5对丹参根腐病的防病效果。根据丹参幼苗根部组织的病斑面积将病情分为五级:1级为无病斑;2级为病斑面积<5%;3级为病斑面积5%~20%;4级为病斑面积21%~50%;5级为病斑面积>50%。病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果(%)=(对照组病情指数-处理组病情指数)/对照病情指数×100。
1.8 数据统计与分析
试验所得数据结果采用SPSS 19.0统计分析软件处理,Duncan氏新复极差法进行处理间差异显著性分析。
2 结果与分析
2.1 丹参内生拮抗细菌的分离与筛选
从健康丹参根、茎和叶中共分离得到72株细菌,其中从丹参根部组织分离到39株细菌,占分离细菌总数的54.2%;从丹参茎和叶中分别分离到24株和9株细菌,分别占分离细菌总数的33.3%和12.5%。对峙试验显示,72株内生细菌有13株对靶标病原真菌腐皮镰刀菌有不同程度的拮抗效果,其中菌株DS-R5对腐皮镰刀菌抑制效果最强,抑菌带宽度可达20.5 mm(表1)。因此选择菌株DS-R5进行下一步的深入研究。
2.2 菌株DS-R5的鉴定
2.2.1 形态和生理生化特征 菌株DS-R5在LB培养基上培养36 h后,菌落光滑、湿润,菌落形状为圆形,不易挑起(图1 A);在光学显微镜下,菌体为杆状,革兰氏染色为阳性,产椭圆形芽胞,且芽胞中生(图1 B、C);扫描电镜显示,菌体细胞大小为0.8 µm×2.8 µm左右(图1 D)。菌株DS-R5的部分生理生化特性如表2所示,菌株DS-R5能利用葡萄糖、甘油发酵产酸,淀粉水解、明胶水解、厌氧生长、接触酶、硝酸盐反应、V-P 反应、水解酪蛋白反应等均为阳性,氧化酶反应、柠檬酸盐反应、琥珀酸盐反应、H2S产生反应等均为阴性,在NaCl含量为5%的培养基上不能生长(表2)。在所测定的生理生化指标中,菌株DS-R5与多粘类芽胞杆菌Paenibacillus polymyxa性质一致[23]。
2.2.2 菌株DS-R5基于16S rDNA 序列的系统发育树分析 结果表明,菌株DS-R5(GenBank Accession SUB9879573)与多粘类芽胞杆菌Paenibacillus polymyxa处于同一分支(图2)。因此,结合菌株DS-R5培养特征和生理生化特征,将菌株DS-R5鉴定为多粘类芽胞杆菌。
2.3 菌株DS-R5的抑菌谱
菌株DS-R5对供试8种常见植物病原真菌均有不同程度的抑制作用。其中对立枯丝核菌和腐皮镰刀菌抑菌活性较强,抑菌带带宽分别为21.2和20.5 mm;对禾谷镰刀菌和假禾谷镰刀菌抑菌活性较弱,抑菌带带宽分别为7.9和6.5 mm,试验表明菌株DS-R5具有较宽的抑菌谱(表3)。
2.4 菌株 DS-R5产抗菌活性物质对腐皮镰刀菌孢子萌发的抑制作用
孢子萌发平板试验表明,抗菌活性物质的加入可以抑制腐皮镰刀菌孢子萌发成菌丝,形成明显的抑菌圈,而且随着抗菌活性物质浓度的升高,形成的抑菌圈明显变大,而对照组孢子正常萌发成菌丝,没有任何抑菌圈形成(图3)。
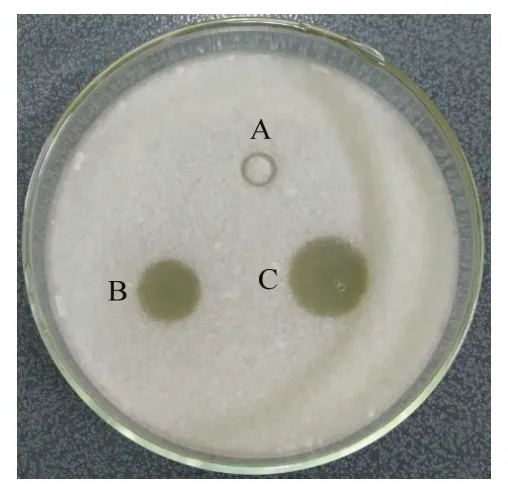
图3 孢子萌发平板抑制试验Fig.3 Spore germination plate inhibition test
菌株 DS-R5抗菌活性物质粗提物对腐皮镰刀菌孢子萌发有强烈的抑制作用,处理组孢子萌发率显著低于对照组:8 h时,对照组孢子萌发率分别为17.3%;而处理组孢子萌发率仅为4.3%,此时孢子萌发抑制率为75.1%;32 h时,对照组孢子全部萌发,而处理组孢子萌发率仅为17.7%,孢子萌发抑制率为82.9%(表4)。
2.5 菌株DS-R5对腐皮镰刀菌菌丝的影响
2.5.1 光学显微镜观察菌株DS-R5对腐皮镰刀菌菌丝的影响 光学显微镜镜检发现,菌株DS-R5对腐皮镰刀菌菌丝生长具有明显的破坏作用。对照组菌丝颜色发亮、细长且粗细均匀(图4A),而受拮抗菌株DS-R5抑制的腐皮镰刀菌菌丝体大部分发生畸变,菌丝缠绕、断裂,局部出现断裂(图4B)。
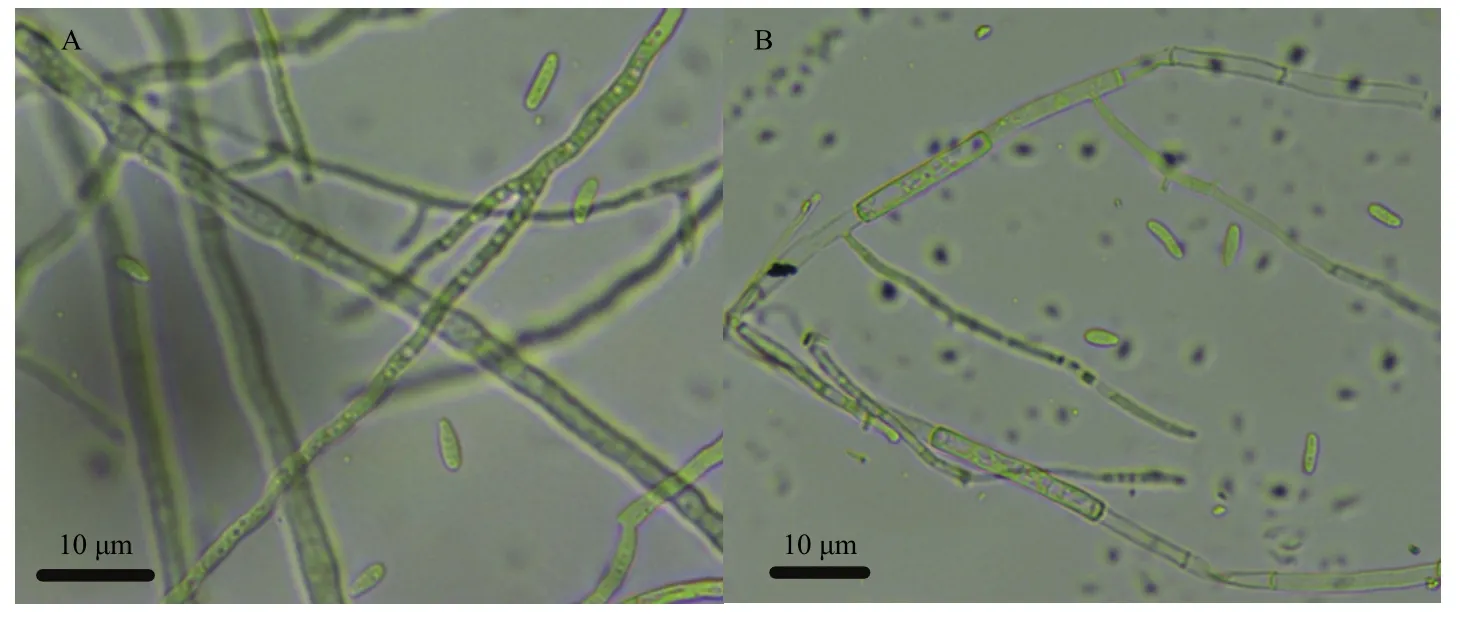
图4 光学显微镜下菌株DS-R5对腐皮镰刀菌菌丝的抑制效果Fig.4 Inhibitory effect of strain DS-R5 on F.solani hyphae under optical microscope
2.5.2 扫描电镜观察菌株DS-R5对腐皮镰刀菌菌丝的影响 由图5可知,菌株DS-R5对腐皮镰刀菌菌丝有一定的影响。对照组的样品菌丝排列规则,粗细均匀,形状完整,呈现出正常的管状结构,且菌丝体表面光滑。处理组的样品菌丝体形态上相比对照组有较大变化,大量菌丝断裂,有菌丝碎屑产生,菌丝粗细不一,表面粗糙,有胞内物质泄露。
2.5.3 透射电镜观察菌株DS-R5对腐皮镰刀菌菌丝的影响 由图6可以看出,对照组的菌丝结构规则,细胞壁和细胞膜结构完整,细胞器清晰正常,线粒体均匀,细胞内含物无外渗现象。处理组菌丝体超微结构受到不同程度破坏,菌丝体细胞畸形,无完整细胞器存在,胞质外流,内部出现异常空洞。上述试验结果表明,菌株DS-R5可以破坏腐皮镰刀菌内部细胞器,引起细胞变形,从而导致菌丝细胞死亡。
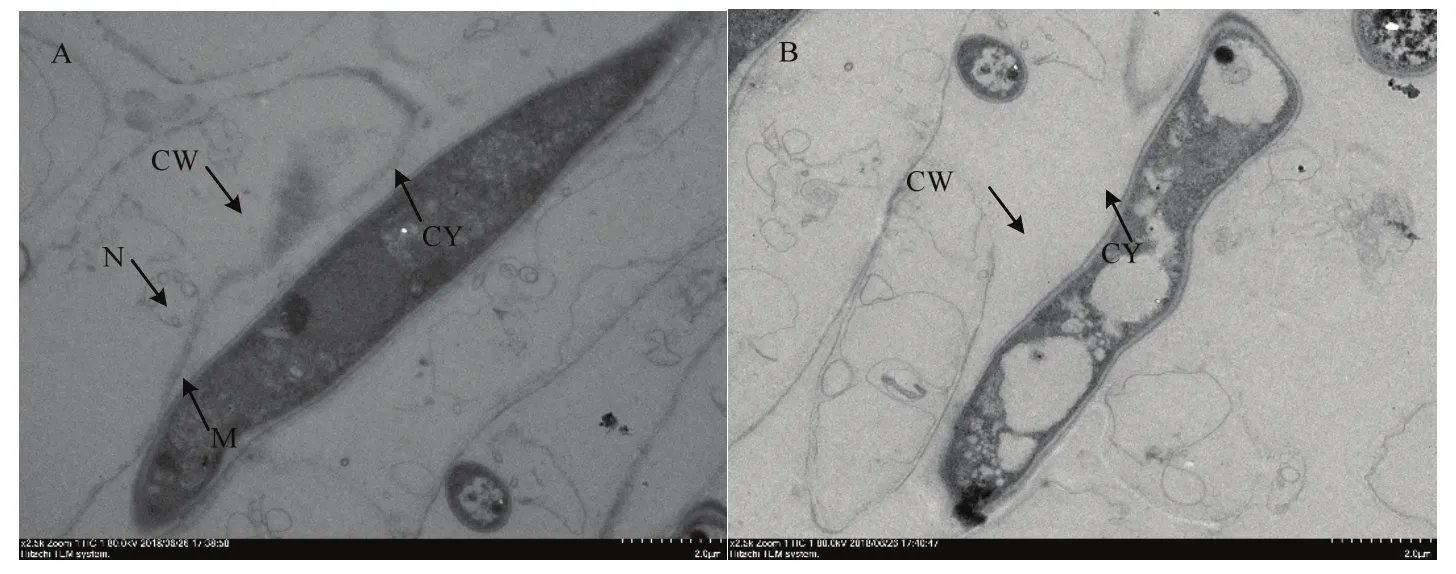
图6 透射电镜下菌株DS-R5对腐皮镰刀菌菌丝的影响Fig.6 Inhibitory effect of strain DS-R5 on F.solani hyphae under TEM
2.6 菌株DS-R5对丹参根腐病的防治效果
盆栽试验结果表明,不接菌种的空白组的病情指数为 6.7,接种病原真菌的对照组和接种拮抗细菌的试验组病情指数分别为60.5和26.3,从病情指数来看,接种拮抗菌株DS-R5后对丹参根腐病具有显著的防治效果,试验组的防治效果达到61.4%(表5)。

表5 菌株DS-R5对丹参根腐病的盆栽试验防治效果Table 5 Control efficacy of the strain DS-R5 against root rot of S.miltiorrhiza under pot experiments
3 讨论
本研究从丹参健康植株中分离到一株拮抗细菌DS-R5,经菌株形态、生理生化特征和16S rDNA序列分析将其鉴定为多粘类芽胞杆菌。多粘类芽胞杆菌是一类可以产生芽胞的非致病性细菌,可产生抗生素和抗菌蛋白等多种生物活性物质,是重要的生防细菌和植物根际促生菌,多粘类芽胞杆菌对人和动植物没有致病性,在植物病害生物防治方面具有诱人的前景[24]。祝久香等[25]采用涂布平板法和对峙培养法,从健康油菜根际土中筛选到 1株对油菜菌核病菌具有较强生防效果的多粘类芽胞杆菌 HX-140,此细菌对供试8种病原真菌有显著的拮抗作用,发酵液在离体油菜叶片上对油菜菌核病的防治效果为65.51%,在盆栽试验中对油菜菌核病的防治效果为 62.22%。王波等[26]从健康大豆植株中分离筛选得到拮抗效果较好的多粘类芽胞杆菌 XZ-2,拮抗活性测定显示该菌株对引起大豆主要病害的大豆疫霉病菌、大豆炭疽病菌和大豆菌核病菌均有较强的抑制作用。此外,多粘类芽胞杆菌还对植物生长具有促生作用,这种作用已经在多种植物中得到验证。郭芳芳等[23]从浙江天目山柳杉中分离得到的1株多粘类芽胞杆菌CF05,室内生测结果表明,发酵液和菌悬液对番茄幼苗均具有明显的促生效果。徐桑尔等[27]试验了多粘类芽胞杆菌CF05菌剂对铁皮石斛的促生长作用,结果表明与对照相比,CF05菌剂处理后铁皮石斛鲜质量提高了31.0%,侧芽增加31.58%。因此,菌株DS-R5促进丹参植株生长的作用及机制是未来研究的重点。
本研究还发现,菌株DS-R5活菌及发酵液产抗菌活性物质均可以抑制腐皮镰刀菌生长,从而可以对丹参根腐病进行生物防治。由于抗菌活性物质提取过程较为繁琐,考虑到之后的应用开发形式,建议使用活菌,尤其是菌株DS-R5所产芽胞为菌株DS-R5的的应用形式,这样就不需要花费大量时间分离菌株DS-R5所产抗菌活性物质。另外,本研究从丹参中分离到的多粘类芽胞杆菌DS-R5,为丹参根腐病病害的生物防治奠定了菌种基础,下一步可以在实验室条件下就菌株DS-R5的抗菌活性物质进行分离纯化和结构鉴定,以期为丹参根腐病生防菌株的开发及应用提供一定的理论指导,并为新药的开发提供功能菌株及有效代谢物。本研究不足之处是仅仅进行了菌株DS-R5对丹参根腐病的盆栽试验,没有进行大规模的田间试验,另外也没有考虑到光照、温度、温度、土壤等因素对试验的影响,在后续的试验过程中会进一步进行探讨。
