一种简单高效的芽胞纯化方法及其效果评价
2021-07-01田寒友史宇璇乔晓玲
邹 昊, 田寒友, 白 京, 王 辉, 史宇璇, 乔晓玲*
(1.中国肉类食品综合研究中心,北京 100068;2.肉类加工技术北京市重点实验室,北京 100068)
基于菌株的生长可被特定抗生素抑制的原理,微生物法是目前应用最为广泛的检测食品中抗生素残留总量的方法[1]。其中,利用嗜热脂肪地芽胞杆菌(Geobacillusstearothermophilus)对多种抗生素敏感[2-3]、繁殖速度快和产芽胞可长期保藏等特点开发的试管扩散法已成为检测鲜乳及其他动物源性食品中抗生素残留总量的标准方法[4-9]。现行的标准方法中,在制备芽胞悬液的过程中没有将芽胞与营养体细胞分离,而是通过热水浴((80±2) ℃,10 min)的方式将营养体细胞杀死[7]。这样制备的芽胞悬液因含有死亡的营养体细胞,主要存在以下两个问题:首先,因为每次制备的芽胞悬液中营养体细胞的数量都不固定,所以只能通过菌落计数的方式来确定芽胞的浓度,需要培养48 h,延长了检测管的制备时间[10];其次,由死亡的营养体细胞分解产生的胞壁肽等物质可诱导芽胞萌发,易导致检测管在保藏过程中失效,缩短了检测管的保质期[11-12]。因此,在制备芽胞悬液的过程中,对芽胞进行纯化是很有必要的。国内外的学者在相关研究中也介绍了芽胞纯化方法,Georget等[13-21]通过反复离心并倾倒上清液的方式去除混悬液中的营养体细胞。Finley等[22-26]在离心法的基础上加入了酶解和超声等环节以提高芽胞纯化效率。但这些方法或多或少都存在着制备时间长、操作繁琐以及所需的仪器和试剂较多等问题。本研究以嗜热脂肪地芽胞杆菌为例,介绍了一种简单高效的芽胞纯化方法,应用此方法对其芽胞进行纯化后,通过镜检等方式从纯化后芽胞悬液的纯度,保藏2 a后芽胞悬液的质量以及对其他芽胞杆菌芽胞的纯化效果等方面对此方法进行评价,为芽胞纯化方法的改进,以及进一步提高试管扩散法对食品中抗生素残留总量的检测性能,缩短其制备时间,延长其保质期提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 嗜热脂肪地芽胞杆菌(GeobacillusstearothermophilusCICC 10425)、嗜热脂肪地芽胞杆菌(GeobacillusstearothermophilusCICC 10392)、枯草芽胞杆菌(BacillussubtilisCICC 20474)、枯草芽胞杆菌(BacillussubtilisCICC 20506),由中国工业微生物菌种保藏管理中心提供。
1.1.2 培养基 胰蛋白胨(LP0042),英国OXOID公司;酵母提取物(212750)、琼脂粉(214010)、营养肉汤培养基(23400)、营养琼脂培养基(213000),美国BD公司;无水葡萄糖、无水磷酸氢二钾、四水合氯化锰(分析纯),国药集团化学试剂有限公司。
1.1.3 仪器与设备 离心机(SORVALL LYNX 4000,美国Thermo Fisher Scientific公司);电子天平(BSA822-CW,德国Sartorius公司);pH计(PB-10, 德国Sartorius公司);相差显微镜(PRIMO STAR,德国ZEISS公司);显微镜彩色制冷CCD (ProgRes CF SCAN,德国JENOPTIK公司);自然对流培养箱(BD260,德国BINDER公司);多功能酶标仪(Synergy H4,美国BioTek公司);生物安全柜(AIRSTREAM ClassⅡ,新加坡ESCO公司);全温振荡培养箱(THZ-C-1型,太仓市豪成实验仪器制造有限公司);加热磁力搅拌器(85-2,上海司乐仪器有限公司)。
1.2 方法
本研究中与菌株接触的培养基、化学试剂、耗材和器具等均经过环氧乙烷或121 ℃,15 min的湿热灭菌;涉及的操作,除离心、震荡、磁力搅拌、培养、镜检和吸光度值检测外,均在生物安全柜内完成。
1.2.1 菌株的复壮 根据保藏中心提供的说明书,先用100 μL的营养肉汤培养基将嗜热脂肪地芽胞杆菌(G.stearothermophilusCICC 10392)的菌种冻干粉溶解,再转移到5 mL营养肉汤培养基中,(55±0.1) ℃培养24 h,转接2代以恢复菌株的活力,0~4 ℃保存备用。
1.2.2 芽胞的培养 对Kim等[25]的芽胞培养方法进行了改进,培养温度为(55±0.1) ℃,培养24 h后将平板倒置防止水分过度蒸发,培养5~7 d后,经镜检发现芽胞大量产生且成熟度满足要求后,对芽胞进行采集和纯化。
1.2.3 芽胞的采集 吸取20 mL,0~4 ℃的蒸馏水至培养基表面,用L形玻璃棒将培养基表面的菌苔刮落,制成芽胞和营养体细胞的混悬液并转移到离心瓶中。
1.2.4 芽胞的纯化 将离心瓶放入振荡培养箱中,0~4 ℃,180 r/min振荡30 min,打散混悬液中粘连在一起的营养体细胞和芽胞。然后根据本研究介绍的方法对混悬液中的芽胞进行纯化。①将离心瓶放入离心机中,0~4 ℃,690 g离心30 min。②将上清液倾倒干净。③将离心瓶倾斜,沿没有沉淀的一侧向离心瓶中缓慢加入200 mL,0~4 ℃的蒸馏水并放入磁力转子。④将离心瓶放在磁力搅拌器上,缓慢提高转速至600~1 200 r/min,通过使离心瓶中的蒸馏水形成的漩涡冲刷营养体细胞沉淀层,让营养体细胞逐渐从沉淀层剥离并悬浮于水中。当芽胞沉淀层开始裸露时,缓慢降低转速直至停止。在此过程中要保证芽胞沉淀层的完整。⑤将营养体细胞悬液倾倒干净。⑥向离心瓶中加入200 mL,0~4 ℃的无菌蒸馏水,振荡使所有沉淀物重新悬浮于水中。⑦重复步骤①~⑥直到芽胞纯度达到要求。将制备好的芽胞悬液转移至试剂瓶中,0~4 ℃避光保藏。
1.2.5 芽胞悬液纯度检测 首先将制备好的芽胞悬液离心(0~4 ℃,690 g,30 min),观察沉淀的分层情况,然后将其制成切片,在相差显微镜下(100×油镜)观察芽胞的状态和纯度。
1.2.6 保藏2 a后芽胞悬液质量检测 将制备好的芽胞悬液在0~4 ℃的环境下避光保藏2 a后,取出制成切片,在相差显微镜下(100×油镜)观察芽胞的状态和纯度。
1.2.7 芽胞浓度标准曲线的建立 对制备好的芽胞悬液进行梯度稀释,使用酶标仪测量其在600 nm处的吸光度(optical density at 600 nm,OD600)值,每个稀释梯度测量3次取算数平均值,选取OD600值在0~0.8之间的稀释梯度进行菌落计数。以OD600值为自变量,菌落数为应变量,进行线性回归,建立基于芽胞悬液OD600值的芽胞浓度标准曲线。
1.2.8 对其他芽胞杆菌芽胞的纯化效果 使用本研究介绍的方法对嗜热脂肪地芽胞杆菌(G.stearothermophilusCICC 10425)、枯草芽胞杆菌(B.subtilisCICC 20474)和枯草芽胞杆菌(B.subtilisCICC 20506)的芽胞进行纯化。将制备好的芽胞悬液制成切片,在相差显微镜下(100×油镜)观察芽胞的状态和纯度。
2 结果与分析
2.1 芽胞的培养
经过5 d的培养,芽胞的成熟度如图1所示,可见菌苔中大部分营养体细胞已经死亡且其中一部分已经自溶分解成细胞碎屑,只有少量成熟的营养体细胞。绝大部分芽胞为游离的芽胞,只有个别已萌发的芽胞。根据樊佳等[27]介绍的芽胞成熟度镜检评价标准,此时芽胞成熟度为Ⅴ级,可以对芽胞进行采集和纯化。

图1 培养5 d后芽胞的成熟度 Fig.1 The maturity of the endospores after 5 days of incubation
2.2 纯化效果
将纯化前的芽胞和营养体细胞的混悬液离心,所得的沉淀如图2a所示,沉淀分为2层,上层呈米黄色为密度较小的营养体细胞和细胞碎屑,下层呈白灰色为密度较大的芽胞。将混悬液制成切片在相差显微镜下观察发现如图2e所示,纯化前,混悬液中除了游离的芽胞外还混有很多营养体细胞、细胞碎屑和个别已萌发的芽胞。
第一次选择性悬浮营养体细胞后,对倾倒出去的营养体细胞悬液进行离心,所得的沉淀如图2b所示,沉淀全部呈米黄色,且未见芽胞沉淀层。将营养体细胞悬液制成切片,在相差显微镜下观察发现如图2f所示,倾倒出去的营养体细胞悬液中几乎全部为营养体细胞及细胞碎屑,只有个别游离的芽胞混在其中。
按照1.2.4中步骤①~⑥进行1次纯化后,对所得的混悬液进行离心,所得的沉淀如图2c所示,沉淀整体呈白灰色,顶端略带黄色,几乎看不到营养体细胞沉淀层。将混悬液制成切片,在相差显微镜下观察发现如图2g所示,纯化1次后的混悬液中大部分为游离的芽胞,但仍混有少量营养体细胞、细胞碎屑和已萌发的芽胞。与图2e相比,尽管只进行了1次纯化,但是混悬液中的营养体细胞和细胞碎屑均已明显减少。
重复步骤①~⑥ 6次后,芽胞纯度已达到本研究要求。将制备的芽胞悬液离心,所得的沉淀如图2d所示,可见沉淀全部呈白灰色,且未见营养体细胞沉淀层。将芽胞悬液制成切片,在相差显微镜下观察发现如图2h所示,纯化后的芽胞悬液中几乎全部为游离的芽胞,只有个别已萌发的芽胞混在其中,且未见营养体细胞和细胞碎屑。
综上所述,本方法先通过离心使混悬液分层沉淀,再通过磁力搅拌的方式选择性悬浮上层的营养体细胞并保证芽胞沉淀层的完整,可以高效地将混悬液中的营养体细胞与芽胞分离,纯化后所得的芽胞悬液纯度较高。

图2 纯化过程中混悬液的变化 Fig.2 The changes in the mixed suspension during the purification processa、b、c和d分别为纯化前的混悬液、倾倒出去的营养体细胞悬液、纯化1次后的混悬液和纯化后的芽胞悬液经离心后所得的沉淀;e、f、g和h分别为a、b、c和d对应的相差显微镜镜检图a, b, c and d are the sediments from centrifuging the mixed suspension before purification, the vegetative cell suspension which were poured out, the mixed suspension after the first round of purification and the endospore suspension after purification; e, f, g and h are the phase contrast microscopic images of a, b, c and d
2.3 保藏2 a后芽胞悬液的质量
保藏2 a后,芽胞悬液的质量如图3所示,此时悬液中大部分芽胞仍为游离的芽胞,只有少量已萌发的芽胞,说明通过本方法制备的芽胞悬液,在保藏2 a后,仍具有较高的质量。与图2h相比,悬液中已萌发的芽胞数量有小幅增加。其原因可能如Kussell等[28-30]在其研究中发现的一样,一些芽胞杆菌的芽胞具有随机萌发的特性,即每隔一段时间,种群中就会有一小部分芽胞自然萌发以保证芽胞种群在没有萌发诱导物质存在但适宜生长的环境下也可以正常萌发生长。

图3 保藏2 a后芽胞悬液的质量 Fig.3 The quality of the endospore suspension after two years of storage
2.4 芽胞浓度的标准曲线
嗜热脂肪地芽胞杆菌(G.stearothermophilusCICC 10392)芽胞浓度的标准曲线如图4所示。可见菌落数与OD600值之间有很好的线性关系(相关系数R2=0.99)。再次说明通过本方法制备的芽胞悬液纯度较高,可用检测其OD600值的方式来取代菌落计数法,对芽胞浓度进行快速测定。

图4 嗜热脂肪地芽胞杆菌(G. stearothermophilus CICC 10392)芽胞浓度标准曲线 Fig.4 The endospore concentration standard curve of G. stearothermophilus CICC 10392
2.5 对其他芽胞杆菌芽胞的纯化效果
使用本方法制备的嗜热脂肪地芽胞杆菌(G.stearothermophilusCICC 10425)、枯草芽胞杆菌(B.subtilisCICC 20474)和枯草芽胞杆菌(B.subtilisCICC 20506)的芽胞悬液如图5所示,可见各悬液中几乎全部为游离的芽胞,只有个别细胞碎屑混在其中且未见营养体细胞和已萌发的芽胞。说明本方法对其他芽胞杆菌的芽胞也有较好的纯化效果。

图5 对其他芽胞杆菌芽胞的纯化效果 Fig.5 The purification effects on the other Bacillus spp.a、b和c分别为使用本方法制备的嗜热脂肪地芽胞杆菌(G. stearothermophilus CICC 10425)、枯草芽胞杆菌(B. subtilis CICC 20474)和枯草芽胞杆菌(B. subtilis CICC 20506)芽胞悬液的相差显微镜镜检图a, b and c are the phase contrast microscopic images of G. stearothermophilus CICC 10425, B. subtilis CICC 20474 and B. subtilis CICC 20506 endospore suspension prepared by using the method that introduced in this study
2.6 不同纯化方法的比较
相关研究中不同芽胞纯化方法所需的操作、仪器、试剂和时间如表1所示,其中离心法是目前应用最多的方法,尽管该方法操作简单,涉及的仪器和试剂较少,但是耗时最长,大约需要4~14 d。如图2a和2e所示,其原因在于,即使在离心力较低(690 g)的情况下,混悬液中死亡的营养体细胞、成熟的营养体细胞和体积较大的细胞碎屑仍会与芽胞一起沉淀下来,只有那些体积较小的细胞碎屑会在离心后悬浮于上清液中。所以在使用离心法时,会在较长的一段时间(4~14 d)内反复对混悬液进行离心,一方面,诱导成熟的营养体细胞在没有营养物质的环境下逐渐死亡,另一方面,使死亡的营养体细胞在自溶酶的作用下逐渐分解成体积较小的细胞碎屑,从而通过离心的方式将营养体细胞与芽胞分离,达到纯化芽胞的目的[14-17]。
Finley等[22-26]为了加快营养体细胞分解成细胞碎屑的速度,在离心法的基础上加入了酶解和超声等环节。尽管这样可以明显缩短芽胞悬液的制备时间,但同时也增加了操作的复杂程度以及所需的仪器和试剂。此外,陈振民等[31-33]在其研究中发现,酶解过程中,在营养体细胞破裂死亡并逐渐分解成细胞碎屑的同时,其细胞内的营养物质以及细胞的酶解产物(胞壁肽等)可诱导周围的芽胞萌发,说明对混悬液进行酶解可诱导部分游离的芽胞萌发,造成游离芽胞数量的减少。Berger等[34-37]在其研究中发现,对芽胞进行超声处理后,可在周围环境中检测到由芽胞核释放的Ca2+和吡啶二羧酸(quinolinic acid, DPA)分子,同时芽胞衣外层的多种蛋白、糖肽、脂肪酸、脂酰甘油和糖脂也会随之脱落;Gould等[38-40]发现当芽胞衣的外层结构被破坏后,其对多种酶、表面活性剂和化学杀菌剂的抗性大大减弱;Palaclos等[35]发现DPA的释放可导致芽胞核的水合,促使芽胞萌发,且Setlow等[41-43]发现释放到环境中的DPA分子可诱导周围的芽胞萌发,说明对混悬液进行超声也可诱导部分游离的芽胞萌发,造成游离芽胞数量的减少。
与其他方法相比,本方法不仅操作较简单,所需的仪器较少,不使用任何试剂且耗时更短。
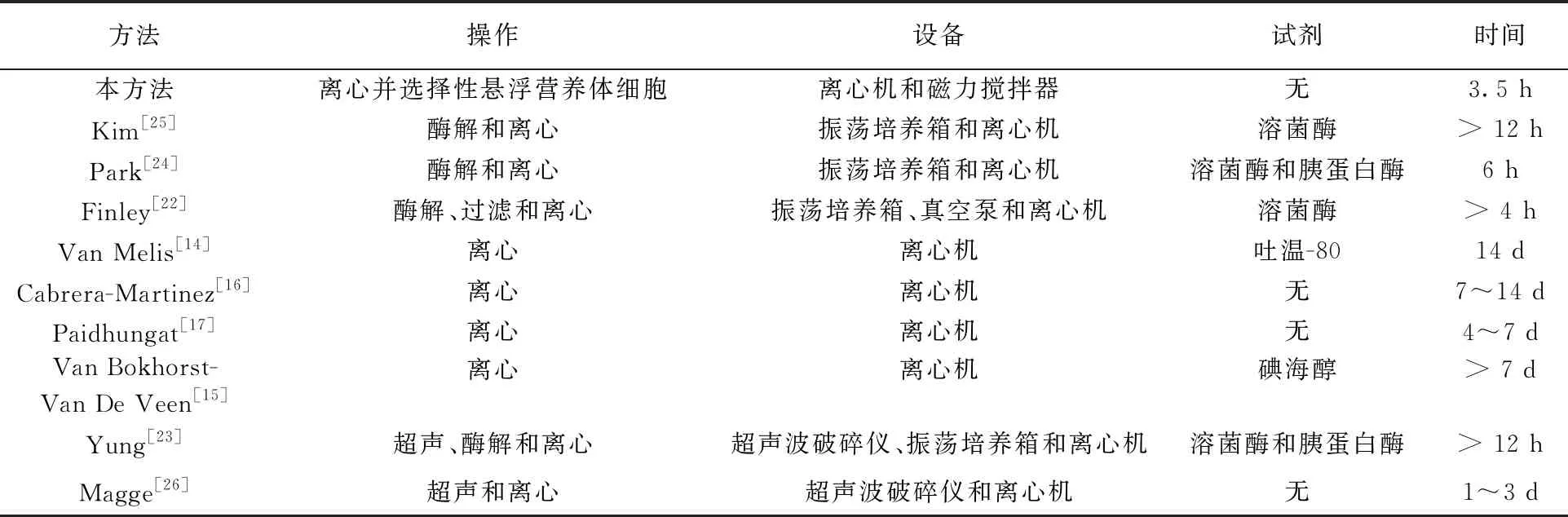
表1 不同纯化方法所需的操作、仪器、试剂和时间
3 讨 论
在使用本方法对芽胞进行纯化的过程中发现,混悬液进行离心时,若离心力过大,会导致沉淀层过于紧实,在选择性悬浮营养体细胞时,会出现营养体细胞不易被从沉淀层中剥离或沉淀层成块脱落的现象;若离心力过小,会导致沉淀层过于松散,在倾倒上清液时,部分沉淀层会随水流一起被倾倒出去,且在选择性悬浮营养体细胞时,很难保证芽胞沉淀层的完整。纯化2~3次后,会出现在倾倒出去的营养体细胞悬液中,游离芽胞的数量逐渐增多的现象,此时可适当增加离心的时间,使沉淀层更为紧实,在选择性悬浮营养体细胞时,可以更好地保证芽胞沉淀层的完整,减少芽胞的流失。随着纯化次数的增加,有时会出现离心后已看不到明显的营养体细胞沉淀层,但镜检仍可观察到少量营养体细胞和细胞碎屑的现象,此时可通过将芽胞沉淀层表面的少量芽胞悬浮于水中并倾倒出去的方式去除剩余的少量营养体细胞和细胞碎屑。
本研究介绍了一种简单高效的芽胞纯化方法,以嗜热脂肪地芽胞杆菌(G.stearothermophilusCICC 10392)为例,应用此方法对其芽胞进行纯化后,通过镜检等方式从纯化后芽胞悬液的纯度、保藏2 a后芽胞悬液的质量以及对其他芽胞杆菌芽胞的纯化效果等方面对此方法进行了评价,结论如下:由于芽胞的密度大于营养体细胞,所以离心后,混悬液会分层沉淀,上层为营养体细胞沉淀层,下层为芽胞沉淀层;通过磁力搅拌的方式选择性悬浮上层的营养体细胞并保证芽胞沉淀层的完整,可以高效地将混悬液中的营养体细胞与芽胞分离,纯化后,所得的芽胞悬液纯度较高;通过本方法制备的芽胞悬液在保藏2 a后仍具有较高的质量;通过本方法制备的芽胞悬液,可通过检测其OD600值的方式快速测定其中芽胞的浓度;使用本方法对其他芽胞杆菌的芽胞进行纯化,所得的芽胞悬液纯度较高;与其他纯化方法相比,本方法不仅操作较简单,所需的仪器较少,不使用任何试剂且耗时更短。
本研究可以为芽胞纯化方法的改进以及进一步提高试管扩散法对食品中抗生素残留总量的检测性能,缩短其制备时间,延长其保藏期方面提供参考。
