对草地贪夜蛾高毒力的苏云金芽胞杆菌菌株筛选与杀虫活性研究
2021-10-22杨小雪王丹丹束长龙高继国耿丽丽
王 建,杨小雪,王丹丹,张 杰,束长龙,高继国,耿丽丽*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193;3.华侨大学化工学院,厦门 361021)
草地贪夜蛾Spodoptera frugiperda (J.E.Smith),属鳞翅目Lepidoptera夜蛾科Noctuidae灰翅夜蛾属Spodoptera,原产于美洲热带和亚热带地区,是一种重大迁飞性害虫[1]。草地贪夜蛾具有繁殖强、迁飞快、寄主广等特点[2],其寄主植物包括禾本科、豆科、菊科等76科350种植物[3]。草地贪夜蛾幼虫嗜食玉米叶片和果穗,一只雌成虫最高可产2000粒卵,可直接为害一亩地的玉米[4]。2016年以来,草地贪夜蛾先后入侵非洲、印度、东南亚等国家和地区,并对玉米等主要粮食作物造成严重危害[5,6]。2019年1月草地贪夜蛾入侵我国并迅速蔓延,目前除新疆、青海和东北地区外均有报道,为害1300万公顷的玉米[7],已完成入侵和定殖过程,截至2020年8月,草地贪夜蛾在我国呈持续暴发状态[8]。
为了应对草地贪夜蛾对全球粮食安全的威胁,我国农业农村部于2019年6月21日组织制定了《全国草地贪夜蛾防控方案》,要求坚决遏制草地贪夜蛾暴发危害,保障粮食及农业生产安全。化学农药是防治草地贪夜蛾的主要手段[9],为了实现绿色防控,农业农村部办公厅发布的《草地贪夜蛾应急防治用药推荐名单》中也将苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)等产品作为推荐用药[10],但当时并无防治草地贪夜蛾的Bt产品登记。
苏云金芽胞杆菌是革兰氏阳性细菌,属于蜡样芽胞杆菌族芽胞杆菌科[11]。Bt形成芽胞的同时,在菌体内一端或两端产生晶体蛋白,基于这类杀虫蛋白对鳞翅目、鞘翅目等多种害虫具有较好的杀虫活性且对环境友好的特点,使其被广泛应用于农业和卫生害虫防治,减少了化学杀虫剂用量[12-14]。美洲地区防控草地贪夜蛾在经历了早期的化学防治后,20世纪末进入主要依靠Bt等微生物农药以及转Bt作物的绿色防控时期[15,16]。美国EPA已登记有DiPel®DF[17]等Bt产品用于防治玉米草地贪夜蛾。研究发现对草地贪夜蛾有活性的Bt杀虫基因主要有vip3Aa、cry1Ab、cry1Ea[18]、cry1F[19]、cry1I[20]等,其中Vip3Aa类蛋白尽管氨基酸序列之间相差很小,但对草地贪夜蛾的活性相差较大[21],且Vip3Aa与Cry1Ab、Cry1Ia蛋白对草地贪夜蛾有协同增效作用[18,22]。转Bt基因玉米防控草地贪夜蛾主要采取叠加/聚合多个杀虫基因的策略[23],如叠加多基因抗虫玉米“MON89034”(表达Cry1A.105+Cry2Ab2)和国内研发的Bt-(Cry1Ab+Vip3Aa)玉米对草地贪夜蛾具有良好的控制效果[24,25];而表达Vip3Aa20杀虫蛋白的Bt玉米是目前唯一没有在田间产生对草地贪夜蛾抗性的产品[26]。
在对菌株资源库中的活性菌株进行筛选前,对于可能存在的冗余菌株,首先进行多样性分析:利用核酸片段分析系统得到菌株PCR-RFLP图谱,结合生物信息学技术对电泳图谱进行数据化、相似性计算以及系统发育树构建,以此分析比较菌株杀虫基因之间的差异,从而去除冗余菌株,获得可用于进一步资源挖掘的菌株。Wang等[27]利用此方法从42株对大黑鳃金龟Holotrichia oblita幼虫有活性的Bt菌株中去除了28个重复菌株,活性菌株分属于14个不同的类型。
本研究从实验室筛选获得的对小地老虎高效的菌株资源中,通过室内毒力测定,筛选对草地贪夜蛾幼虫高毒力的Bt菌株,为开发对草地贪夜蛾高效的Bt杀虫剂新产品奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试菌株为本实验室前期分离、筛选的对斜纹夜蛾、小地老虎具有高毒力的 Bt野生菌株363株;对照菌株KN11由武汉科诺生物科技有限公司提供,其可湿性粉剂商品名称为“无敌小子”;Bt菌株HD73-为无晶体突变株。
1.1.2 培养基 LB液体培养基:Trytone 1%,Yeast extract 0.5%,NaCl 1%,pH 7.0;LB固体培养基:在液体培养基中加入终浓度为1.3%的琼脂粉;1/2 LB固体培养基:Trytone 0.5%,Yeast extract 0.25%,NaCl 0.5%,pH 7.0,1.3%琼脂粉。上述培养基均由纯水配置,121 ℃/20 min灭菌。
1.1.3 生化试剂 引物由北京六合华大基因科技有限公司合成;限制性内切酶、DNA Marker购自Takara公司;T4DNA Ligase购自北京全式金生物技术有限公司;质粒提取试剂盒、酶切纯化回收试剂盒购自美国Axygen公司;其它试剂均购自北京博迈德生物技术有限公司。
1.1.4 供试虫源及饲养条件 供试草地贪夜蛾由河北省沧州市农林科学院植物保护研究所提供,人工饲料由中国农业科学院植物保护研究所棉花害虫组提供,饲养温度为(27±1)℃,RH(65±5)%,光周期16L:8D,选取初孵幼虫作为供试昆虫。
1.2 Bt菌株分离鉴定
将菌株划线接种于LB固体培养基中,30 ℃培养12 h,挑取单菌落接种于LB液体培养基过夜活化。取活化的Bt菌液接种于1/2 LB固体培养基中,30 ℃培养2~3 d,挑取适量菌体涂布于滴有超纯水的载玻片上,烘干后用碱性石炭酸复红染液染色约3 min,油镜下观察Bt芽胞及晶体形态[28]。
1.3 Bt菌株多样性分析
菌株资源库中可能存在重复菌株,因此,在进行菌株杀虫活性筛选前有必要对菌株进行多样性分析。
1.3.1 PCR-RFLP Bt菌株按照Song等[29]的方法进行基因组DNA制备。将下表中的4对引物(表1)等体积混匀后作为PCR扩增引物。

表1 菌株多样性分析引物序列[30]Table 1 Primers sequences used for diversity analysis
PCR 反应体系(20 μL):基因组 DNA 2.0 μL、2×Taq mix 15 μL、引物 1.0 μL、超纯水补至 20 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性1 min,40 ℃退火1 min,72 ℃延伸1.5 min,10次循环;94 ℃变性1 min,40 ℃退火1 min,72 ℃延伸1.5 min,30次循环;72 ℃延伸5 min。
酶切体系(40 μL):PCR产物15 μL,10×H Buffer 4.0 μL,Hinf I限制性内切酶1.0 μL,超纯水补至40 μL,37 ℃恒温孵育 2 h。
1.3.2 PCR-RFLP图谱分析 PCR-RFLP图谱分析、图谱数字化、相似性分析及系统发育树构建参照单月明[30]的方法进行:利用Fragment AnalyzerTM全自动毛细管电泳系统对酶切产物的片段多态性进行分析,将系统分析得到的图谱信息采用PERL脚本转换成用于可直观显示菌株间相似关系的系统发育树文件,使用MEGA 5软件构建反映菌株进化关系的UPGMA tree,利用系统发育树定位具有相似PCR-RFLP图谱的菌株从而去除重复菌株。
1.4 Bt胞晶混合物制备及SDS-PAGE分析
取400 μL活化的Bt菌液均匀地涂布于1/2 LB固体培养基上,在30 ℃恒温条件下培养至光学显微镜观察有50%以上的晶体释放时停止培养,将全部菌体刮到50 mL离心管中,加适量预冷的超纯水充分洗涤两次,每次8000 r/min离心10 min,弃上清,沉淀加入4 mL预冷的50 mmol/L Na2CO3(pH 10.0)溶解,反复吹打混匀胞晶混合物。
取上述胞晶混合物,加入1/5体积预冷的0.5 mol/L NaOH溶液,室温反应5 min,随后加入5×上样缓冲液混匀,沸水浴5 min,12000 r/min离心3 min,取上清液进行SDS-PAGE电泳分析,电泳方法参照萨姆布鲁克和拉塞尔[31]的方法进行。电泳结束后取出凝胶,进行脱色、染色及扫描图谱。使用Image J 2x软件进行蛋白定量:首先,打开要分析的蛋白图谱,用矩形选框工具逐一为泳道编号,完成之后,通过analyze/gels/plot lanes绘制条带的峰图。然后,在灰度曲线上将目的波峰与基线围成封闭区域,随后用魔棒工具(Wand tool)点击每个峰的中间区域即可完成对每个峰面积的计算,计算的结果在Result窗口显示,可通过File导出为xls文件,最后,通过对待测样品和已知浓度的BSA灰度值比较计算蛋白浓度。
1.5 草地贪夜蛾幼虫室内生物活性测定
称取15 g草地贪夜蛾人工饲料置于灭菌培养皿中,加入3 mL待测样品溶液,充分搅拌均匀,于室温放置;待饲料中多余的水分蒸发后,将全部饲料均匀的分装于一个 24孔板中;随后用毛笔挑取拉丝、个体活跃且大小一致的初孵幼虫接于 24孔板内,每孔一头,接好幼虫后用内置吹塑纸板的顶盖盖好,再用橡皮筋固定扎紧,防止幼虫逃逸;以添加Na2CO3溶液和蒸馏水的饲料为空白对照。将24孔板置于温度(27±1)℃,RH(65±5)%,光周期16L:8D的养虫室中。每处理3次重复。每天检查光照、湿度、温度以及饲料是否霉变,是否有水蒸气的凝结。7 d后分别调查死、活虫数,计算平均死亡率、校正死亡率,使用Polo-Plus软件计算致死中浓度。
1.6 cry1Ea基因克隆及其表达产物的活性分析
1.6.1 cry1Ea重组表达载体构建 根据B14-D2菌株已有的基因组草图聚类分析后,得到cry1Ea基因序列,利用https://web.expasy.org/protparam/网站预测Cry1Ea蛋白等电点及分子量。根据B14-D2菌株cry1Ea基因序列和 Bt-E.coli 穿梭表达载体pSTK[32]酶切位点设计引物(表2):
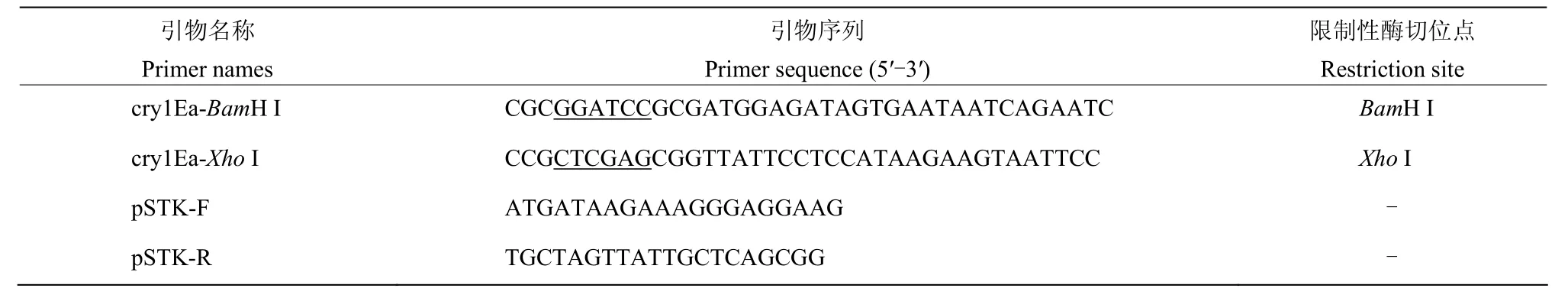
表2 cry1Ea基因克隆所用引物序列Table 2 Primers sequences used for cry1Ea gene clone
cry1Ea 基因 PCR 反应体系:基因组 DNA 1.0 μL、2×PrimeSTARTMHS(Premix)25 μL、引物各 1.0 μL、超纯水补至50 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,30次循环;72 ℃延伸5 min。
回收扩增得到的3.5 kb左右的DNA片段,将得到的cry1Ea基因及pSTK载体分别用限制性内切酶BamH Ⅰ与Xho Ⅰ进行双酶切,回收酶切产物,T4连接酶4 ℃连接过夜。连接产物转化入大肠杆菌DH5α感受态细胞中,用含有卡那霉素的LB平板筛选阳性转化子,经PCR鉴定、酶切分析和基因测序之后筛选正确的重组质粒 pSTK-1E。大肠杆菌质粒提取、DNA酶切、片段回收以及大肠杆菌连接转化过程详见Sambrook等[33],重组质粒使用引物pSTK-F/ pSTK-R进行鉴定,基因测序由北京六合华大基因科技有限公司完成。
1.6.2 Cry1Ea蛋白表达与活性测定 将含有cry1Ea基因的重组质粒pSTK-1E转入大肠杆菌ET中,并提取质粒,然后通过电击转化的方法将该质粒转入Bt无晶体突变株HD73-中,最终获得重组菌株HD73_1E,提取Cry1Ea蛋白进行草地贪夜蛾幼虫室内毒力测定。Bt转化过程详见Lereclus等[34]的方法,Cry1Ea蛋白在Bt中的表达与提取参见Zhou等[35]的方法,草地贪夜蛾室内生物活性测定方法见1.5。
2 结果与分析
2.1 Bt菌株晶体形态观察
光学显微镜镜检结果显示有305株Bt菌株可观察到晶体,但晶体种类有所不同,大部分菌株含有菱形晶体,小部分菌株含有方形晶体,图1展示了部分Bt菌株的显微镜检结果。
2.2 Bt菌株PCR-RFLP图谱分析
以本实验室设计的通用Bt菌株鉴定引物扩增供试菌株,图谱呈现多样性(图2A)。PCR产物经Hinf I限制性内切酶消化,结果同样呈现多样性,不同菌株PCR产物酶切后产生不同大小、不同浓度的条带,部分菌株具有相似条带(图 2B),说明这些 Bt菌株中含有不同的杀虫基因及组合,同时也存在重复菌株。
图2 不同Bt菌株PCR扩增结果及RFLP鉴定分析结果(部分样品)Fig.2 PCR amplificationand RFLP identification analysis of different Bt strains (partial samples)
对酶切产物的片段多态性进行分析(图 3A),与传统的琼脂糖凝胶电泳相比,全自动毛细管电泳仪分辨率更高,有效的分离35~1500 bp的片段,大部分样品具有不同的酶切图谱,显示出菌株的多样性,同时观察到部分菌株具有相似的图谱。利用系统发育树定位具有相似PCR-RFLP图谱的菌株(图3B),去除重复菌株133株,占总数的43.61%,得到172株不同类型的Bt菌株作为代表菌株进行后续生物活性测定。
2.3 室内生物活性测定结果
2.3.1 初筛 172株候选Bt菌株饲毒7 d后,47株菌株校正死亡率>80%,占总菌株数的27.33%;27株菌株校正死亡率>90%,占总菌株数的15.70%。其中PS3-C3-2等6株菌株校正死亡率达100%(表3)。
2.3.2 复筛 对PS3-C3-2等6株高毒力菌株进一步复筛,结果显示菌株B14-D2杀虫活性最高,LC50为0.155 μg/g,与对照菌株KN11毒力相当,而菌株PS3-C3-2、C3-E11也表现出很高的毒力(表4)。
2.4 高毒力Bt菌株杀虫蛋白分析
对草地贪夜蛾有活性的172株Bt菌株胞晶混合物SDS-PAGE分析结果显示,共有82株菌表达分子量约为130 kDa的蛋白,具有典型Bt杀虫晶体蛋白的特征,少部分表达分子量约为60 kDa的蛋白。高毒力菌株B14-D2表达约130 kDa和80 kDa大小蛋白条带(图4)。质谱鉴定表明,菌株B14-D2主要含有Cry1E-like、Vip3Aa蛋白(表5)。
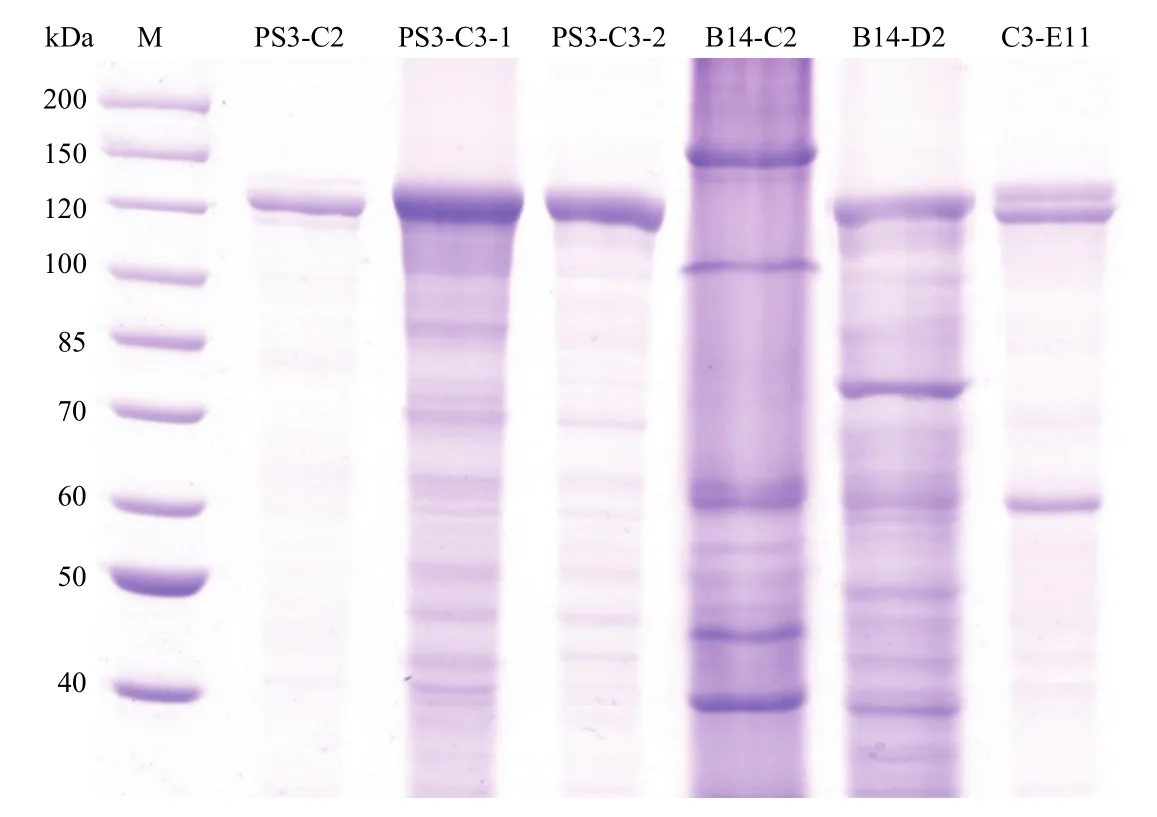
图4 对草地贪夜蛾高毒力Bt菌株杀虫晶体蛋白SDS-PAGE分析结果Fig.4 SDS-PAGE analysis of insecticidal crystal protein for Bt strains with high toxicity against S.frugiperda
2.5 cry1Ea基因表达及活性分析
测序结果表明,本研究发现的cry1Ea-like与cry1Ea3基因(GenBank号:AAA22345)碱基相似性为100%,其编码的蛋白等电点为5.01,蛋白的分子量为133.3 kDa。随后构建了含有cry1Ea3基因的重组质粒pSTK-1E,并导入无晶体突变株HD73-中。对重组菌株HD73_1E进行显微镜观察(图5A),观察到均为菱形晶体,这说明Cry1Ea3蛋白形成的蛋白晶体为菱形。重组菌株HD73_1E胞晶混合物SDS-PAGE分析结果显示:Cry1Ea3在Bt_HD73-突变株中可以表达约133 kDa的蛋白(图5B),符合预期大小,这说明Cry1Ea3蛋白在HD73-无晶体突变株中成功表达。同时测得Cry1Ea3蛋白对草地贪夜蛾初孵幼虫LC50为 1.789 μg/g(95%置信区间:1.438~2.206 μg/g)。

图5 HD73_1E菌株显微形态观察及胞晶混合物SDS-PAGE分析结果Fig.5 HD73_1E strain morphology observation and SDS-PAGE analysis of cell crystal mixture
3 讨论
自 2016年以来,由于草地贪夜蛾在全球大部分热带和亚热带地区的传播及其对农业生产造成的严重危害,引起国际社会的广泛关注。草地贪夜蛾入侵我国后,曾一度面临无生物农药可用的窘境,在农业农村部农药检定所的大力支持下,今年 10月武汉科诺生物科技股份有限公司和中国农业科学院植物保护研究所共同研发的Bt-KN11可湿性粉剂(登记证号为PD20084969)获批扩作登记,新增玉米草地贪夜蛾等作为防治对象[36]。此外,由中国农业科学院植物保护研究所研发登记的基因工程菌G033A可湿性粉剂(商品名称“禁卫军”)现已完成一年八地田间试验,提交了扩作申请。同时,为实现草地贪夜蛾可持续、绿色防控,亟需挖掘更多具有不同基因型的Bt菌株资源,开发高效稳定的Bt新产品。
本研究建立了基于菌株去冗余和大规模生测系统相结合的高效菌株筛选体系,从实验室保藏的363株野生菌株库中,筛选获得27株对草地贪夜蛾初孵幼虫具有较好活性的菌株。传统的活性菌株筛选一般采用对分离的大量 Bt菌株进行生测的方法,如 Monnerat等[37]通过饲料表面涂药法(Diet overlay method)从1400株Bt菌株中筛选得到对草地贪夜蛾具有高毒力的Bt菌株S1905(2龄幼虫,LC50为18 ng/cm2)。本研究在对菌株进行大规模活性筛选前,利用单月明[30]建立的基于核酸片段分析系统获得的PCR-RFLP图谱构建系统发育树的方法,分析了菌株多样性,去除了冗余菌株,提高了筛选效率,这种高效技术的引入,有效剔除重复的菌株,从而极大地减少了前期生测工作量,提高了准确率。刘华梅等[38]从对夜蛾科害虫高毒力的6株Bt菌株中筛选出KN50、KN11、KNR8这三株高毒力Bt菌株,且在田间试验中取得很好的防治效果,分析发现其均含有cry1Ac、cry1Ia、cry2Ab、vip3Aa基因。本研究中高毒力菌株B14-D2室内生测活性与KN11相当,但含有的杀虫基因不一样,因而具有良好的应用前景。菌株B14-D2中含有cry1Ea3基因,目前已发现Cry1Ea类蛋白对家蚕Bombyx mori、甜菜夜蛾Spodoptera exigua (Hübner)、海灰翅夜蛾Spodoptera littoralis、烟草天蛾Manduca sexta (Linnaeus)等多种鳞翅目害虫具有杀虫活性[39,40]。Figueiredo等[18]采用饲料表面涂药法测定的Cry1Ea1蛋白的LC50为3.07 ng/cm2,由于草地贪夜蛾幼虫取食存在钻蛀现象,本研究采用饲料混毒法(Diet incorporation method)[41]测得Cry1Ea3蛋白的 LC50为1.789 μg/g更为准确。而该蛋白活性显著低于其来源菌株B14-D2的活性(LC50为0.155 μg/g),基因组草图的结果显示该菌株除cry1Ea3基因,还含有cry2Ab、vip3Aa和vip4基因(数据未发表),菌株的高毒力可能来自某个蛋白的杀虫活性或者是多个蛋白的协同增效作用,下一步我们将完成该菌株的全基因组测序,并明确其高毒力原因。李国平等[42]测定了入侵我国云南的瑞丽草地贪夜蛾种群对不同Bt蛋白的敏感性,结果显示Bt蛋白对草地贪夜蛾致死顺序为Vip3A>Cry1Ab>Cry1F>Cry2Ab>Cry1Ac,表明该入侵种群对此5种Bt蛋白尚未产生抗性,而Vip蛋白与其他Cry类蛋白无交互抗性[43]。目前尚无 Cry1Ea蛋白与已经商业化的Cry1、Cry2类蛋白交互抗性的报道,我们将在今后的研究中明确菌株B14-D2中Cry1Ea、Vip3Aa等蛋白与已商业化应用的Bt蛋白有无交互抗性,为转基因作物的开发提供基因储备。此外,为了加速B14-D2菌株其及含有杀虫基因的应用,应对环境和食用安全性进行评价:明确其对家蚕等非靶标经济昆虫的影响,并分析杀虫蛋白的稳定性和过敏原位点等。
本研究在去除冗余菌株的基础上,通过室内毒力测定,筛选获得对草地贪夜蛾幼虫高毒力的Bt菌株,并初步分析了Cry1Ea3蛋白的杀虫活性,为新的Bt产品的开发提供了丰富的菌株资源储备。下一步工作将优化发酵条件实现对高毒力菌株的生产,并进入农药产品登记流程;明确 Cry1Ea蛋白杀虫谱,测定对非靶标有益生物的活性;分析Cry1Ea蛋白与目前商业化转基因作物中应用的Cry1Ab蛋白等的交互抗性,同时通过全基因组测序进一步挖掘高毒力菌株中的新基因。
