四川省套作玉米茎腐病致病镰孢菌的分离与鉴定
2018-11-09周欢欢王对平雍太文龚国淑杨文钰常小丽
周欢欢,严 雳,王对平,雍太文,2,龚国淑,尚 静,2,杨文钰,2,常小丽,2*
(1.四川农业大学农学院,成都 611130;2.四川省作物带状复合种植工程技术研究中心,成都 611130)
玉米茎腐病(maize stalk rot)是世界玉米生产中普遍发生的一种真菌病害[1-2]。自20世纪70年代在我国首次报道后,相继在黑龙江、吉林、河北、河南、陕西、广西等20多个省区发病,该病可以引起玉米早衰、产量降低,田间一般发病率为10%~20%,严重地块高达70%以上,甚至植株完全枯死[3]。据国内外研究报道[4-6],镰孢菌是引起玉米茎腐病的主要致病菌之一,其中轮枝镰孢菌F.verticillioides、层生镰孢菌F.proliferatum、禾谷镰孢菌F.graminearum、胶孢镰孢菌F.subglutinans、F.temperatum等,不仅可危害玉米产量和品质,而且其产生的毒素对人、畜健康造成危害[7-10]。受气候条件、耕作栽培方式(保护性耕作、秸秆还田等)及玉米品种更替的影响,我国不同地区玉米茎腐病的优势致病菌存在差异[11]。
近年来,杨文钰等[12]在传统间套作基础上,系统研究了作物品种选配、田间优化配置,形成了玉米-大豆带状复合种植的核心与配套技术,大大提高土地生产率与光肥利用率,改善农田生态系统,降低病虫草害损失率,与净作玉米相比,在玉米不减产的情况下多收一季大豆,实现了经济、生态与农业可持续发展相统一[13-14],目前在我国西南、西北、黄淮海等地区推广面积逐年增加。但关于玉米-大豆带状套作下玉米茎腐病的发生情况及病原菌种类尚不清楚。本研究对四川省玉米大豆带状套作4个主要栽培县(市)的玉米茎腐病进行调查及取样,采用形态特征和分子鉴定对病原菌进行鉴定和致病性检测,以便掌握该模式下玉米茎腐病的发生情况及病原菌类群,为玉米大豆带状套作下玉米茎腐病的防治提供参考。
1 材料和方法
1.1 供试材料
1.1.1 供试菌株
2016—2017年间分别对四川省雅安市、成都市崇州区、自贡市荣县和眉山市仁寿县4个市(县)的玉米-大豆带状套作栽培田中玉米茎腐病病样进行采集。选取病状典型,且茎部未完全腐烂的病样本112份,进行室内组织分离、纯化及鉴定。
1.1.2 供试植物
室内病原菌致病性检测采用玉米品种登海605。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA)∶200 g马铃薯,20 g琼脂,20 g葡萄糖,用水定容至1 L。羧甲基纤维素钠培养基(CMS)∶羧甲基纤维素钠7.5 g,酵母膏0.5 g,磷酸氢二钾0.5 g和硫酸镁0.25 g,用水定容至1 L。清水琼脂培养基(WA)∶10 g琼脂,10 g葡萄糖,用水定容至1 L。以上培养基在121℃高压灭菌30 min,冷却待用。
1.2 试验方法
1.2.1 田间病害调查
2016—2017年间分别对四川省雅安市、成都市崇州区、自贡市荣县和眉山市仁寿县4个市(县)的玉米-大豆带状套作栽培田进行调查及取样。其中,玉米-大豆带状套作栽培具体试验设计为:玉米于3月底4月初采用宽窄行种植,窄行40 cm,宽行160 cm,株距10 cm;大豆于6月上旬播种于玉米宽行,种植2行,行距40 cm,株距20 cm。玉米底肥穴施尿素330 kg/hm2、过磷酸钙750 kg/hm2和氯化钾 150 kg/hm2,在大喇叭口期追施尿素330 kg/hm2;大豆底肥施尿素65 kg/hm2、过磷酸钙 420 kg/hm2、氯化钾 70 kg/hm2。其他按照常规进行管理。其中,玉米品种为登海605,大豆品种为南豆12。
于玉米乳熟期分别在4个市(县)选择3~5个主栽区,采用随机抽样调查玉米茎腐病的发病情况,参照李春霞等[15]病情级别标准,计算发病率及病情指数,公式如下:

1.2.2 病原菌分离与纯化
剪取玉米茎腐病病样的茎部组织约0.5 cm×0.5 cm,依次用75%乙醇消毒30 s,5%NaClO消毒45 s,无菌水冲洗3次,在灭菌滤纸充分晾干后,移至9 cm的PDA平板上,每皿4个,置于25℃下培养3~5 d后观察。挑取镰孢菌菌落外缘菌丝或者单个孢子法,获得镰孢菌纯化菌株。
1.2.3 病原菌鉴定
形态学鉴定:采用J.F.Leslie和B.A.Summerell的镰孢菌鉴定方法[16],根据菌落形态、质地、菌丝是否有隔膜、分生孢子形态、大小对分离菌株进行鉴定。
分子鉴定:将获得的单孢菌株转移至PDA平板上,25℃培养7 d。参照何宛芹等[17]的CTAB法提取病原菌 DNA。采用 ITS1(5’-tccgtaggtgaacctgcgg-3’)和 ITS4(5’-gctgcgttcttcatcgatgc-3’)[18]对各镰孢菌rDNA-ITS基因的区段进行PCR扩增。反应体系:DNA 模板 1 μL、上下游引物各 1 μL、2×PCR Master Mix12.5 μL、ddH2O 补至 25 μL。PCR 反应程序:94℃预变性 5 min;94℃变性 45 s;58℃退火 45 s;72℃延伸2 min,35个循环;72℃延伸10 min;4℃保存。采用 EF1-728F(5’-tccgtaggtgaacctgcgg-3’)和 EF1-986R(5’-gctgcgttcttcatcgatgc-3’)[19]对延长因子基因序列PCR扩增。反应体系:DNA模板1 μL、上下游引物各 1 μL、2×PCR Master Mix 12.5 μL、ddH2O 补至 25 μL。PCR 反应程序:95℃预变性 3 min,95℃变性 20 s,55 ℃复性 30 s,72 ℃延伸 40 s,35 个循环,72℃延伸10 min,4℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测后送往上海生物工程有限公司测序。测序结果与NCBI基因库中已登录的镰孢菌序列进行Blast n比对,并将待测菌株序列和NCBI基因库中与之相似度较高的序列一起导入Clustal X软件序列比对。利用MEGA 6.0软件采用MP(Maximum-Parsimony)最大简约法构建系统发育树,自检次数为1 000次。
1.2.4 致病性测定
选取7个镰孢菌种的代表菌株各3株接种于PDA培养基上活化,置于25℃黑暗条件下培养3 d,待菌落长至培养皿边缘时,打菌饼(直径为5 mm)用于接种。玉米种子经75%乙醇消毒3 min,无菌水重新干净后,置于珍珠岩中,25℃在光照培养箱中培养。待玉米幼苗长至15 cm高时,参照戴浩[20]接种方法及评级标准,具体操作为:在玉米幼苗基部轻刺3个伤口,贴上菌饼,用保鲜膜缠绕,置于25℃光照培养箱内进行保湿培养,3 d后观察发病情况,每个代表菌株接种20株玉米幼苗。病情级别分4级,分别为:0级,健康,整株生长正常,未发病;1级,轻度发病,茎基部接种部位有轻微变色但未见明显病斑;3级,中度发病,茎基部变色明显,病斑明显拓展;5级,重度发病,病斑明显,茎基部几乎变褐,病斑环绕整个植株,有些茎基部完全腐烂,植株死亡。
1.3 数据处理分析
田间病害调查、菌株分离结果及致病性检测所得数据,均采用SPSS17.0统计软件进行统计分析。检验方法为邓肯氏多重比较法,分析后各样本平均数间是否有显著差异。
2 结果与分析
2.1 田间调查结果
2016—2017年间,通过对四川省4个县市玉米大豆套作栽培下玉米茎腐病情况调查。结果显示玉米茎腐病在各地均有发生,但发病率和病情指数在不同地区存在差异。自贡市荣县的玉米茎腐病田间发病率均高于其他3个地区,发病率为11.52%,病情指数为13.49;雅安和崇州的玉米茎腐病田间表现发病率均较低,病情指数差异不显著;仁寿地区茎腐病相对其他地区发病率和病情指数最低(见表1)。总体来看,四川玉米大豆套作栽培下,玉米茎腐病发生较轻,平均发病率为8.45%,平均病情指数为11.16。
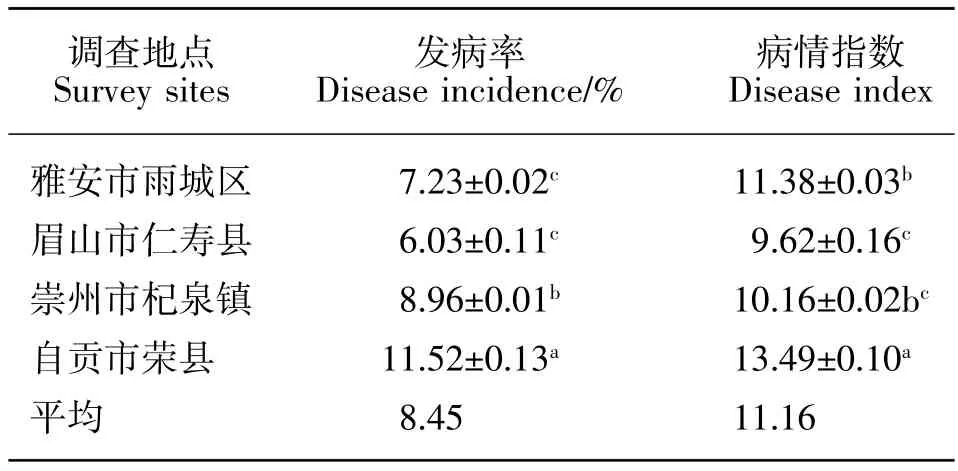
表1 四川省玉米大豆套作下玉米茎腐病发病情况Table 1 Occurrence status of maize stalk rot
2.2 病原菌分离及鉴定结果
2.2.1 玉米茎腐病镰孢菌鉴定结果
从供试103株玉米茎腐病分离菌株中获得71株镰孢菌,根据菌落形态和分生孢子形态(见图1),对菌株的基因区段进行PCR扩增及序列分析,选取部分镰孢菌序列与下载参照菌株序列构建ITS-EF多基因系统发育树,并以Bipolaris oryzae作外群,采用MEGA 6.0软件构建系统发育树,如图2所示,供试菌株可分为2个大分支7个组,第1组Y9、Y12、Z1和C10与2个禾谷镰孢菌F.graminearum参考菌株聚在一起,相似性高达100%;第2组中Y1、C9、Z8和Z10与木贼镰孢菌F.equiseti参考菌株聚在同一分支;第3组中,Y16、C5和S8与轮枝镰孢菌F.verticillioides参考菌株相似性为54%;第4组中,C1、S3、Y5和S17与尖孢镰孢菌F.oxysporum参考菌株以相似性70%聚在一起;第5组中,Y11、C2和S5等7个菌株与3个腐皮镰孢菌F.solani参考菌株的序列相似性高达76%;第6组中,Y17、S1和Z53个菌株与藤仓镰孢菌F.fujikuroi参考菌株相似度为57%;最后一分支中,Y4、Y8和S2等16个菌株与层生镰孢菌F.proliferatum聚在一起,相似性达87%。结合形态特征和分子鉴定,可将分离获得的镰孢菌分为7种,包括层生镰孢菌、腐皮镰孢菌、轮枝镰孢菌、禾谷镰孢菌、尖孢镰孢菌、藤仓镰孢菌和木贼镰孢菌。

图1 玉米茎腐病镰孢菌菌落和分生孢子形态特征图Figure 1 Morphologies of colonies and microconidia of Fusarium isolates associated with maize stalk rot
2.2.2 套作玉米茎腐病各镰孢菌分离频率
在分离自玉米茎腐病的103株菌株中,共鉴定出7种镰孢菌(见表2)。其中,层生镰孢菌分离频率最高,为35.21%;腐皮和轮枝镰孢菌次之,分离频率分别为16.9%和15.49%,禾谷镰孢菌较低,而尖孢镰孢菌、藤仓镰孢菌和木贼镰孢菌最低,均不足10%。就不同地区而言,层生镰孢菌的分离频率均最高,为各地区优势镰孢菌;仁寿地区无禾谷镰孢菌和木贼镰孢菌,其他种类镰孢菌均有分布;崇州地区无藤仓镰孢菌分布;荣县地区禾谷镰孢菌的分离频率在4个区域中最高,无尖孢镰孢菌分布。综合来看,四川玉米大豆套作栽培下,玉米茎腐病镰孢菌的优势类群为层生镰孢菌、轮枝镰孢菌、腐皮镰孢菌和禾谷镰孢菌。
2.3 致病性测定
选取玉米茎腐病7种镰孢菌代表菌株各3株,采用玉米幼苗刺伤接种法进行致病性检测,结果如图4所示,在刺伤接种第3天后,不同病菌的致病力差异较大:禾谷镰孢菌致病性最强,病斑变褐、凹陷、病斑扩展明显。发病率高达95%且病情指数大于3;层生镰孢菌和轮枝镰孢菌接种后玉米茎秆部位出现水渍状病斑、变褐色,并伴有腐烂症状且有大量菌丝产生,发病率分别为91.67%和78.33%,病情指数均在2~3之间;木贼镰孢菌和尖孢镰孢菌发病率分别为81.67%和66.67%,病情指数为1.58和1.2,两种镰孢菌可引起玉米茎部出现部分水渍状变色、病斑扩增不明显,有少许菌丝出现。藤仓镰孢菌和腐皮镰孢菌也可引起茎秆部位变色但病状不明显,发病率分别为65%和71.67%,病情指数最低。因此分离获得各镰孢菌中,以禾谷镰孢菌致病性最强,层生镰孢菌和轮枝镰孢菌次之,尖孢镰孢菌和木贼镰孢菌致病性较弱,藤仓镰孢菌和腐皮镰孢菌致病性最弱。
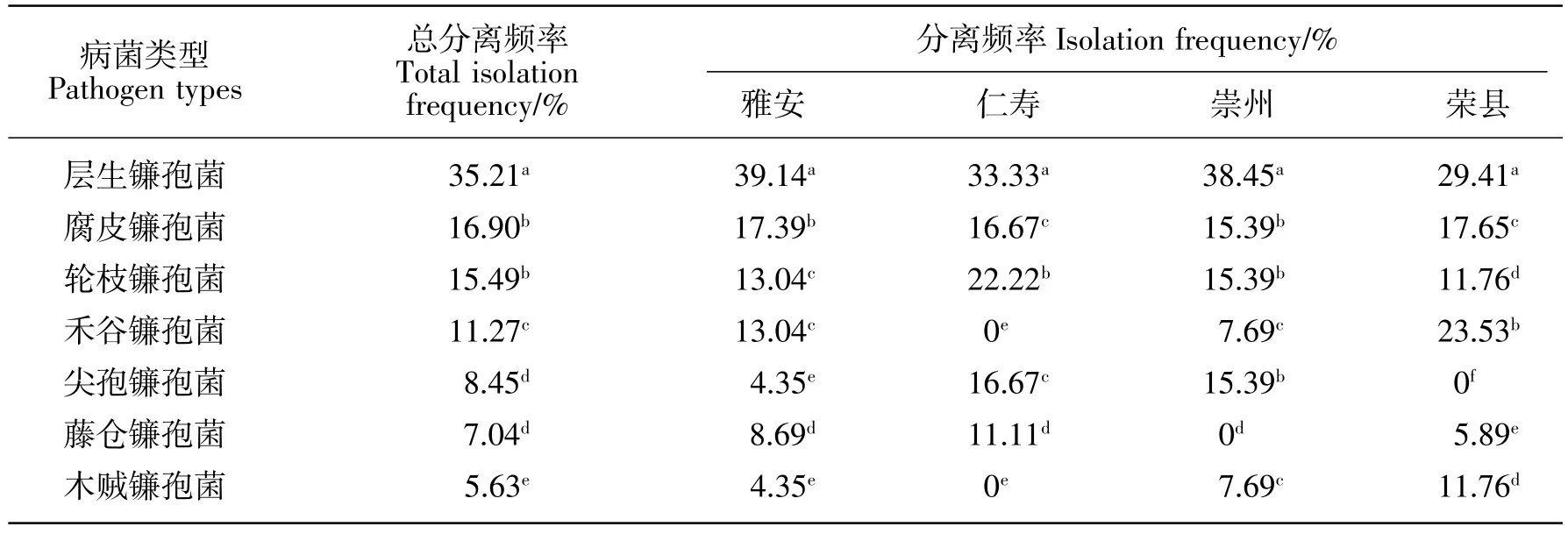
表2 四川省玉豆套作下玉米茎腐病镰孢菌的分离频率Table 2 Isolation frequency of Fusarium species associated with corn stalk rot
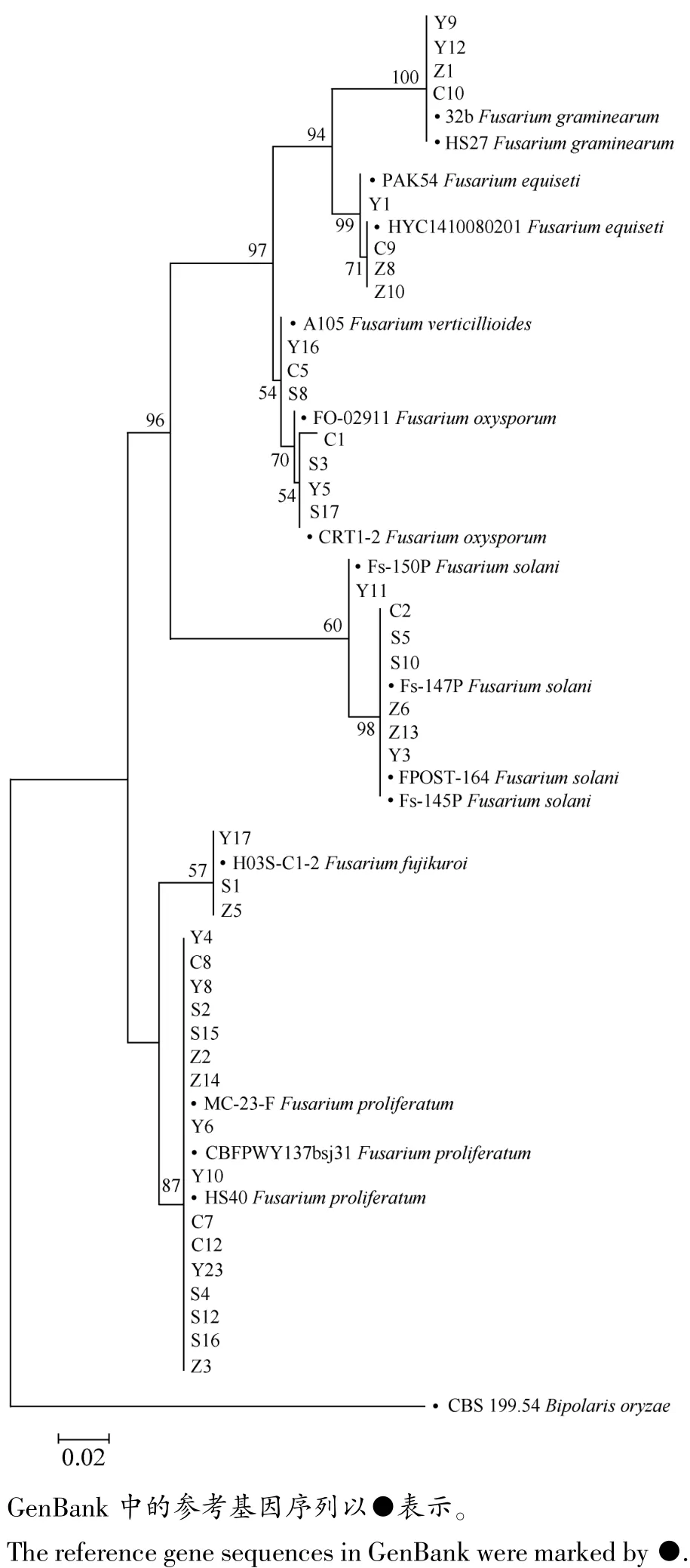
图2 玉米茎腐病rDNA ITS和EF1-α序列系统发育树Figure 2 Phylogenetic tree based on rDNA ITS and EF1-α fragments of Fusarium strains causing maize stalk rot
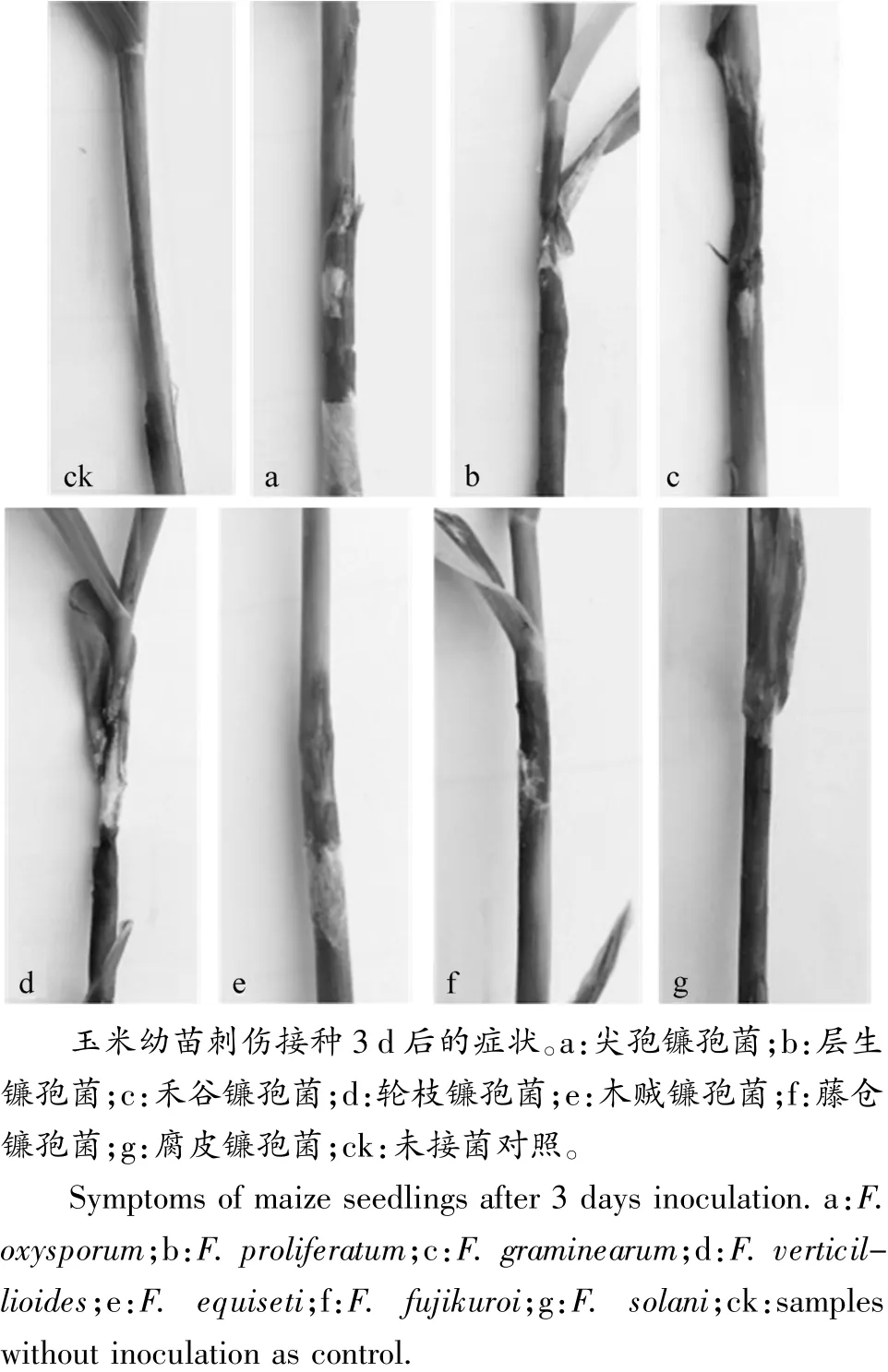
图3 镰孢菌接种引起的玉米发病症状Figure 3 Symptoms on maize seedlings inoculated with representative Fusarium isolates
3 讨论与结论
我国玉米茎腐病分布范围广,危害严重,轮枝镰孢菌和禾谷镰孢菌是我国玉米茎腐病的优势致病镰孢菌,但各地受不同因素影响,镰孢菌的种类及优势致病菌存在差异。本研究表明,四川玉米大豆套作栽培下玉米茎腐病镰孢菌的优势种为层生镰孢菌、轮枝镰孢菌和禾谷镰孢菌,但不同地区镰孢菌的种群结构及分布存在差异。
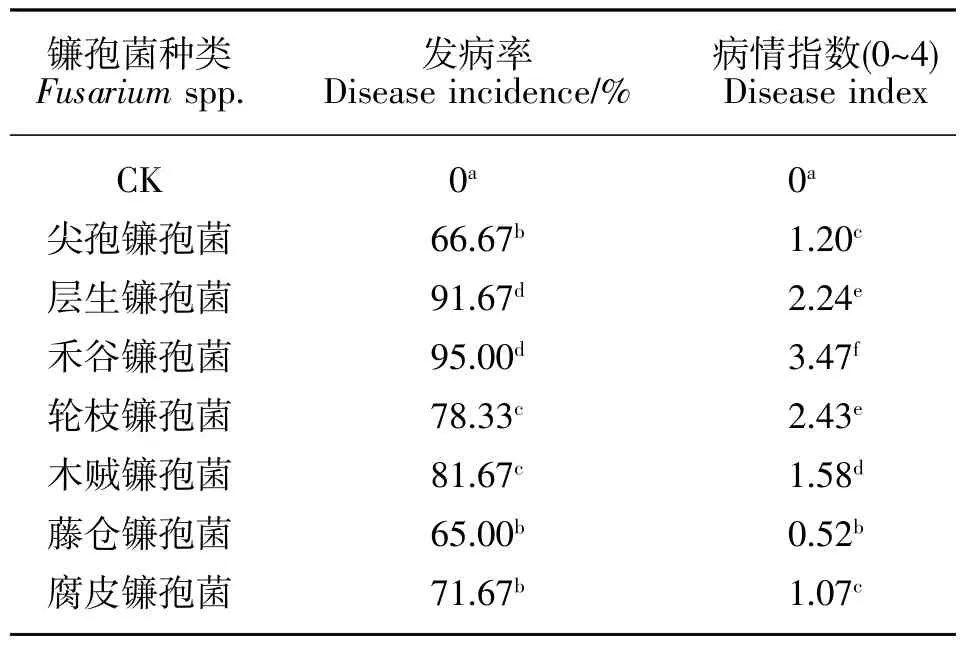
表3 镰孢菌代表菌株接种引起的玉米发病Table 3 Disease incidence and grade on maize seedlings inoculated with representative Fusarium isolates
晋齐鸣等[21]研究发现保护性免耕、少耕或秸秆还田等耕作方式,实行玉米宽窄行交替休闲耕作,可加重玉米茎腐病的发生。魏荐郦[22]于2013—2014年对四川省玉米茎腐病进行调查发现,平均发病率为17.18%;通过研究不同栽培模式对玉米茎腐病的影响发现,小麦-玉米套作田中玉米茎腐病的病情指数高于净作田,分别为17.38和13.32,秸秆还田处理后可加重两种栽培方式下玉米茎腐病的发生。本试验表明,四川玉米大豆带状套作栽培下玉米茎腐病平均发病率为8.45%,明显低于魏荐郦[22]在净作玉米和小麦-玉米套作田中的调查结果,表明玉米大豆带状套作不仅增产效果好,而且可有效地降低玉米茎腐病的发生。但总体来说,近年来四川玉米茎腐病发生情况不严重,可能与该地区多样化的玉米栽培方式有关。
在我国,玉米茎腐病的优势致病菌为禾谷镰孢菌复合群和轮枝镰孢菌[1,4,11]。Yu C.等[1]对我国东北地区玉米茎腐病的病原菌进行调查及鉴定发现,共分离获得9种镰孢菌,其中轮枝镰孢菌和禾谷镰孢菌为强致病菌株。袁红霞等[23]对河南省玉米茎腐病病原菌鉴定发现,禾谷镰孢菌分离频率和致病性最强,轮枝镰孢菌致病性较弱。何婧[24]通过对东北春玉米区、黄淮海夏玉米区以及云南、陕西等省部分地区的玉米茎腐病病原菌进行鉴定发现,轮枝镰孢菌为优势致病菌,其次为禾谷镰孢复合种。在四川省,魏荐郦[22]通过对净作和麦玉套作栽培下玉米茎腐病病原菌的鉴定结果表明,层生镰孢菌和木贼镰孢菌分离频率最高,为优势致病菌,轮枝镰孢菌是次优势致病菌,而禾谷镰孢菌和九州镰孢菌Fusarium kyushuense分离频率较低。与魏荐郦[22]分离的病原菌种类不完全相同,本试验从玉米大豆带状套作下共分离获得7种玉米茎腐病镰孢菌,除了层生镰孢菌、轮枝镰孢菌、禾谷镰孢菌、木贼镰孢菌,还分离获得了尖孢镰孢菌、腐皮镰孢菌和藤仓镰孢菌,但未分离到九州镰孢菌,这表明不同玉米栽培方式可能影响玉米茎腐病的镰孢菌类群。
此外,本研究中已分离鉴定的7种镰孢菌中,禾谷镰孢菌的致病性更强。众所周知,禾谷镰孢菌可危害小麦、玉米、大麦等作物,导致穗腐病和茎腐病,也可引起大豆茎基腐和根腐病。在四川、重庆等西南地区,除净作,玉米常与小麦轮作或者与大豆套作,研究发现来源于小麦、玉米和大麦病样的禾谷镰孢菌对玉米的致病性差异并不显著[26-27],小麦玉米轮作有利于田间病残体及土壤中禾谷镰孢菌的积累,从而加重穗腐病和茎腐病的发生[11,25]。轮枝镰孢菌作为玉米茎腐病的重要致病菌,可在田间病残体、土壤表面或土壤内存活,但对大豆的影响并不大。D.Kendra[28]通过RT-PCR对玉米大豆轮作田中健康大豆植株进行检测发现,大豆体内虽可检测到轮枝镰孢菌,却未影响大豆生长,这就解释了玉米-大豆带状套作下轮枝镰孢菌的分离频率较高,但对玉米的致病性不及禾谷镰孢菌。
综上所述,四川省玉米大豆套作系统下,镰孢菌所引起的玉米茎腐病田间发病率不高,镰孢菌群体与国内其他省份存在差异,但禾谷镰孢菌仍为强致病菌,对于该地区玉米茎腐病的发生具有潜在威胁。同时,玉米大豆带状套作栽培可降低玉米茎腐病的发生,减少化学农药使用量,具有良好的经济效益和生态效益,为本地区玉米生产提供了有价值的参考。
