光催化甲醇氧化脱氢制甲酸甲酯反应研究
2021-10-10唐思扬刘长军岳海荣
王 彬,钟 山,唐思扬,马 奎,刘长军,岳海荣,梁 斌
四川大学化学工程学院,四川 成都 610065
甲酸甲酯是重要的C1 化工产品中间体[1]。目前,甲酸甲酯生产基本上是甲醇转化生产工艺[2-4]。对于甲酸甲酯生产的热催化体系,液相甲醇羰基化工艺需要在高压条件(约4.0 MPa)下进行[2,4],而且甲醇钠催化剂对水分极敏感,需要把原料(CH3OH,CO)纯化使含水量降到很低水平(mg/L 级),这些缺点限制了甲醇羰基化制备甲酸甲酯的大规模工业化生产。甲醇直接脱氢反应工艺,由于热力学平衡的限制,反应的最终转化率很低[5-7]。甲醇氧化脱氢制取甲酸甲酯反应是一个放热过程,虽然可以降低能量消耗,但是反应温度过高易导致甲酸甲酯热解,且会产生催化剂积炭失活等问题[8-9]。所以,随着甲醇产量的逐年增长以及对甲酸甲酯需求的不断增加,开发温和条件下甲醇脱氢制取甲酸甲酯的技术路线对于优化甲酸甲酯的生产具有实际意义。
本论文拟开发一种光催化驱动的液相甲醇氧化脱氢制取甲酸甲酯的新路径。探究氧气气氛条件下甲醇氧化脱氢制甲酸甲酯[式(1)]的可行性,通过改变金属负载以及负载量,探究不同金属负载对催化剂(M/TiO2)在甲醇氧化脱氢反应中活性的影响,并通过原位红外技术明确甲酸甲酯的生成机理以及氧的存在对甲酸甲酯生成路径的影响。
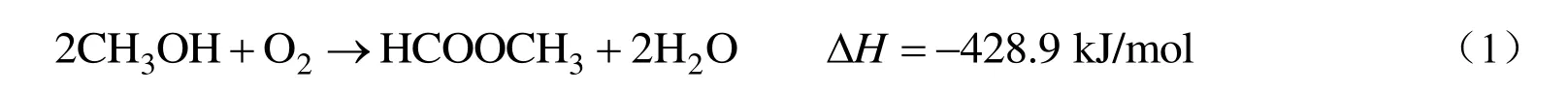
1 实验部分
1.1 催化剂制备
在50 mL 的烧杯中加入25 mL 超纯水(18.25 MΩ)和0.5 g 二氧化钛(Degussa P25),搅拌15 min。然后缓慢滴加5 mL 的Na2PdCl4溶液(Pd 含量为0.5 mg/mL),滴加完毕后再加入5 mL 过量的甲醇,继续搅拌30 min 使溶液混合均匀。将分散体系在氙灯光源下(CEL-HXF300,300 W,Ceaulight 300~2 500 nm)光照50 min,整个过程伴随搅拌。依次用超纯水和乙醇洗涤离心收集的浅灰色固体,并放置在60 ℃真空干燥箱中干燥12 h,得到0.5%Pd/TiO2催化剂。不同Pd 负载量的催化剂表示为xPd/TiO2(其中x表示样品中负载的Pd 理论质量分数,分别为1%,0.5%和0.25%)。将金属前驱体分别更换为HAuCl4·yH2O,AgNO3,RhCl3·3H2O,RuCl3·yH2O,Cu(NO3)2·3H2O 和Ni(NO3)2·6H2O,制得其他金属负载的光催化剂为0.5%M/TiO2,其中M 为金属。
1.2 催化剂表征
采用X 射线衍射仪(XRD,DX2700)测定催化剂的晶体结构。Cu-Kα射线源,测试所需电压和电流分别为40 kV 和30 mA,扫描2θ为5°~90°,步进角度为0.05°。拉曼光谱(Raman,DXR Microscope,Thermo Fisher)用于测定样品表面的化学结构,光源波长为455 nm,光阑狭缝为50 μm。使用具备能量色散X 射线光谱仪的扫描透射电子显微镜(STEM-EDX,JEM-F200)进一步研究样品中实际的元素分布。高倍透射电子显微镜(HRTEM,FEI Tecnai G2 F20,200 kV)用于观察样品的微观结构、形貌和负载粒子的大小分布等。紫外可见漫反射光谱(UV-Vis DRS,PE Lambda 750 UV-Vis)测定样品的的吸光范围,测量波长为200~800 nm。
1.3 催化剂活性评估
光催化甲醇脱氢反应活性评估为间歇操作,在配有冷却水夹套、体积为100 mL 的玻璃常压反应器中进行。首先在反应器中加入30 mg 的催化剂和30 mL 的甲醇;然后以200 mL/min 的速度将高纯氩气(99.999%)或高纯氧(99.999%)通入甲醇中,通气30 min,以鼓泡方式排出反应器中的空气,保持反应器温度在20 ℃;停止通气后打开氙灯,光催化反应2 h;关闭灯源,收集气相和液相产物。用安捷伦气相色谱(Agilent 490Micro GC)检测气相产物(H2,CO 和CO2),福立气相色谱(FL 9790ⅡGC,氢火焰检测器,FFAP 色谱柱)检测液相产物(甲酸甲酯)。
1.4 原位红外测定
为了探究甲醇氧化脱氢涉及的中间体及反应路径,进行了氩气和氧气气氛下的甲醇脱氢原位红外实验。具体操作步骤如下:(1)样品预处理,除去样品中的水分。氩气以20 mL/min 通入反应池进行吹扫,温度在110 ℃保持30 min,升温速率为10 ℃/min。恒温结束后,在氩气吹扫下降至20 ℃,采集红外谱图作为背景。(2)氩气气氛下甲醇吸附-光反应。流量为20 mL/min 的氩气以鼓泡方式通过 20 ℃的恒温甲醇中,通入原位反应池 30 min 后,关闭进出口阀,打开氙灯进行光催化反应。(3)氧气气氛下甲醇吸附-光反应。一个气路是氩气以鼓泡方式通过20 ℃的恒温甲醇,另一气路通入氧气,使出口混合气为甲醇和氧气的混合气,吸附 30 min 后,关闭进出口阀,打开氙灯,混合气在光反应器中发生反应。
2 实验结果和讨论
2.1 M/TiO2 光催化甲醇脱氢反应
2.1.1 不同金属负载催化剂M/TiO2的光催化活性
催化剂0.5%M/TiO2在Ar 和O2气氛中光催化甲醇脱氢反应活性的实验结果如表1 所示。由表1可知,氧气气氛下H2的生成速率相比在氩气气氛中的速率均有一定程度的下降,甲酸甲酯的生成速率均有提高。因为氧的存在促进了甲醇脱氢的过程,使得甲酸甲酯的生成速率提高,但氧气气氛下原子氧会与甲醇解离出的氢质子结合生成水,因而降低了H2的生成速率。与其他金属负载的催化剂相比,Pd/TiO2活性最佳,单位催化剂质量上甲酸甲酯的生成速率从1 196.37 μmol/(g·h)(Ar 气氛)增加到14 428.05 μmol/(g·h)(O2气氛),提高了约11 倍。

表1 0.5%M/TiO2 催化剂在两种气氛下(Ar,O2)光催化甲醇脱氢反应的活性结果Table 1 Photocatalytic activities of methanol dehydrogenation over 0.5%M/TiO2 in Ar or O2 atmosphere
另外,由两种气氛下的气相产物结果可知,在氧气中,甲醇会发生深度氧化,检测到大量CO2的存在。而Pd/TiO2为催化剂时,两种气氛下反应均未检测到CO。
2.1.2 不同负载量催化剂xPd/TiO2的光催化活性
氧气气氛下,不同负载量催化剂xPd/TiO2光催化甲醇脱氢反应活性如图1 所示。由图1 可知,与TiO2相比,负载了Pd 的催化剂Pd/TiO2活性均有一定程度的提高。这可能是因为电子不断地从TiO2迁移到功函数较大的金属Pd 上,促进了光生载流子的分离与迁移,进一步与催化剂表面的吸附基团反应,相应的光催化活性也有一定程度的增加。当Pd 的负载量为0.5%时,甲酸甲酯生成速率相对较高,为14 428.05 μmol/(g·h)。另外,当金属Pd 的负载量从0.25%增加到1%时,均未检测到CO,可能是因为以化学吸附的形式存在Pd 表面的CO 并未直接脱附形成CO 气体,而是进一步氧化生成了CO2。
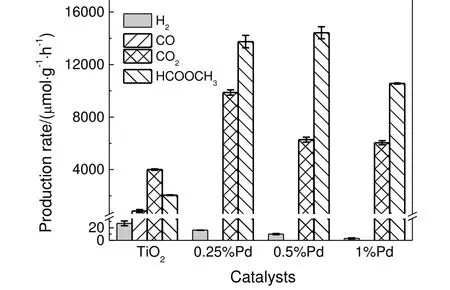
图1 氧气气氛下xPd/TiO2 的光催化结果Fig.1 Photocatalytic results over xPd/TiO2 in O2 atmosphere
2.2 催化剂表征结果
2.2.1 X 射线衍射表征
图2 显示了催化剂0.5%Pd/TiO2与TiO2的XRD 图谱。图2 显示,当金属Pd 的负载量为0.5%时,TiO2的晶形没有变化,包含了锐钛矿型和金红石型[10],表明了TiO2作为载体的稳定性,同时也未观察到金属Pd 的衍射峰,说明金属Pd 高度分散在载体TiO2表面。

图2 0.5%Pd/TiO2 与TiO2 的XRD 图谱Fig.2 XRD patterns of 0.5%Pd/TiO2 and TiO2
2.2.2 拉曼表征
图3 为催化剂0.5%Pd/TiO2与TiO2的拉曼图谱。可以观测到明显的锐钛矿型TiO2晶型的特征峰。其中包含了O—Ti—O 键不同的振动模态,分别为对称伸缩振动峰E′g(144,197 和635 cm-1)、反对称弯曲振动峰Alg(514 cm-1)和对称弯曲振动峰B1g(395 cm-1)峰[11]。因为拉曼光谱对于钛氧键的结构缺陷灵敏度高,可以发现,0.5%Pd/TiO2与未负载的TiO2相比,不同形式的钛氧键振动峰强度逐渐减弱,说明金属Pd 与载体TiO2间存在相互作用。

图3 TiO2 和0.5%Pd/TiO2 的Raman 图谱Fig.3 The Raman patterns of TiO2 and 0.5%Pd/TiO2
2.2.3 STEM-EDS 元素分布分析
使用扫描透射电子显微镜(STEM)结合能量色散X 射线光谱(EDX)对样品进行分析,确认纳米颗粒的微观结构和组成分布,结果如图4 所示。

图4 0.5%Pd/TiO2 的STEM-EDX 结果Fig.4 STEM-EDX spectra of 0.5%Pd/TiO2
图4(a)中的高角环形暗场像-扫描透射电子像(HAADF-STEM)显示了0.5%Pd/TiO2样品的微观结构。进一步在其上进行元素谱图分析,图4(b)~(d)所示为图4(a)区域的EDX 元素相对分布图,表明样品中三种元素(Ti,O 和Pd)在催化剂表面分布均匀。说明通过光化学还原制备催化剂的方法是可行的。
图5 和表2 显示了催化剂表面的化学组成,表明金属Pd 成功地负载在基体TiO2上。

表2 0.5%Pd/TiO2 中的元素组成Table 2 Elemental composition in 0.5%Pd/TiO2

图5 0.5%Pd/TiO2 的EDX 能谱Fig.5 EDX spectrum of 0.5% Pd/TiO2
2.2.4 高倍透射电子显微镜
通过HRTEM 可以更清楚地观测到金属Pd 颗粒在TiO2表面的分布情况。图6 为两种尺度下0.5%Pd/TiO2的HRTEM 图像。由图6(a)可以观察到TiO2表面存在的Pd 颗粒纳米团簇;图6(b)中呈现出2.25 Å 的晶格间距,对应于Pd(111)晶面。

图6 0.5%Pd/TiO2 的HRTEM 图像Fig.6 HRTEM images of 0.5%Pd/TiO2
2.2.5 紫外可见漫反射光谱
图7 所示为样品的UV-Vis DRS 谱图。由图7(a)可知,相比TiO2,样品0.5%Pd/TiO2的吸光范围由紫外光向可见光区域扩展。根据式(2)可以计算xPd/TiO2的带隙(Eg)[12]。

式中:A为吸光度;h为普朗克常数,J·s;ν是光频率,Hz;K是常数;Eg是带隙,eV。
将图7(a)的实验数据按(Ahν)0.5对光子能量(hν)作图,结果见图7(b),当纵坐标为零时的hν值即为Eg。图7(b)显示,0.5%Pd/TiO2的带隙从TiO2的2.96 eV 缩小为2.42 eV,表明通过光化学还原沉积的方法在TiO2表面负载贵金属Pd 确实能改变催化剂的光学性能,增加对可见光的吸收。
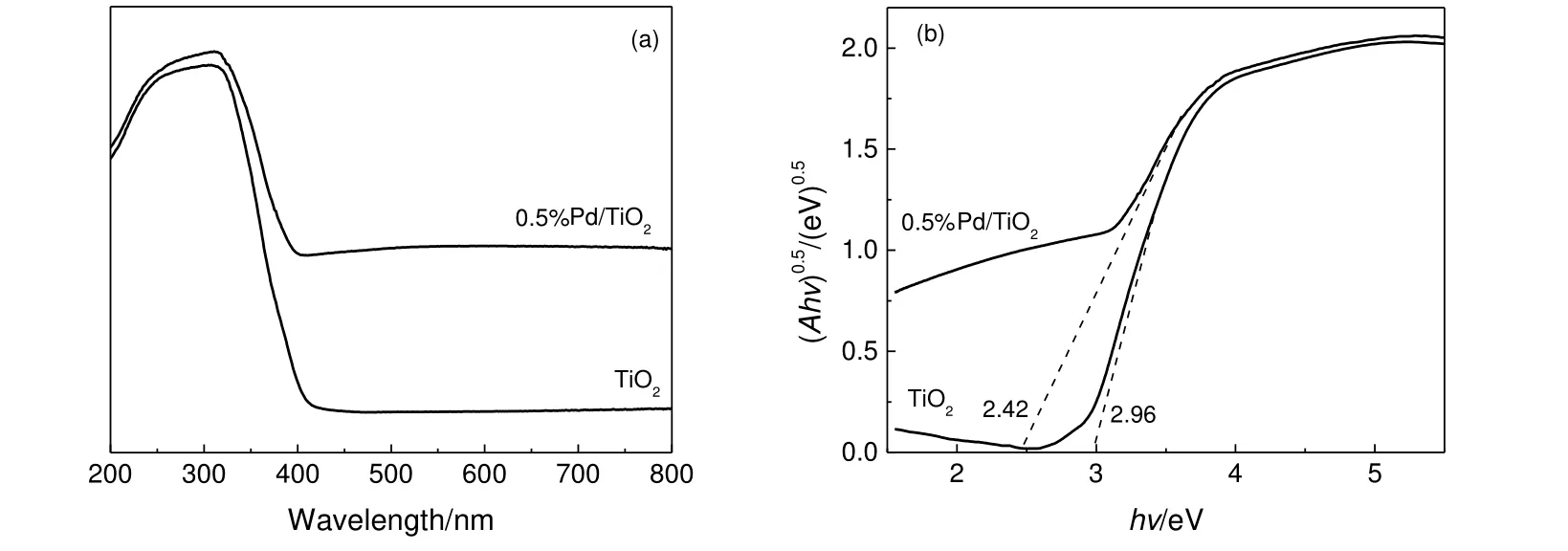
图7 0.5%Pd/TiO2 的光学特性Fig.7 Optical characterization of 0.5%Pd/TiO2
2.3 甲醇脱氢制甲酸甲酯反应机理
为了探究氧气对甲醇脱氢路径的影响,分别开展了氧气和氩气气氛下的光催化甲醇脱氢原位漫反射(in-stiu DRIFTS)实验。
2.3.1 甲醇的原位吸附及光催化反应
氧气气氛下,0.5%Pd/TiO2光催化甲醇脱氢反应过程的原位红外光谱见图8。
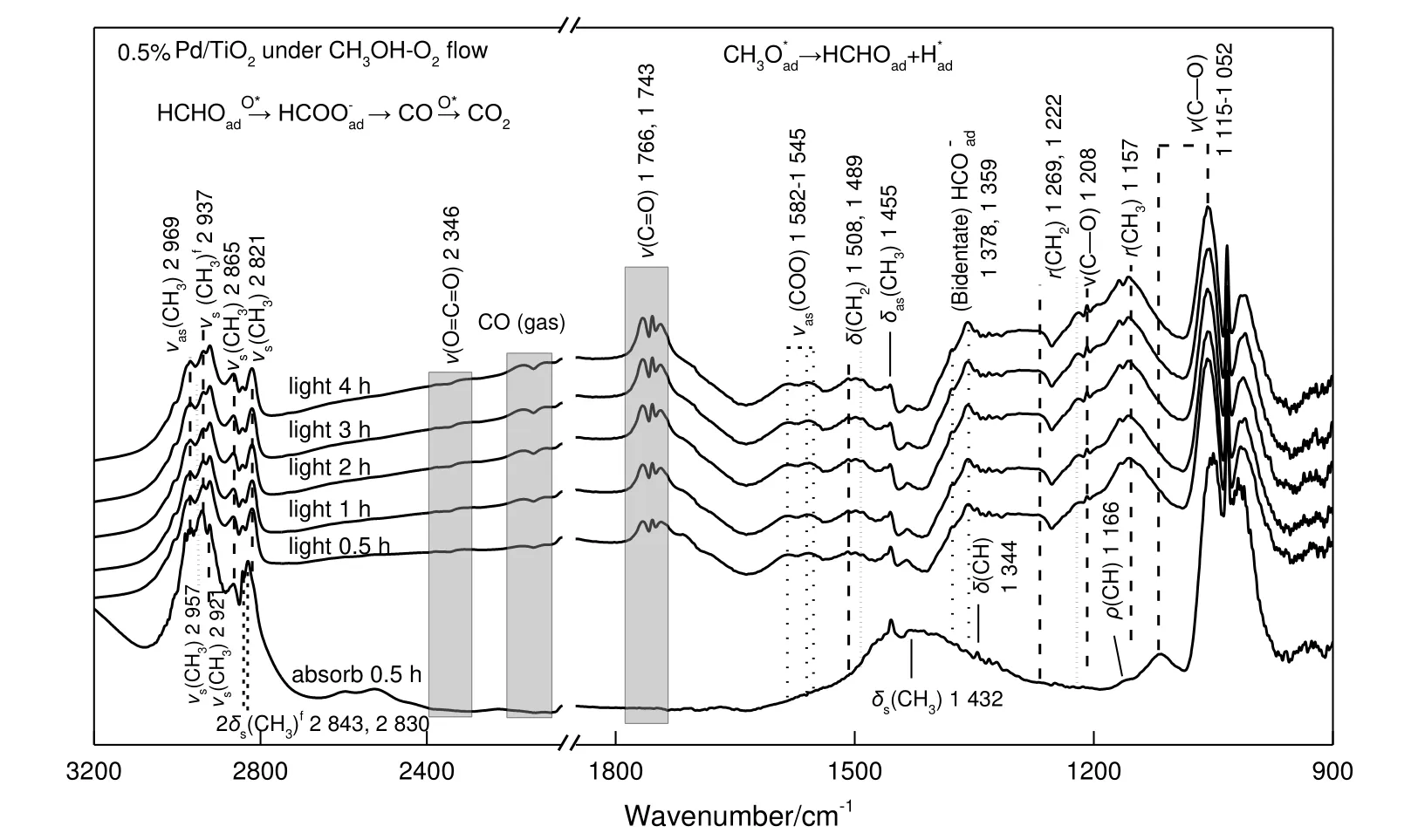
图8 O2 气氛下甲醇在0.5%Pd/TiO2 催化剂上的吸附-光反应过程的红外谱图Fig.8 FTIR spectra for adsorption-photoreaction process of methanol over 0.5%Pd/TiO2 in O2 atmosphere
由图8 可见:
(a)甲醇吸附。打开氙灯前(通气0.5 h 时)的红外图谱即为甲醇在0.5%Pd/TiO2上的吸附谱图,检测到了C—H 键的特征谱带[13],其中2 921~2 828 cm-1的吸收峰归属于甲氧基(CH3Oad),2 954 cm-1和1 344 cm-1处相对较弱的特征峰振动源自未解离吸附的甲醇分子[13];低频处也可见CH3Oad的特征峰,δ(CH3)[13](1 458 cm-1,1 433 cm-1),ρ(CH3)[13](1 166 cm-1),ν(C—O)(1 115~1 052 cm-1)[13-14]。结果表明,甲醇在Pd/TiO2表面存在分子吸附和解离吸附,CH3Oad是由CH3OHad通过O—H 键的解离生成的(CH3OHad→ CH3Oad+H*),这一步骤在黑暗下即可进行。
(b)光催化反应。打开氙灯光照反应0.5 h 后,可以观察到甲氧基基团特征峰强度略有下降,与此同时,在1 508 cm-1和1 269 cm-1处新出现的振动峰归属于中间体甲醛[13,15],这表明CH3Oad进一步经过C—H 的断裂反应生成甲醛(CH3Oad→ HCHOad+H*),这一步骤需在光反应下进行。
由甲醇在氧气、氩气气氛下的原位光反应谱图(见图9)对比可知,随着反应时间的增加,甲酸甲酯的特征峰[1 766~1 743 cm-1:v(C=O),1 208 cm-1:v(C—O),1 157 cm-1:r(CH3)][13,16-17]强度显著增长,与活性评价所做的实验结果一致。这是因为低温下贵金属Pd 对氧有很强的解离能力,解离出的原子氧促进了CH3Oad中C—H 的断裂形成了更多的甲醛。可以观察到,氧气气氛下甲醛的特征峰强度有一定程度的增大,使得有更多的甲醛与甲醇发生交叉偶联反应生成甲酸甲酯[17]。
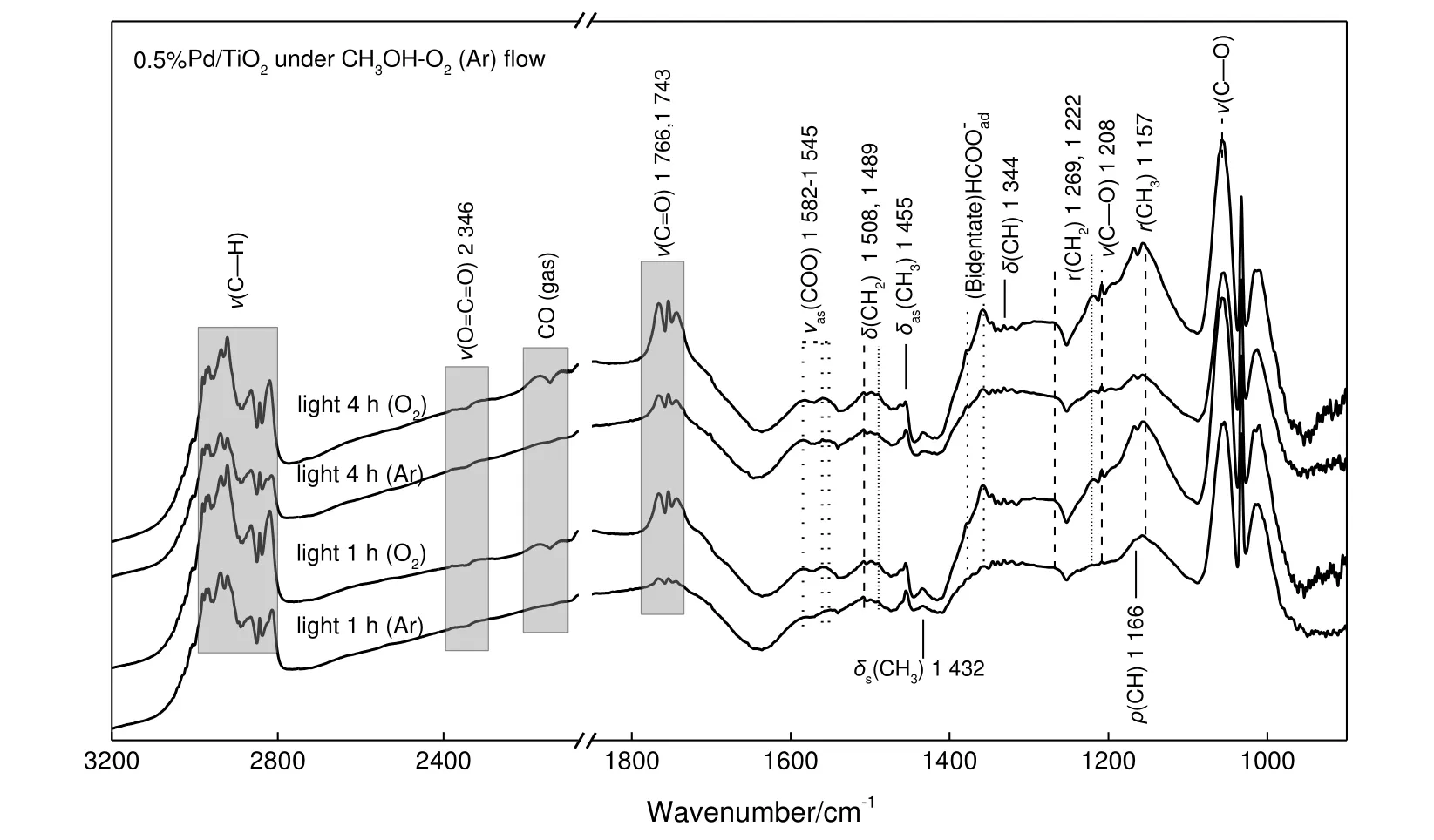
图9 甲醇在氩气与氧气气氛下的光反应过程的红外谱图对比Fig.9 Comparison of FTIR spectra for the photoreaction process of methanol in Ar and O2 atmosphere
由图9 可知,甲醇在氩气气氛下没有产生CO 与CO2的特征峰;而在氧气气氛下可以观测到CO(2 170~2 118 cm-1)[19]与CO2(2 346 cm-1)[16]的特征峰。其中,CO 来自于甲酸盐的分解生成的CO 再进一步发生氧化反应生成
2.3.2 甲醇氧化脱氢反应机理
使用原位漫反射技术研究了甲醇在O2气氛下的吸附和光化学反应过程中涉及的活性物种和中间体,并与Ar 气氛中的实验结果进行分析比较,得出甲醇在氧气中的氧化脱氢路径以及氧的存在对过程的影响,如图10 所示。
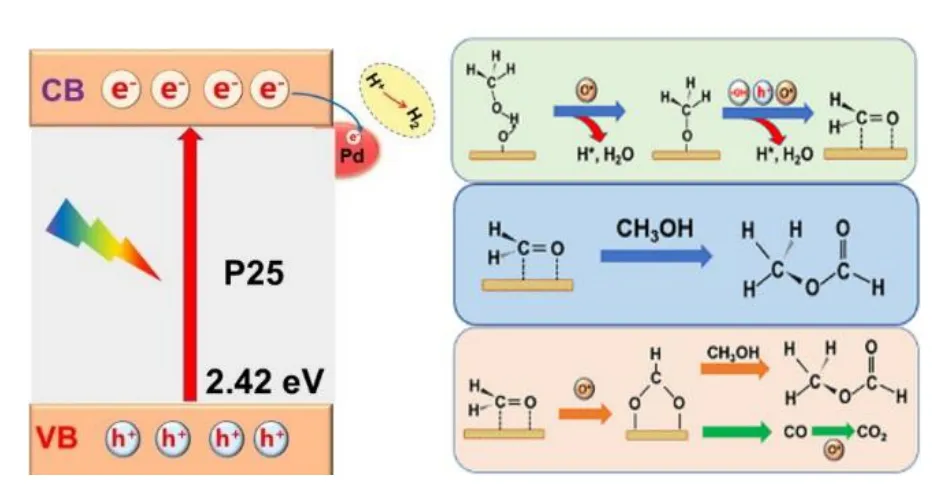
图10 O2 气氛中甲醇氧化脱氢反应机理Fig.10 Mechanism of oxidative dehydrogenation reaction of methanol in O2 atmosphere
低温(20 ℃)下,金属Pd 解离出的原子氧(O*)与光生空穴(h+)和羟基自由基(·OH)共同促进了CH3Oad中C—H 的断裂反应生成中间体甲醛,使得有更多的甲醛与CH3OH 发生交叉偶联反应;另一方面,氧的存在使得HCHO 进一步氧化生成HCOO*,部分甲酸甲酯来源于氧化产物中间体甲酸盐与甲醇直接酯化反应,总体上提高了甲酸甲酯的产量。中间体HCOO*也会进一步分解生成CO,生成的CO 再发生氧化反应生成CO2。而甲醇脱氢产生的氢质子(H*)会与原子氧(O*)结合,因此气相产物中H2的产量与甲醇在Ar 中的脱氢量相比显著降低。
3 结论
通过光化学还原的方法制备了不同金属负载以及负载量不同的TiO2光催化剂,开发了一种光催化驱动的液相甲醇氧化脱氢制取甲酸甲酯的新路线。在测试的众多金属中,催化剂Pd/TiO2在不同气氛下(Ar 和O2)的脱氢实验中表现出优异的活性,甲酸甲酯的生成速率从1 196.37 μmol/(g·h)(Ar气氛)增加到14 428.05 μmol/(g·h)(O2气氛),提高了11 倍。在不同负载量的Pd/TiO2中,0.5%Pd/TiO2具备最高的甲酸甲酯产率。另外,两种气氛下的气相产物均未检测到CO。根据XRD、Raman、HRTEM和UV-Vis DRS 等表征,证明了金属Pd 与载体TiO2之间存在相互作用,并且高度分散在TiO2表面。而且Pd 的负载缩小了半导体禁带宽度,促进其在可见光区域的吸收。根据Ar 和O2两种气氛下的原位红外实验,证实了氧的存在促进了甲氧基(CH3Oad)中C—H 的断裂与HCHOad的氧化。明确了光催化体系下甲醇氧化脱氢制甲酸甲酯的两条反应路径:一是中间产物HCHOad与CH3OHad的交叉偶联反应,二是甲醛氧化的中间体与CH3OHad的酯化反应。
