含深共熔溶剂体系中晶胶微球固定化分枝杆菌生产雄烯二酮研究
2021-10-10何京锴楼小玲贠军贤关怡新姚善泾
何京锴,肖 霞,楼小玲,贠军贤,关怡新,姚善泾
1.浙江大学化学工程与生物工程学院,浙江 杭州 310027;2.浙江工业大学化学工程学院,绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310032
雄甾-4-烯-3,17-二酮(AD)及其衍生物是合成多种甾体类药物的重要中间体,可通过分枝杆菌等微生物降解植物甾醇侧链制备[1]。相比传统的“黄姜-皂素-双烯类-甾体药物原料药及制剂”工艺路线[2],生物转化法能有效地解决薯蓣皂苷原料短缺和化学合成带来的环境污染等问题,是甾体药物的重要绿色合成途径[3]。然而,受限于底物的低水溶性、产物抑制以及降解、细胞聚集等问题,目前生物转化法的效率仍然较低,难以应用于大规模生产。
溶剂工程可有效促进底物的溶解或分散,避免产物的局部积累情况,是提高生物转化效率的重要策略[4-6]。近年来,离子液体等新型绿色溶剂受到了人们的广泛关注,深共熔溶剂(DESs)作为一种离子液体的类似物,具有离子液体的可设计性、环境友好和不挥发不可燃的特点,还有合成简便且廉价的独特优势[7]。DESs 由2 种及以上的物质混合构成,混合物的凝固点由于发生共熔作用而显著降低,在室温下能以液态形式存在,发挥其作为溶剂的作用。DESs 在细胞催化领域有着广泛的应用[8],能显著提高酶催化性能,增强固定化细胞操作稳定性等[9]。
固定化细胞技术可以改善细胞的聚集情况、提供更加稳定的微环境[10],并为实现半连续和连续生产提供了可能。晶胶介质是一种新型的聚合材料,具有特征性的连通大孔、超大孔乃至海绵状结构,早期主要作为生物分离层析介质使用[11-12]。晶胶介质的多孔特性使其能够高载量地固定化细胞[13-14],在Efremenko 等[15]的研究中,聚乙烯醇晶胶介质的微生物载量可以达到300 mg-DCW/g-基质(细胞干重/基质)。通过对聚合单体的改性和种类的调节,可改变基质的电负性、亲疏水性等性质,满足不同细胞的固定化要求。
本研究以甲基丙烯酸羟乙酯(HEMA)和甲基丙烯酸正丁酯(BMA)为聚合单体制备晶胶微球,考察晶胶微球固定化对分枝杆菌细胞的形态和催化活力的影响,优化固定化分枝杆菌的晶胶微球添加量,构建含DESs 的新型转化体系,研究固定化细胞催化生产AD 的反应进程和固定化细胞的重复利用,实现固定化细胞催化的半连续转化。
1 实验部分
1.1 菌种与试剂
分枝杆菌菌株Mycobacteriumsp.MB 3683 购自中科院微生物研究所菌种保藏中心。植物甾醇(β-谷甾醇45%,豆甾醇26.2%,菜油甾醇23.5%,菜籽甾醇3.2%,纯度≥95%)购自西安海斯夫生物科技有限公司。甲基丙烯酸羟乙酯(纯度≥97%)、甲基丙烯酸正丁酯(纯度≥99%)、聚乙二醇二丙烯酸酯[PEGDA,数均分子量(Mn)约为250,纯度≥99%]、乙二醇二甲基丙烯酸酯(EGDMA,纯度≥98%)、四甲基乙二胺(TEMED,纯度≥99%)和过硫酸铵(APS,纯度≥98%)均购自德国Sigma-Aldrich 公司。其它试剂均为分析纯市售试剂。
1.2 培养基
种子培养基:5 g/L 葡萄糖,3 g/L 牛肉浸膏,5 g/L 胰蛋白胨,15 g/L NaCl,0.9%体积分数甘油,pH 值为7.0,每50 mL 装液量加入15 颗玻璃珠。
发酵培养基:8 g/L 葡萄糖,2 g/L 柠檬酸,6 g/L (NH4)2HPO4,0.05 g/L 柠檬酸铁铵,0.5 g/L K2HPO4,0.5 g/L MgSO4,0.3%体积分数Tween 80,1 g/L 植物甾醇,pH 值为7.1。
1.3 实验方法
1.3.1 晶胶微球的制备和表征
晶胶微球使用滴加冷冻聚合法制备[16]。将7.5%(质量分数)HEMA、7.5%(质量分数)BMA、2.5%(质量分数)PEGDA 和2.5%(质量分数)EGDMA 溶于去离子水中,预冷至3~5 ℃。往上述聚合单体溶液加入0.6%(质量分数)TEMED 为引发剂和0.8%(质量分数)APS 为加速剂,迅速混匀溶液,并匀速滴加至-20 ℃的白油中。定型后,取出微球置于-20 ℃冰箱中过夜以充分聚合。聚合完成的晶胶微球于室温下解冻,用大量去离子水冲洗,冷冻干燥保存。
晶胶微球拍照后,使用Nano Measurer 1.2 软件分析晶胶微球的平均粒径(dm)。在25 ℃下测定晶胶微球的干重和相应微球的水饱和重量,确定微球的最大孔隙率(φmax)。同时,在25 ℃下测定晶胶微球的干重和被滤纸挤压出自由水的相应微球重量,确定微球的有效孔隙率(φe)。
1.3.2 DESs 的合成
Bet/Mal(甜菜碱/麦芽糖,两者的物质的量之比为4:1)合成:称取相应质量的各组分,置于反应器中,60 ℃水浴搅拌加热,反应2 h 并得到澄清液体后,加入超纯水至DESs 浓度为80%(质量分数),继续搅拌加热至液体均一,于30 ℃恒温保存。
Bet/Gal(甜菜碱/半乳糖,两者的物质的量之比为5:2)合成:称取相应质量的各组分,置于反应器中,加过量超纯水,摇匀至完全溶解,于60 ℃水浴中以旋转蒸发仪旋干水分至DESs 浓度为80%(质量分数),于30 ℃恒温保存。
1.3.3 悬浮培养静息细胞和固定化细胞制备
从保藏的斜面中挑取菌落,转移至种子培养基中。在180 r/min、28 ℃的条件下培养48 h 后,以11%接种量接种到发酵培养基,在200 r/min、30 ℃的条件下培养60 h。4 ℃、6 000 r/min 下离心10 min收集菌饼,用0.1 mol/L 磷酸盐(PBS)缓冲液(pH 值为7.1)重复洗涤3 次,即得到悬浮培养静息细胞。固定化细胞的制备需要在发酵培养基中额外加入20 g/L 灭菌后的干燥晶胶微球,相同条件培养完成后收集固定化细胞的晶胶微球,用0.1 mol/L PBS 缓冲液(pH 值为7.1)洗涤至少3 次,至无明显细胞脱落,所得即为固定化细胞。
1.3.4 扫描电子显微镜观察固定化细胞晶胶微球
用0.9%(质量分数)的NaCl 生理盐水重悬样品,并洗涤2 次。加入2.5%(质量分数)的戊二醛固定液,于4 ℃环境中固定3 h,离心去上清液。之后分别以30%,50%,70%,90%,100%(体积分数)的乙醇溶液按顺序室温下处理15 min。最后将完全脱水的样品用冷冻干燥机干燥,喷金后用扫描电镜(SU-8010,Hitachi,Japan)进行观察。
1.3.5 含深共熔溶剂体系的细胞转化
将50 g/L 的分枝杆菌悬浮培养静息细胞或100 g/L 的固定化细胞晶胶微球、含有12.5%体积分数的80% DESs、2 g/L 葡萄糖和3 g/L 植物甾醇加入装有0.1 mol/L Tris-HCl 缓冲液(pH 值为7.5)的锥形瓶中(悬浮培养时使用带玻璃挡板的锥形瓶),30 ℃和200 r/min 条件下反应一定时间。半连续转化时,每一批次转化36 h,取出固定化细胞晶胶微球,以0.1 mol/L PBS 缓冲液(pH 值为7.1)简单洗涤后投入下一个循环。转化完成后加入等体积乙酸乙酯,室温下均匀混合15 min 以萃取溶液中的AD。离心后,取澄清的上相(乙酸乙酯相)通风风干,并加入5 倍体积的甲醇以充分溶解。用高效液相色谱(HPLC,Agilent 1100,Agilent,USA)测定AD 的浓度:使用Hypersil ODS-2 C18 反相色谱柱(5 μm,250 mm4.6 mm,Thermo Fisher Scientific,USA);流动相采用甲醇/水混合物(体积比为8:2),流速为1 mL/min;进样量为20 μL;检测波长为254 nm;洗脱时间为6 min。
2 结果与讨论
2.1 晶胶微球的表征与细胞固定化
由于分枝杆菌细胞壁富有分枝菌酸等脂质,细胞会表现出一定的疏水性,易聚集于固定化基质的疏水性空腔内。然而,基质过高的疏水性容易使分枝杆菌在空腔内过度堆积,因此实验中使用的晶胶微球由亲水性单体HEMA 和疏水性单体BMA 等质量聚合而成,确保分枝杆菌静息细胞以合适的密度吸附在基质上。晶胶微球的形态可通过外观形貌和微观结构进行观察。图1 显示了微球外部形态,可以看到,制备所得的晶胶微球为轻质白色小球。利用Nano Measurer 1.2 软件分析平均粒径为(2.78±0.03) mm。晶胶微球内部具有大量空隙,最大孔隙率为85.43%±0.30%,有效孔隙率为72.82%±0.41%。

图1 HEMA-BMA 聚合制备的晶胶微球Fig.1 The cryogel beads prepared by polymerization of HEMA and BMA
图2 为未固定(a,b)和固定(c,d)分枝杆菌细胞的晶胶微球表面扫描电镜(SEM)图。由图2 可见,晶胶微球的微观结构具有大量直径为40 μm 以上的孔洞,有利于细胞吸附并提供通畅的物质交换环境。经固定化后,长约2 μm 的细胞均匀地分散吸附在微球表面,有效缓解了悬浮培养细胞的聚集现象。烘干后称重,计算晶胶微球的分枝杆菌细胞载量为(70.5±7.2) mg-DCW/g-基质,高于已报道的其它吸附性基质对分枝杆菌的细胞载量(硅藻土的分枝杆菌细胞载量为11.4 mg-DCW/g-基质,硅胶的分枝杆菌细胞载量为5.7~6.0 mg-DCW/g-基质)[17]。

图2 固定化细胞前(a,b)后(c,d)的晶胶微球表面结构Fig.2 Structure of cryogel beads before (a,b) and after (c,d) cells immobilization
表1 为悬浮培养细胞和晶胶微球固定化细胞在缓冲液中转化24 h 后的AD 产量。得益于晶胶微球的促细胞分散性和高细胞载量,细胞的转化效率显著提高,单位细胞的AD 产量(以细胞干重计,下同)为悬浮培养细胞的6.8 倍。表明晶胶微球作为分枝杆菌的固定化基质,显著提高了细胞的利用率。
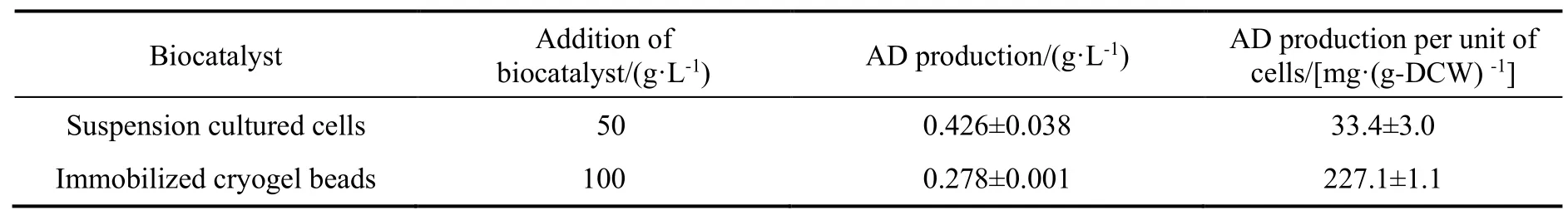
表1 悬浮培养细胞和固定化晶胶微球转化24 h 的AD 产量Table 1 AD production using suspension cultured cells or beads immobilizing cells after 24 h biotransformation
2.2 固定化细胞晶胶微球添加量对AD 产量的影响
相比悬浮培养细胞转化体系中50 g/L 的细胞浓度,上文中固定化细胞转化体系中细胞浓度较低,因此探讨了不同的固定化分枝杆菌的晶胶微球添加量对转化效率的影响。图3 所示为不同添加量的固定化晶胶微球在缓冲液体系中转化24 h 的AD 产量和单位细胞AD 产量。由图3 可知,随着固定化晶胶微球添加量的增加,总AD 产量迅速提高。将固定化晶胶微球添加量提高到180 g/L 的情况下,仍未受到明显的传质限制。这是因为一方面固定在晶胶微球内部的分枝杆菌为静息细胞,对外界营养物质要求较低;另一方面,晶胶微球内部的大量孔道使得物质可以自由通过,传质阻力极低[11]。
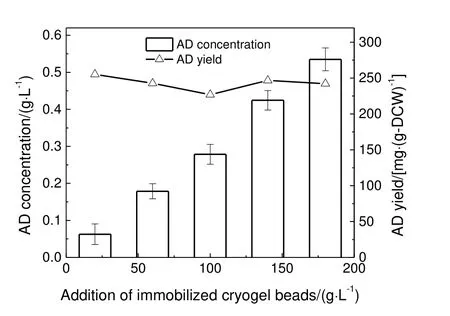
图3 不同固定化细胞晶胶微球添加量时转化24 h 的AD 产量Fig.3 AD production after 24 h biotransformation with different additions of immobilized cryogel beads
在植物甾醇降解过程中,因为底物在发酵液中溶解性极差,一般的策略是过量加入植物甾醇,通过提高固定化细胞晶胶微球的添加量,可以大大提高细胞对植物甾醇的利用率,也有利于降低生物转化的设备和时间成本。
2.3 含DESs 体系中分枝杆菌转化反应历程
研究表明,含DESs 的转化体系在全细胞催化反应和固定化细胞反应中具有很好的应用潜力[18]。采用合成的Bet/Mal 深共熔溶剂和Bet/Gal 深共熔溶剂,构建了2 种含10%(质量分数)的DESs 转化体系,研究了48 h 的悬浮培养细胞转化以及固定化细胞转化反应历程,结果见图4。
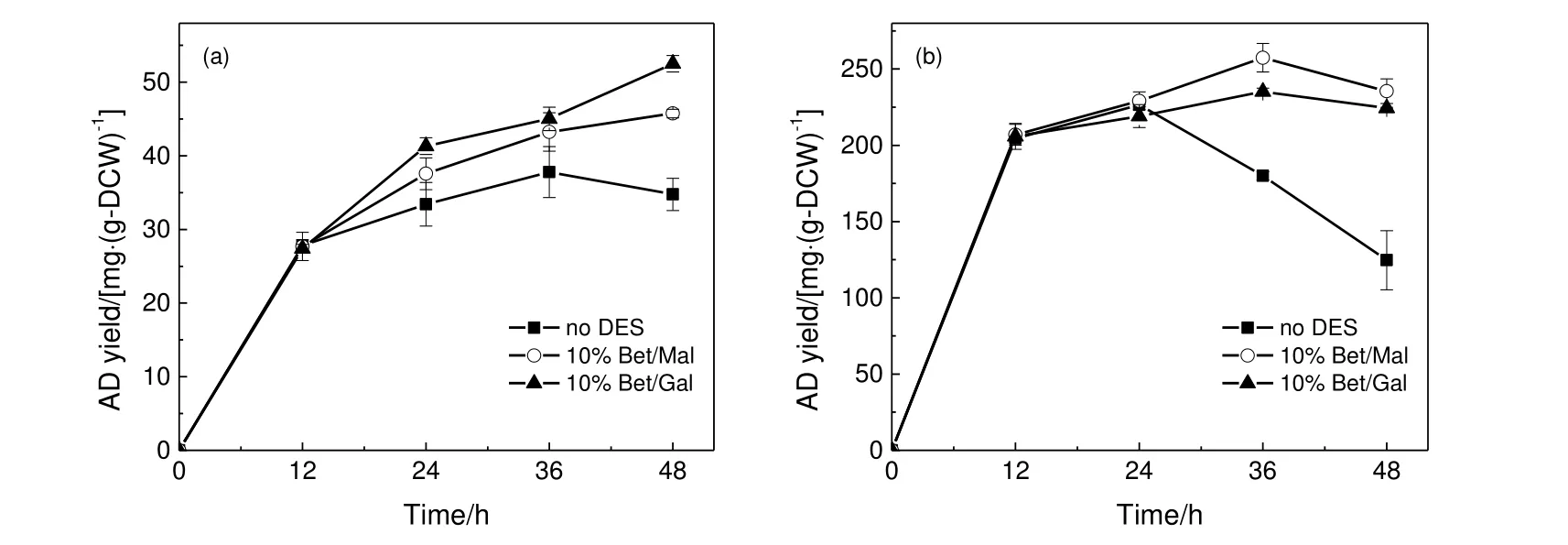
图4 含10% DESs 体系中悬浮培养细胞(a)和固定化细胞(b)降解植物甾醇反应历程Fig.4 AD production course for the biotransformation of phytosterols in systems with 10% DESs by suspension cultured cells (a) and immobilized cells (b)
如图4 所示,在无DESs 的转化体系中,悬浮培养细胞和固定化细胞分别在转化36 h 和24 h 时达到最大的AD 产量,随后细胞内AD 的降解途径占据优势,AD 积累逐渐下降。而在两种含DESs转化体系中,不论是悬浮培养细胞转化还是固定化细胞转化过程,AD 的降解过程都被明显抑制,使得AD 产量的积累阶段得以延长,大大提高了AD 的产量。尤其是在固定化细胞转化过程,含DESs体系中24~36 h 阶段的AD 降解被明显抑制。在10% Bet/Mal 和10% Bet/Gal 体系中,转化36 h 后AD 产量分别为257.5 mg/g-DCW 和235.3 mg/g-DCW。值得注意的是,不论是在缓冲液对照组还是DESs 组中,相比悬浮培养细胞转化,固定化细胞转化过程中AD 的降解阶段均出现的更早些,意味着固定化细胞受产物抑制和产物降解的影响更显著。因为在固定化细胞体系中单位细胞的AD 产量远高于悬浮培养细胞,疏水性产物AD 在细胞所处微环境的局部浓度更高,使得产物抑制作用更强,且更易触发产物降解途径。
2.4 含DESs 体系中固定化细胞的重复利用
细胞的多批次重复利用是固定化细胞技术在生物转化过程中的一个突出优势。在单批次转化达到最大产量即转化36 h 后,回收固定化细胞并重复使用,可以最大限度地提高细胞利用率。实验测定了在不同溶剂体系中,每批次转化中AD 的产量,另外为了考察晶胶微球内部积累的AD 对回收后固定化细胞转化产量的影响,测定了每批次转化前晶胶微球内部富集的AD 含量,结果见表2。

表2 含10% DESs 体系中固定化细胞重复利用性能Table 2 Performances of repeated used immobilized cells in systems with 10% DESs
由表2 可见,在3 种体系中重复利用的固定化细胞催化活力都出现了大幅下降,其中缓冲液组的下降最为明显,第3 批次转化过程中的AD 产量只有第1 批次的13.1%。导致细胞催化活力丧失的主要原因是AD 在晶胶微球内部的堆积。在分枝杆菌催化植物甾醇侧链降解反应时,AD 容易在细胞表面析出,而晶胶微球内部的半疏水环境进一步加剧了AD 在局部堆积的倾向,阻碍了AD 向主体溶液的扩散。如表2 所示,在第1 个循环批次开始前,由于静息细胞制备过程中的植物甾醇诱导,晶胶微球内部已存在少量的AD。在经过第1 批次的循环后,晶胶微球内部AD 浓度显著上升,抑制了第2循环批次中的AD 产量。因此在第2 批次后,扩散出晶胶微球的AD 量反而大于该批次中细胞生产的AD 量,导致晶胶微球内部AD 浓度有少许下降。含DESs 体系相对于缓冲液体系,有助于改善AD在晶胶微球内和缓冲液中的分配。以第1 批次反应完成后为例,两种DESs 体系中分别将溶液中AD占总AD 的比例从20.6%提高到了49.6%和51.5%。通过促进产物从晶胶微球中扩散至外部缓冲液中,含DESs 体系部分缓解了固定化细胞循环利用后的催化活力损失。多项研究[9,19-20]也证实,DESs 有助于提高固定化细胞经循环回收后的催化活力,认为DESs 可以提高细胞的操作稳定性。
2.5 含DESs 体系中固定化细胞的半连续转化过程
尽管重复使用细胞损失了细胞的大部分催化活力,但通过多批次半连续转化过程,可以有效解决这一问题。在单批次转化过程中,通过乙酸乙酯同时萃取发酵液和晶胶微球中的AD,萃取后晶胶微球中固定化细胞基本失活;而在半连续转化时,仅萃取收集发酵液中的AD,固定化细胞仍具有催化活力并继续参与下一批次的转化,在所有批次的转化完成后再对晶胶微球中的AD 进行萃取回收。
表3 展示了每批次循环(36 h)后从缓冲液中萃取回收的AD 量,以及完成所有循环后从晶胶微球中萃取回收的AD 量。

表3 含10% DESs 体系中固定化细胞半连续转化的AD 产量Table 3 AD production of semi-continuous biotransformations using immobilized cells in systems with 10% DESs
由表3 可知,在缓冲液体系中,由于AD 大部分积累在晶胶微球内部,第一个批次中的AD 产量很低,且未处理晶胶微球内的AD 抑制了后续批次的AD 生产,限制了最终得到的总AD 产量。在缓冲液中,3 批次半连续转化后AD 产量仅比单批次转化时上升了17.6%。而在含DESs 体系中,由于DESs 抑制了AD 的降解并减少了AD 在晶胶微球内的累积情况,AD 产量显著提高。最终,在含10%Bet/Mal 的体系中,固定化细胞的3 批次半连续转化的总AD 产量达到了0.491 g/L,即401.4 mg/g-DCW的单位细胞AD 产量,相比半连续转化的缓冲液组有明显提高,是缓冲液体系悬浮培养细胞转化单位细胞AD 产量(33.4 mg/g-DCW)的12 倍。
3 结 论
DESs 作为一种新型绿色溶剂,在生物转化过程中具有促进底物分散、稳定生物催化剂和提高转化效率等优势。本研究构建了10% Bet/Mal 和10% Bet/Gal 两种含DESs 体系,将其应用于分枝杆菌固定化细胞降解植物甾醇侧链生产AD 过程中。合成了基于HEMA 和BMA 的晶胶微球,作为分枝杆菌固定化基质,有效分散了分枝杆菌细胞,提高了细胞的利用率。DESs 的添加抑制了AD 的降解,减少了AD 在晶胶微球内的累积。在含10% Bet/Mal 的新型溶剂体系中,晶胶微球固定化分枝杆菌细胞经过3 批次半连续转化,单位细胞总AD 产量达到401.4 mg/g-DCW,是缓冲液体系悬浮培养细胞转化的12 倍,展示了工业化应用的潜力。
