DCE-MDCT与HR-MRI评估直肠癌肠壁外脉管侵犯的应用价值比较
2021-04-25邱勇刚董浩汪鑫斌楼存诚陆亚丽李国锋
邱勇刚 董浩 汪鑫斌 楼存诚 陆亚丽 李国锋
直肠癌是临床最常见的消化道恶性肿瘤之一,统计显示[1]其发病率和病死率分别居我国全身肿瘤的第3位和第4位,手术仍然为最有效治疗方法之一。2020年版中国结直肠癌诊疗规范[2]建议术前影像学检查方法包括CT和MRI。壁外脉管侵犯(EMVI)阳性是肿瘤局部复发与远处转移的独立危险因素[3],与患者不良预后密切相关。相比MRI,CT空间分辨率具有明显优势,同时可以应用MPR、MIP、SSD等技术多方位重建,动态增强多排螺旋(DCE-MDCT)能更直观、立体的反映肿瘤与周围脉管结构的关系。本文比较分析DCEMDCT与高分辨率核磁共振成像(HR-MRI)在分级评价EMVI中的诊断效能。
1 资料与方法
1.1 临床资料 回顾性分析2018年10月至2020年3月本院41例直肠癌患者的影像资料,(1)纳入标准:①经病理确诊为结直肠癌并接受根治术;②术后病理报告包含脉管侵犯及免疫组化血管内皮标志物CD31/CD34、淋巴管内皮标志物D2-40等;③影像学资料完整,术前1周检查同时包含DCE-MDCT及HR-MRI;④检查前未接受其他治疗。(2)排除标准:①术前行放疗、化疗或放化疗;②CT对比剂过敏;③严重心脏疾病,如冠心病、心绞痛、二尖瓣狭窄等;④CT或MRI图像质量差而无法评估者。
1.2 检查方法 (1)HR-MRI:应用SIEMENS Aera 1.5T MR扫描仪。患者取仰卧位,表面线圈,行病变处矢状位、轴位和冠状位扫描,轴位垂直于病变段肠管,矢状位和冠状位平行病变段肠管。①T2WI序列(TR/TE=3000 ms/97 ms),层厚3 mm,层间距1 mm,视野(FOV)160 mm,成像矩阵384384;②DWI序列(TR/TE=4900 ms/65 ms,b值取50和800 s/mm2);③T1WI序列(TR/TE=5 ms/2 ms)。(2)DCE-MDCT:采用Philips Barilliance型64排螺旋CT扫描仪。患者仰卧位,进床方式为先头后足,扫描范围包括自双侧肋弓下缘至耻骨联合下缘,平扫后增强,扫描参数:管电压:120 kV,管电流250 mAs,螺距1.0,层厚2 mm。增强采用高压注射器自肘静脉团注非离子型对比剂碘海醇(300 mgI/ml),剂量为1.5 ml/kg,注射流率2.5 ml/s,分别于注射对比剂完毕后15 s、45 s行动脉期、静脉期扫描。扫描图像导入至后处理工作站进行重建,包含多平面重组、曲面重建等。
1.3 影像评估 由2名腹部影像专业的高年资主治医师采用双盲法阅片进行评估,影像评估分级按照JHAVERI等[4]提出的改良后肿瘤及周围脉管关系分级(见表1),0~2分为EMVI阴性,3~4分为EMVI阳性。对评估结果不同时,由2位医师共同讨论,取得一致意见后确定。

表1 直肠癌EMVI评估分级量表及示意图
1.4 统计学方法 采用SPSS 19.0统计软件。影像与病理一致性采用Kappa检验,Kappa≥0.75时一致性好;0.4<Kappa<0.75时一致性中等;Kappa≤0.4时一致性差,分别统计DCE-MDCT与HR-MRI检出直肠癌EMVI的最佳评分临界值、灵敏度和特异度,通过ROC曲线图比较二者的差异。以P<0.05为差异有统计学意义。
2 结果
41例患者均遵照直肠癌诊疗指南行全直肠系膜切除术,术后病理HE染色存在脉管瘤栓共14例,免疫组化染色结果显示表达淋巴管内皮标志物D2-40阳性11例,血管内皮标志物CD31/CD34阳性7例(见图1)。41例患者影像评价及病理资料见表2。DCE-MDCT和HR-MRI评价EMVI与病理结果的一致性呈中等(Kappa分别为0.485、0.719,P<0.01),二者评价EMVI的敏感度、特异度和准确率见表3。通过ROC曲线图(见图2)分析DCE-MDCT评价直肠癌EMVI的ROC曲线下面积为0.590(95%CI:0.402~0.777,P=0.350),最佳临界评分值为3.5分,灵敏度和特异度分别为21.4%和92.6%;HR-MRI评价直肠癌EMVI的ROC曲线下面积为0.820(95%CI:0.685~0.955,P=0.001),最佳临界评分值为2.5分,灵敏度和特异度分别为85.7%和77.8%。
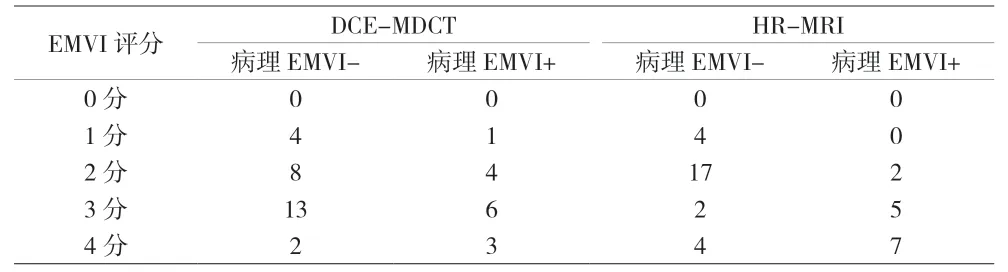
表2 41例直肠癌EMVI状态及影像评估

图2 DCE-MDCT及HR-MRI评价EMVI的ROC曲线图
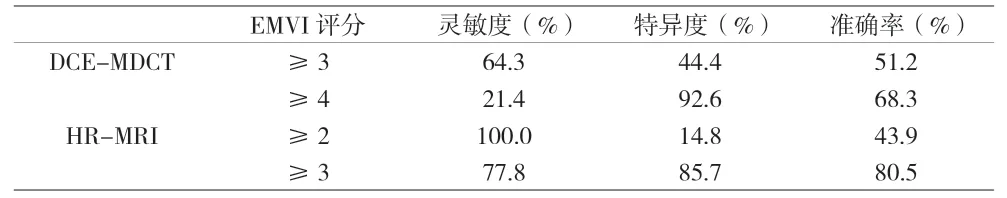
表3 DCE-MDCT及HR-MRI的诊断效能指标
3 讨论
目前,直肠癌术前影像评估方法中最为广泛使用的是NOUGARET等[5]提出的DISTANCE评估法,ALSUKHNI等[6]报道MRI对于直肠癌T分期的准确率、敏感度、特异度分别达85%、87%和75%,IANNICELLI[7]等分析N分期的准确性为60%~80%,其价值已逐渐被临床所认可。EMVI作为直肠癌TNM分期的强力补充,被认为是肿瘤局部复发及远处转移的独立危险因素,与患者生存期及生活质量密切相关[8]。研究显示[9],EMVI阳性的直肠癌,1年内转移率可达24.5%,而EMVI阴性的直肠癌患者1年的转移率仅为6.7%。肠壁固有肌层外脉管内出现恶性细胞,T3、T4术前EMVI阳性患者比阴性患者高出约4倍的远处转移风险,EMVI阳性的直肠癌患者在1年内发生异时性转移的风险提高3.7倍。因此,EMVI的评估现已被推荐为新辅助治疗的一项重要参考指标。
病理诊断中的脉管结构包括血管和淋巴管,SOHN等[10]认为大部分的脉管侵犯可能仅为淋巴管的侵犯。常规HE染色难以区分血管和淋巴管,免疫组织化学染色中血管内皮标志物CD31/CD34及淋巴管内皮标志物D2-40能够清晰的分辨其为血管或是淋巴管的侵犯。本组14例EMVI阳性中11例为淋巴管侵犯,7例为血管侵犯,与文献[10]报道一致,分析其原因可能为肿瘤与淋巴管接触机会大及肿瘤相关巨噬细胞所致炎性微环境相关[10,14]。
DCE-MDCT通过增强对比剂凸显出肠壁外管腔形态及密度改变等间接征象,HR-MRI则是依据高分辨率T2WI及DWI序列以周围脂肪的高信号为背景衬托出管腔内病灶的直接征象,两种方法皆为日常工作中最常用的检查方法,但也各具优劣势。本资料中,通过ROC曲线图分析显示HR-MRI在评价直肠癌EMVI状态的诊断效能中明显高于DCE-MDCT,HR-MRI评价最佳临界评分值低于DCE-MDCT。在CT评估中有36.6%的EMVI阴性患者被过高诊断为EMVI阳性,分析其原因可能与肿瘤周围血流异常,血管代偿性增粗所致的形态改变,或肠壁外管腔内密度减低并与肿瘤密度相近所致[11];12.2%的EMVI阳性患者在评估时被过低诊断,其原因可能与肠壁外管腔内肿瘤细胞少及局限于管壁内有关[12]。MRI评估时由于功能成像的存在,在评估时会更注重管腔内的T2WI异常信号及DWI序列进行对照。因此,当癌细胞未广泛浸润突破管壁时,MRI能更准确的显示其异常改变。这也与本资料中MRI评估2分与3分的准确性更高一致。
此外,14例EMVI阳性患者的CT和MRI特征,结合文献[13-14]分析其EMVI阳性的可靠征象:(1)当癌细胞局限于管壁内时,以高分辨率T2WI及DWI同时观察到异常信号准确性更高;(2)当癌细胞突破管壁至腔外时,表现为肠壁外连续走行的管腔呈现不规则的扩张,边缘以结节状突起多见,不同于肿瘤周围炎性反应所致的条索状突起及管腔均匀性扩张;(3)增强后显示肠壁外管腔内的充盈缺损,当腔内癌细胞较少时,此征象难以显示;(4)肿瘤周围管腔内壁凹凸不平,有助于EMVI阳性的诊断。既往未见类似报道,本资料中6例出现该征象,推测其病理基础为癌细胞沿管壁黏膜下浸润生长所致。
综上所述,HR-MRI在直肠癌术前评估EMVI状态有较好的鉴别能力,其评估结果可作为临床诊疗选择时的一项重要参考依据。
