肠壁增厚分层并定量分析对小肠坏死的诊断价值
2021-07-28葛权昌冷梅娜朱宝强林飞飞
葛权昌 冷梅娜 吴 华 李 慧 朱宝强 林飞飞
日照市中心医院影像科 (山东 日照 276800)
判断小肠梗阻是否肠壁缺血对于临床早诊断、早治疗有重要意义。目前,CT是诊断绞窄性肠梗阻的重要检查方法,既往学者对绞窄性肠梗阻中肠壁形态、密度、增强方式及肠系膜改变等CT征象有较多报道[1-8],其中肠壁增厚分层是较常见的CT征象,但是缺乏定量研究,本文回顾性分析47例肠梗阻患者的临床及CT资料,对增厚分层的肠壁行定量分析,以探讨对小肠缺血坏死的诊断价值。
1 资料与方法
1.1 临床资料收集2015年2月至2019年10月期间我院收治的小肠梗阻患者47例,纳入标准:CT图像显示小肠梗阻(肠腔扩张>3cm),且肠壁增厚分层(扩张状态下厚度>3mm);术前行CT平扫+增强,图像清晰;均经手术证实。
47例小肠梗阻患者中,男21例,女26例,年龄31~91岁,平均年龄(64.1±15.7)岁。所有患者临床均行急诊手术探查, 经手术病理证实肠缺血坏死18例(坏死组)、缺血但肠壁未坏死29例(缺血组),其中坏死组中继发性腹内疝8例、肠扭转2例、术后粘连带卡压4例、腹外疝3例、回肠脂肪瘤并套叠1例;缺血组中粘连性肠梗阻18例、炎性肠病3例、腹外疝2例、肠肿瘤5例、腹内疝1例。
1.2 检查方法使用西门子公司SOMATOM Definition双源CT机,术前行腹部CT平扫及增强扫描,扫描范围自膈顶水平至耻骨联合下缘水平,头足方向扫描,扫描参数:管电压120kV,自动管电流,增强扫描采用高压注射器以3.5mL/s的注射速率静脉注射碘海醇80~100mL,采用智能追踪法获得动脉期图像(触发阈值为70HU,圆形监测点置于膈顶水平降主动脉中心部),分别延时60s及3min获得静脉期及平衡期图像。
1.3 肠壁三层结构量化方法选取梗阻中段肠壁最厚处为感兴趣区域肠壁,把感兴趣区域肠壁在PACS工作站上局部放大,根据增厚肠壁的密度差异由内而外分别定义为内层(粘膜层)、中层(粘膜下层)、外层(固有肌层和浆膜层),在每层结构上标记3个圆形ROI点(直径不超过对应肠壁每层结构的厚度),尽量维持平扫和增强3个点位置相同,取3个点平扫和增强CT值的平均值,并把增强与平扫的CT值差作为增强幅度。由于本文重点研究肠壁各层结构的密度改变,而增强扫描静脉期恰好是肠壁强化实质期,因此选择测量静脉期CT值。
1.4 外科手术参考标准外科手术中,把小肠从梗阻部位释放出来,在其系膜根部注射0.5%普鲁卡因缓解血管痉挛,同时充分吸氧、维持血容量稳定,用温盐水热敷15~30min后观察,如肠壁蠕动恢复、颜色转为正常,动脉搏动可见,表明解除梗阻原因血运恢复正常归为缺血组,反之则认为肠壁坏死归为坏死组,并切除病变段小肠送病理。
1.5 统计学方法使用IBM SPSS Statistics 19统计学软件分析数据,采用独立样本t检验对坏死组和缺血组肠壁三层结构的平扫CT值、增强CT值及增强幅度进行比较,P<0.05为差异有统计学意义。对有差异的数值采用ROC曲线分析对肠缺血坏死的诊断效能,“约登指数”确定最佳界值。
2 结 果
2.1 肠坏死组和缺血组对比结果47例小肠梗阻患者均有不同程度肠壁增厚、分层,CT上表现为“靶征”(图1、图2)。经临床手术探查,与手术病理结果对照,分别测量肠坏死18例和缺血非坏死29例患者肠壁三层结构的平扫CT值、增强CT值及增强幅度,对比分析显示,肠壁三层结构的平扫CT值均无统计学差异,而增强CT值和增强幅度有明显差异(P<0.05,表1)。
表1 坏死组与缺血组的各项参数比较(±s)
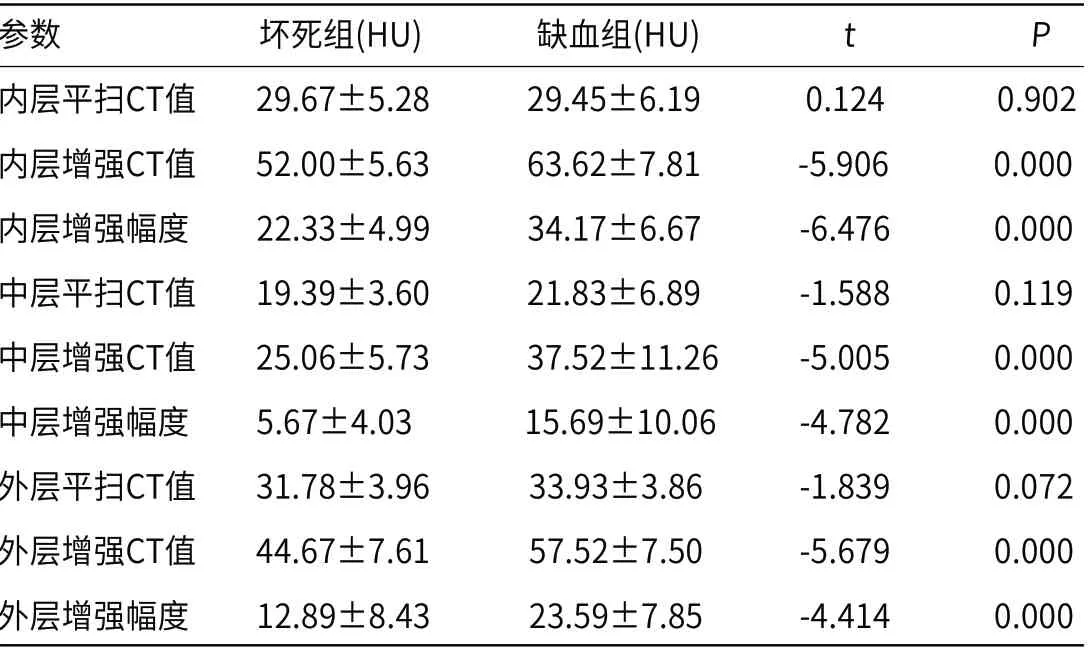
表1 坏死组与缺血组的各项参数比较(±s)
参数 坏死组(HU) 缺血组(HU) t P内层平扫CT值 29.67±5.28 29.45±6.19 0.124 0.902内层增强CT值 52.00±5.63 63.62±7.81 -5.906 0.000内层增强幅度 22.33±4.99 34.17±6.67 -6.476 0.000中层平扫CT值 19.39±3.60 21.83±6.89 -1.588 0.119中层增强CT值 25.06±5.73 37.52±11.26 -5.005 0.000中层增强幅度 5.67±4.03 15.69±10.06 -4.782 0.000外层平扫CT值 31.78±3.96 33.93±3.86 -1.839 0.072外层增强CT值 44.67±7.61 57.52±7.50 -5.679 0.000外层增强幅度 12.89±8.43 23.59±7.85 -4.414 0.000

图1 女,83岁,继发性腹内疝。CT平扫(1A)及增强扫描(1B)示肠壁环形增厚,密度减低,呈“靶征”(白箭),肠腔内见气-液平面。图2 男,49岁,粘连性肠梗阻。图2A:示肠腔扩张、积液,局部肠壁均匀增厚(白箭),图2B:示增厚肠壁三层结构,由内而外分别为粘膜层(黑箭)、粘膜下层(空心箭)、固有肌层(白箭)。
2.2 ROC曲线分析诊断效能对肠壁三层结构的增强CT值和增强幅度绘制ROC曲线(图3),计算AUC分别为0.890、0.949、0.836、0.813、0.888、0.833(表2),以肠壁内层的增强幅度诊断小肠梗阻并肠壁缺血坏死准确性最高,最佳界值为28.0HU,诊断肠缺血坏死的敏感性为94.4%、特异性为82.8%。
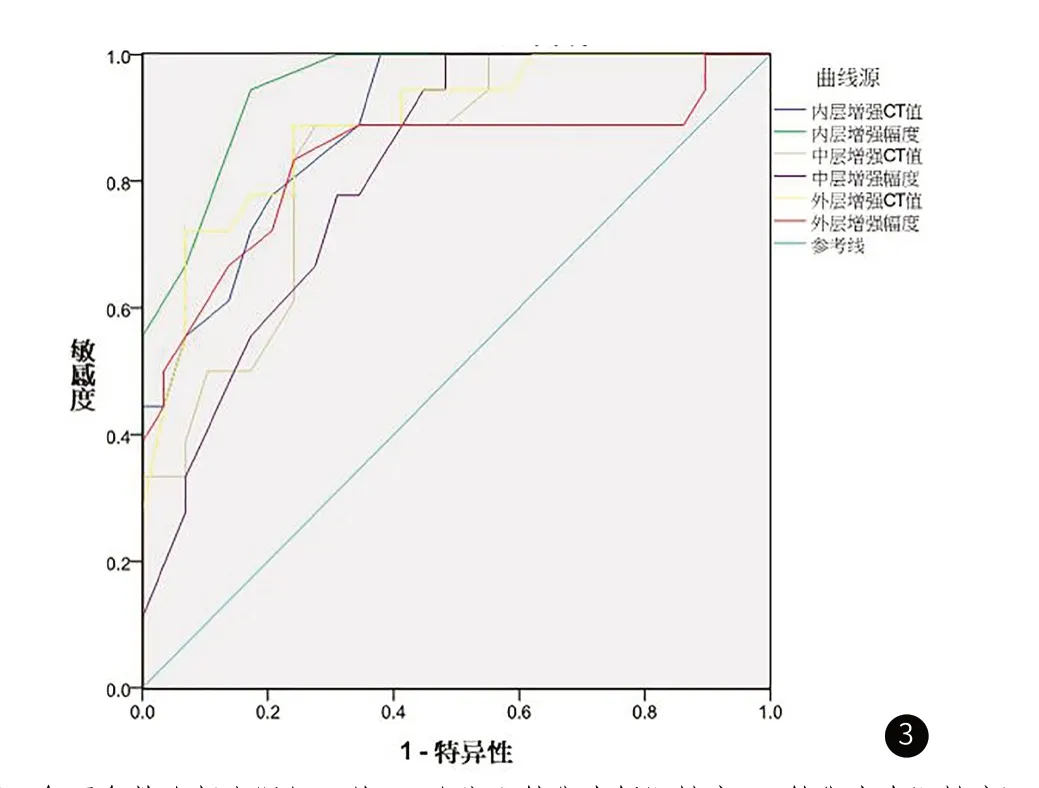
图3 各项参数诊断小肠坏死的ROC曲线(X轴代表假阳性率,Y轴代表真阳性率)
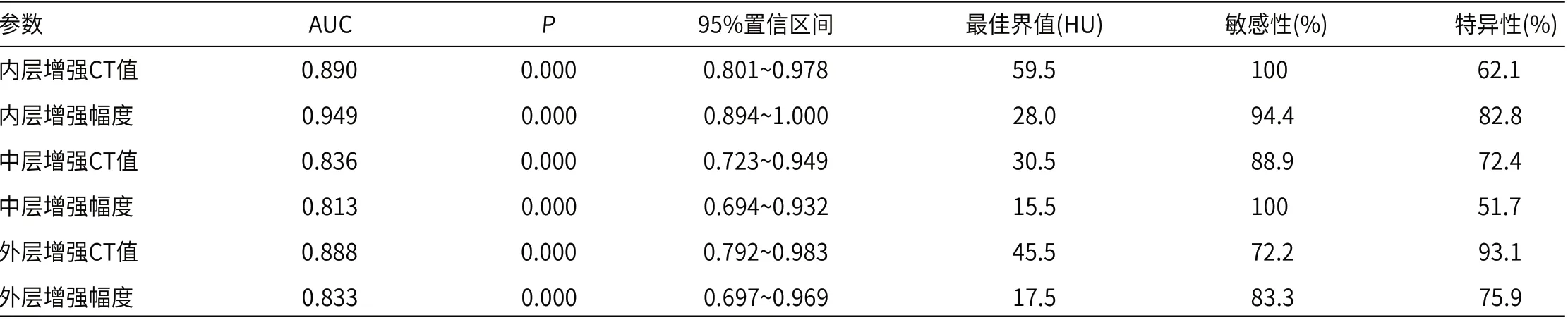
表2 各项参数对小肠坏死的诊断效能
3 讨 论
肠壁血运障碍是小肠梗阻患者常见且严重的并发症,当肠壁处于早期可逆性缺血阶段,及早外科手术解除梗阻,能避免小肠坏死,降低死亡率。因此,鉴别小肠梗阻患者是否肠壁缺血有重要临床意义。
依据病理基础将小肠肠壁缺血分为三期[5],在淤血水肿期主要是静脉回流受阻,从而导致肠壁水肿,以粘膜下层为主,此时CT上表现为肠壁增厚,多层环状改变,形似多个靶环,称为“靶征”,解剖上内层为粘膜层,中层为粘膜下层,外层为固有肌层和浆膜层。“靶征”是小肠肠壁缺血常见的CT征象之一,较多研究认为此征象诊断小肠缺血特异性较高,但是既往学者观点并不一致[6,9]。肖运平等[1]则认为诊断绞窄性肠梗阻并无特异性。多种原因如Crohn氏病急性期、感染、单纯性肠梗阻等引起的肠壁水肿,亦可出现肠壁增厚分层[10]。本研究纳入47例小肠梗阻患者CT均出现“靶征”,对比分析显示,肠坏死组和缺血组中增强CT值和增强幅度存在明显差异,这表明绞窄性小肠梗阻和单纯性小肠梗阻均可出现“靶征”,但是在增强CT扫描中,增厚分层肠壁各层结构的量化指标存在差异性,可以预测肠壁是否缺血坏死。
本研究中肠壁各层结构的平扫CT值无统计学差异,在张小明等[11]的动物实验中也证实肠缺血各期平扫无差异,故CT平扫对早期肠壁缺血诊断价值不高,但是当小肠梗阻后血流灌注受到影响,即使在肠壁缺血的早期阶段,增强CT扫描也有差异。既往较多报道也认为增强CT扫描有重要价值,肠壁强化减弱是肠壁血运障碍的直接CT表现[2,4]。本研究以此典型征象为基础,对肠壁三层结构的强化程度细分量化,最大限度的避免主观因素的影响,更客观的评价小肠肠壁缺血的早期病理改变。采用ROC曲线分析显示,肠壁内层的增强幅度对诊断小肠缺血坏死的效能最高,AUC为0.949,最佳界值为28HU,其诊断小肠缺血坏死的敏感性为94.4%、特异性为82.8%,这与肠壁缺血早期阶段以粘膜层缺血为主的病理改变是一致的。然而张婷等[7]认为单凭内层密度改变难以鉴别单纯性和绞窄性肠梗阻,与本文观点不一致,分析原因可能是研究方法不同,本文是比较了坏死组和非坏死组中增厚肠壁各层结构量化指标的差异,而张婷等[7]则是以正常小肠为参考标准定义内层密度改变。
肠壁缺血损伤受其敏感性、缺血时间、缺血程度及侧支循环等多重因素影响,因此,CT表现具有复杂性,综合分析多个CT征象并结合临床非常重要,尤其在早期阶段缺乏典型CT表现时,应密切观察患者病情,若病情加重及时复查CT尤为重要。
本研究存在的不足:由于肠道蠕动导致标记点难以完全维持在同一位置;肠道内容物可能干扰测量CT值的准确性;从CT检查到外科手术存在时间差,可能影响分组的准确性;选取样本较小。
总之,肠壁增厚分层并对各层结构在增强CT扫描中的差异进行量化分析,能早期预测肠壁缺血状态[12],以肠壁粘膜层的增强幅度预测小肠缺血坏死价值最高,能为临床提供有价值的信息,减少手术探查的盲目性。
