组蛋白去乙酰化酶2在肝细胞癌组织中的表达及其临床意义
2021-03-28陈仲林丽燕程变巧林仁河蒋小玲
陈仲林丽燕 程变巧 林仁河 蒋小玲
作者单位:350007 福州 1厦门大学附属福州第二医院神经内科;350014 福州 2福建医科大学附属肿瘤医院,福建省肿瘤医院病理科;350007 福州 3厦门大学附属福州第二医院肝胆内科
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的恶性肿瘤,全球每年新发肝癌病例约840 000例,死亡病例约780 000例[1-2]。手术、肝移植、化疗、局部放疗等是治疗肝癌的主要措施,但肝癌起病隐匿且尚缺乏特异性的早期检测指标,大部分患者确诊时已处于晚期,失去手术治疗机会,预后不良[3]。索拉非尼是晚期肝癌患者的主要治疗药物,可以显著延长中位生存期,但治疗后期常出现药物耐受,且费用昂贵[4]。因此亟需探寻可应用于肝癌早期诊断、反映疾病预后的指标及开发新的治疗手段。
组蛋白去乙酰化酶(histone deacetylase,HDAC)是表观遗传学中组蛋白修饰的重要蛋白酶,对染色体结构修饰和基因表达调控具有重要作用,在多种肿瘤中异常表达,并可促进肿瘤细胞增殖并抑制细胞凋亡、促进血管增生[5-6]。HDAC抑制剂(inhibitors of HDACs,HDACi)也是具有前景的抗肿瘤治疗手段。但是HDACi在靶向特定酶方面尚缺乏特异性,可能导致广泛的副作用。因此,在HCC组织中确定具有应用前景的HDACs类型,进而开发新的靶向治疗药物具有重要的临床意义。本研究通过检测人HCC组织中组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)的表达情况,探讨其表达水平与HCC患者临床病理学参数及预后的关系,为寻找新的HCC预后标志物和治疗靶点提供依据。
1 资料与方法
1.1 研究对象
选择2011年1月至2013年12月于厦门大学附属福州第二医院确诊并行根治性切除术的142例HCC患者为研究对象,收集癌和癌旁组织(距肿瘤边缘1 cm以上)石蜡样本,所有患者均有完整的临床病理资料。收集2018年6月至2018年10月手术切除的配对新鲜HCC组织及癌旁组织8例,离体后30 min内置于-70℃冰箱内保存,作为后续蛋白提取。所有患者均经术后组织病理学诊断为HCC,术前均未接受化疗、放疗等辅助治疗。本研究经厦门大学附属福州第二医院伦理委员会批准,患者知情同意。
1.2 Western blot实验检测HDAC2蛋白表达
分别取100 mg新鲜HCC及癌旁组织,加入RIPA裂解液提取组织蛋白,用BCA法测定蛋白浓度,加入制备好的SDS-PAGE上样缓冲液,经电泳、转膜后,置于脱脂牛奶中室温封闭2 h,孵育稀释的一抗HDAC2(稀释比例1∶1 000,购自美国Abcam公司),4℃过夜,TBST洗膜后,室温孵育辣根过氧化物酶(HRP)标记的二抗β-actin(稀释比例1∶2 000,购自美国Abcam公司)2 h,经ECL荧光底物反应后,胶片曝光显影,扫描灰度。目的蛋白与内参灰度的比值即为目的蛋白的相对表达量。
1.3 免疫组化检测HDAC2蛋白表达
1.3.1 免疫组化染色 采用EliVision plus两步法对HCC石蜡组织样本中的HDAC2蛋白进行免疫组化分析。所有石蜡切片常规烤片、脱蜡、水化后,用柠檬酸热修复法进行抗原修复,3%过氧化氢封闭20 min阻断内源性过氧化物酶,滴加稀释的一抗HDAC2(1∶100),37 ℃湿盒内孵育 1 h,PBS 洗涤后加入试剂A(增强剂),37℃湿盒内孵育20 min;PBS洗涤后加入二抗(酶标羊抗鼠/兔聚合物),37℃湿盒孵育30 min;PBS再次充分洗涤后DAB显色,苏木素复染1 min,1%盐酸酒精分化3 s,冲水返蓝10 min梯度酒精、二甲苯脱水,切片风干后用中性树胶封片。采用PBS代替一抗作为阴性对照。
1.3.2 免疫组化结果判读 免疫组化结果由2位病理科医师进行双盲阅片、评定。按染色强度和阳性细胞比例综合评分。HDAC2蛋白阳性定位在细胞核上。染色强度评分定义:无色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。阳性细胞数比例评分在400倍视野下按阳性细胞数比例评定:0分为无阳性细胞;1分为阳性细胞比例<25%;2分为阳性细胞比例为26%~50%;3分为阳性细胞比例为51%~75%;4分为阳性细胞比例>75%。最终结果由染色强度评分和阳性细胞数比例评分的乘积判定,0~4分为定义低表达,>4分为高表达。
1.4 TCGA数据库检索策略
检索 Ualcan网站(http://ualcan.path.uab.edu)基于TCGA数据库的HCC组织及癌旁组织中HDAC2 mRNA的表达情况及与预后的关系。
1.5 随访
术后开始随访,通过查询就诊记录及电话随访,每3个月随访1次,随访起止时间为2011年1月至2018年4月。无随访资料患者21例,随访期间,失访7例,随访率为94.2%。总生存期定义为从手术当日至患者死亡或末次随访的时间。
1.6 统计学方法
采用SPSS 20.0软件进行数据分析。HCC癌组织与癌旁组织中HDAC2蛋白的表达比较采用配对t检验。HDAC2蛋白表达水平与HCC患者一般临床资料的关系采用χ2检验,Kaplan-Meier法绘制生存曲线,用Log-rank检验生存分析,多因素Cox回归探讨可能影响患者总生存期的独立预后因素,计算风险比(HR)及其对应的95%可信区间(CI)。P<0.05为差异有统计学意义。
2 结果
2.1 HDAC2在HCC组织和癌旁组织中的表达
检索TCGA数据库结果显示,在HCC组织(n=371)中HDAC2 mRNA的表达高于正常肝组织(n=50)(P<0.001),见图 1A。Western blot检测结果显示,HDAC2蛋白在8例HCC组织中的表达高于相应癌旁组织(P=0.025),见图1B。免疫组化检测结果显示,HDAC2蛋白主要定位于细胞核上,染色呈棕黄色,在癌组织中的表达也高于癌旁组织,见图2。

图1 HDAC2在HCC及癌旁组织中的表达Fig.1 Expression of HDAC2 in HCC and normal tissues

图2 HDAC2在HCC及癌旁组织中的表达(EliVisionplus,×200)Fig.2 Expression of HDAC2 in HCC and normal tissues(EliVision plus,×200)
2.2 HCC组织中HDAC2蛋白表达水平与临床病理特征的关系
在142例HCC组织中,HDAC2蛋白高表达率为81%(115/142),低表达率为19%(27/142)。HDAC2 蛋白表达与肿瘤分化程度、脉管侵犯及复发相关(均P<0.05),而与患者年龄、性别、肿瘤大小、TNM分期、包膜侵犯及肝硬化无关(均P>0.05),见表1。

表1 HDAC2蛋白表达水平与HCC患者临床病理特征的关系(n=142)Tab.1 Relationship between HDAC2 expression level and clinicopathological charactersitics of HCC patients(n=142)
2.3 HDAC2表达与HCC预后的关系
TCGA数据库显示,HCC组织中HDAC2 mRNA高表达患者预后较差(P<0.001),见图3A。121例HCC患者中,Kaplan-Meier单因素分析结果显示,HDAC2蛋白高表达患者1年、3年及5年生存率分别为75.5%、29.8%、5.3%,中位生存期为38个月;低表达患者1年、3年及5年生存率分别为100.0%、96.3%、44.4%,中位生存期为58个月。Log-rank检验显示,HDAC2高表达组患者总生存期低于低表达组,差异有统计学意义(χ2=19.245,P<0.001),见图 3B。
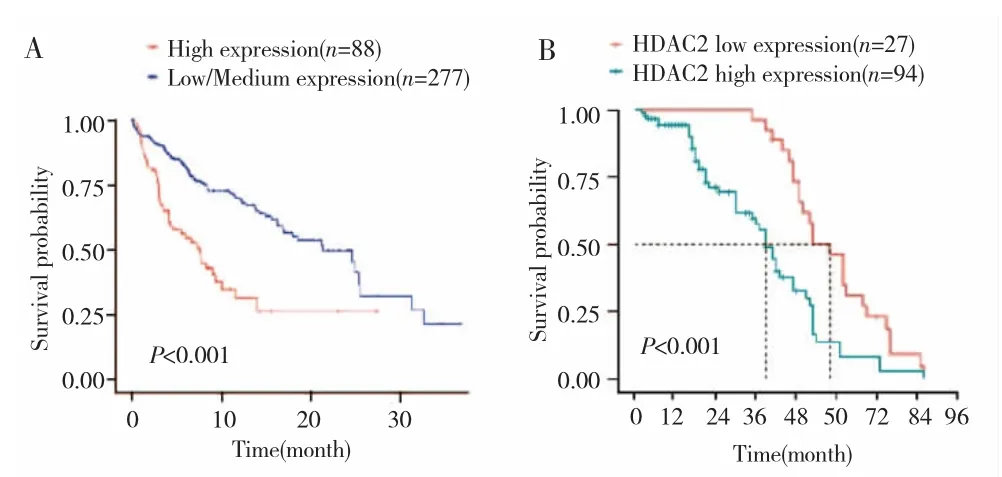
图3 HDAC2高表达与低表达HCC患者的生存曲线өFig.3 Survival curves of HCC patients with high and low expression of HDAC2
2.4 影响HCC患者术后总生存期的Cox回归分析
121例HCC患者中,单因素Cox回归分析显示,HDAC2蛋白高表达、肿瘤分化程度及脉管侵犯与HCC患者术后不良预后有关。多因素Cox回归分析显示,HDAC2高表达是HCC患者术后预后不良的独立危险因素(HR=12.255,95%CI:2.865~52.411),见表2。

表2 Cox回归分析影响HCC患者术后总生存期的因素Tab.2 Cox analysis to identify the prognostic factors affecting postoperative overall survival in HCC patients
3 讨论
HDACs通过使组蛋白N-末端的赖氨酸残基去乙酰化,促进组蛋白八聚体与带负电荷的DNA紧密结合,进而限制转录因子与RNA聚合酶Ⅱ结合,从而抑制基因转录[7]。HDACs分为4个亚家族,常受转录调节因子招募,通过失活抑癌基因启动子,抑制抑癌基因活性,在肿瘤侵袭和转移中发挥重要作用[8-9]。HDAC2属于Ⅰ型组蛋白去乙酰化酶家族成员,研究表明,HDAC2可以通过干扰肿瘤抑制基因p21位于启动子区域内的特异性蛋白1(Sp1)结合位点而抑制基因的活性[10]。HDAC2还可与SIN3形成复合物,与E-cadherin启动子结合后,抑制 E-cadherin表达,并促进 MMP表达和肿瘤侵袭[11]。HDAC2通过抑制p53和促进MYC表达还能抑制细胞凋亡和促进细胞周期进程[12-13]。在肝癌细胞中上调HDAC2表达后可抑制microRNA-449表达,并通过抑制C-MET mRNA表达促进细胞增殖,诱导细胞凋亡[14]。由此可见,HDAC2在肿瘤增殖和侵袭中具有重要作用。
LER团队在东南亚人群的研究结果显示,HDAC2在HCC中高表达[15]。也有研究报道HDAC2高表达是HCC患者预后不良的危险因素[16]。进一步通过Ualcan网站检索TCGA数据库,结果也发现,在HCC组织中HDAC2 mRNA的表达显著高于正常肝组织。本研究通过Western blot检测8例新鲜HCC组织和配对癌旁组织中HDAC2的表达,同样发现HCC组织中HDAC2表达高于癌旁组织,免疫组化检测结果也进一步证实了HDAC2在癌组织中高表达。HDAC2蛋白表达与HCC患者临床病理特征关系的分析结果显示,HDAC2蛋白在中低分化HCC组织中的表达高于高分化组,提示HDAC2表达可能与HCC增殖相关。此外,HDAC2表达还与脉管侵犯及复发有关,提示HDAC2也可能与肝癌侵袭及进展密切相关。进一步分析HDAC2表达与预后的关系,TCGA数据库显示,HCC组织中HDAC2 mRNA高表达的患者预后较差。临床样本的Kaplan-Meier分析显示HDAC2高表达患者的总体生存期缩短,多因素Cox回归分析结果证实HDAC2高表达是HCC患者术后预后不良的危险因素,说明HDAC2在HCC中具有重要的意义,靶向HDAC2可能是HDACi药物研究的新方向。
综上所述,HDAC2在HCC组织中高表达,并与肿瘤进展及不良预后相关,可能是HCC患者预后判断标志物及潜在的治疗靶点。
