苦参碱通过诱导miR-433-3p表达抑制食管鳞癌放射抵抗
2021-03-28刘颖冯达斌王绩钊张丞张露张明鑫陈南征
刘颖冯达斌 王绩钊 张丞 张露张明鑫 陈南征
作者单位:710061 西安 1西安交通大学第一附属医院肿瘤内科;711500 商洛 2镇安县人民医院胸外科;710061西安 3西安交通大学第一附属医院胸外科;710061 西安 4西安交通大学第一附属医院泌尿外科;710077西安 5西安医学院第一附属医院消化内科
食管鳞癌是我国常见的恶性肿瘤之一,目前缺乏有效的治疗措施[1]。放疗是食管鳞癌主要的治疗方式之一,尤其是对于丧失手术机会,如颈部及晚期食管鳞癌患者。但在放疗中患者常出现放射抗拒,导致治疗失败,仅15.6%~16.0% 的患者可获得完全缓解[2]。放疗联合靶向治疗或免疫治疗亦尚不能有效延长食管鳞癌患者生存期[3-5]。近年来,中药提取物在肿瘤防治中的作用被越来越多报道。苦参碱(Matrine)属喹诺里西啶类,是中药苦参含量最高的生物碱成分。有研究发现苦参碱通过抑制肝癌细胞中的AKT/GSK3β/βcatenin信号通路降低β-catenin转录活性,从而抑制肝癌细胞增殖能力[6]。也有研究报道苦参碱可增强人宫颈癌细胞对放射性的敏感性[7]。在食管癌中,苦参碱也已被报道可抑制食管鳞癌细胞增殖能力并诱导细胞凋亡[8]。而临床应用复方苦参注射液可降低食管癌的急性放疗副作用[9]。但复方苦参能否改善食管鳞癌的放疗效果及其分子机制,目前仍少有研究报道。本研究通过构建放射抵抗食管鳞癌细胞株,探讨苦参碱是否参与调控食管鳞癌细胞的放射敏感性,为临床进一步提高其放疗疗效提供新的思路。
1 材料与方法
1.1 主要材料与试剂
食管鳞癌细胞Eca-109及正常食管上皮细胞HEEC均购自中国科学院典型培养物保藏委员会细胞库。DMEM培养基及10%胎牛血清购自美国Gibco公司。SYBR Premix Dimmer Eraser Kit、The NucleoSpin miRNA Kit和Mir-X miRNA qRT-PCR TB Green Kit均购自日本TaKaRa公司。RAD21抗体及二抗购自美国CST公司。miR-433-3p过表达、miR-433-3p敲减、RAD21过表达、RAD21敲减慢病毒及相应的对照病毒均购自上海吉凯基因医学科技股份有限公司。
1.2 细胞转染及分组
食管鳞癌放疗抵抗细胞Eca-109R为本课题组前期构建。Eca-109R、Eca-109及HEEC细胞用DMEM培养基及10%胎牛血清,在37℃、5% CO2、95%湿度培养箱中培养。
按照操作指南,使用TransFast Transfection Reagent辅助转染目的细胞,构建miR-433-3p过表达、miR-433-3p敲减、RAD21过表达、RAD21敲减的Eca-109R细胞及相应的对照细胞。采用qRT-PCR检测转染情况,嘌呤霉素筛选稳定转染细胞株。实验分组:不同剂量照射组为分别经 0 Gy、2 Gy、4 Gy、6 Gy及 8 Gy 剂量照射的转染前后的Eca-109和Eca-109R细胞;不同浓度苦参碱处理组分别以0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL和5.0 mg/mL苦参碱处理转染前后的Eca-109和Eca-109R细胞,设未经处理的相应对照组。
1.3 qRT-PCR检测RAD21和miR-433-3p的表达
用Trizol试剂盒提取目的细胞的总RNA。RAD21用GoScript反转录系统建立cDNA;利用SYBR Premix Dimmer Eraser Kit完成qRT-PCR,以GADPH为内参。miR-433-3p用The NucleoSpin miRNA Kit完成microRNA纯化,Mir-X miRNA qRT-PCR TB Green Kit进行qRT-PCR,U6为内参。PCR 反应条件:95℃ 15 s;60℃1min,40个循环。采用2-ΔΔCt法计算目的基因的表达。引物序列:RAD21Forward为 5′-GGATAAGAAGCTAACCAAAGCCC-3′,Reverse 为 5′-CTCCCAGTAAGAGATGTCCTGAT-3′;miR-433-3p Forward 为 5′-GGAGAAGTACGGTGAGCCTGT-3′,Reverse 为 5′-GAACACCGAGGAGCCCATCAT-3′;GAPDH Forward 为 5′-ACAGCCTCAAGATCATCAGC-3′,Reverse 为 5′-GGTCATGAGTCCTTCCACGAT-3′;U6 Forward 为 5′-CTCGCTTCGGCAGCACA-3′,Reverse 为5′-TCATCCAAATACTCCACACGC-3′。
1.4 Western blot检测RAD21蛋白表达
用RIPA获取细胞总蛋白,SDS-聚丙烯酰胺凝胶分离,转至PVDF膜上。室温条件下以TBST及5%脱脂牛奶封闭 1 h,加入 RAD21一抗(1∶1 000)4 ℃孵育过夜,次日与二抗(1∶4 000)孵育1 h。使用ECL试剂显影,应用Image J图像分析软件,以GAPDH内参照,计算相对蛋白表达量。
1.5 CCK-8检测细胞活性
取 100 μL目的细胞悬液,以 1×105/孔接种于96孔板中。每个实验组设置3个复孔,设置3个对照组复孔,加入PBS。分别于培养24 h、48 h、72 h、96 h及120 h时每孔加入20 μL CCK-8溶液(5 mg/mL),用酶标仪测定450 nm处的光密度(OD)值,分别计算各组细胞存活率并绘制细胞生存曲线,通过生存曲线计算苦参碱抑制的IC50。
1.6 双荧光素酶报告基因实验验证miR-433-3p与RAD21的靶向关系
构建含有 RAD21 3′UTR野生型(Wt)及突变型(Mut)的荧光素酶报告基因,质粒载体为pmirGLO。突变型突变位点参考RAD21 3′UTR与miR-433-3p的结合位点。将RAD21-Wt及RAD21-Mut分别与miR-433-3p及对照病毒(NC)在Eca-109细胞中共转染,具体转染分组如下:⑴RAD21-Wt及miR-433-3p共转染;⑵RAD21-Wt及NC共转染;⑶RAD21-Mut及miR-433-3p共转染;⑷RAD21-Mut及NC共转染。检测转染48 h后细胞的萤火虫荧光值;所有荧光值均用海肾荧光值标准化。
1.7 统计学方法
采用R 3.3.1进行统计分析。计量资料以均数±标准差(±s)表示。采用配对样本t检验分析Eca-109R与其亲本Eca-109细胞的qRT-PCR结果。使用独立样本t检验分析其他分组情况的qRT-PCR及双荧光素酶报告基因实验结果。使用重复测量方差检验分析CCK-8结果。取双侧P值,P<0.05为差异有统计学意义。
2 结果
2.1 苦参碱对Eca-109R细胞活性的影响
经不同剂量(0 Gy、2 Gy、4 Gy、6 Gy 及 8 Gy)照射后,Eca-109R细胞活性较Eca-109细胞明显增强(P<0.05),见图1A。经不同浓度(0.5 mg/mL、1.0 mg/mL,2.0 mg/mL、3.0 mg/mL、4.0 mg/mL 和 5.0 mg/mL)苦参碱处理后,Eca-109R细胞活性被抑制,其IC50为0.41 mg/mL,见图1B。用0.41 mg/mL苦参碱处理Eca-109R细胞,在不同剂量照射下,苦参碱处理组的Eca-109R细胞活性低于未加入苦参碱的对照组细胞(P<0.05),见图 1C。
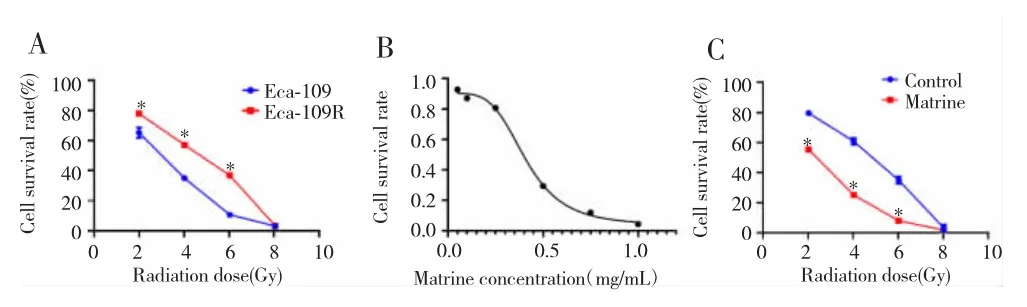
图1 苦参碱对Eca-109R细胞活性的影响Fig.1 The influence of Matrine on cell viability of radio-resistant Eca-109R cells
2.2 miR-433-3p对Eca-109R细胞活性的影响
qRT-PCR检测结果显示,miR-433-3p在Eca-109细胞中的表达低于HEEC细胞(P<0.05),见图2A。在Eca-109R细胞中miR-433-3p的表达也较亲本细胞Eca-109表达降低(P<0.05),见图 2B。过表达miR-433-3p后 Eca-109R细胞活性明显降低(P<0.05),见图2C;敲减miR-433-3p表达后Eca-109R细胞活性增强(P<0.05),见图 2D。不同剂量照射后,miR-433-3p过表达显著抑制Eca-109R细胞活性(P<0.05),见图2E;敲减 miR-433-3p则增强Eca-109R细胞活性(P<0.05),见图2F。
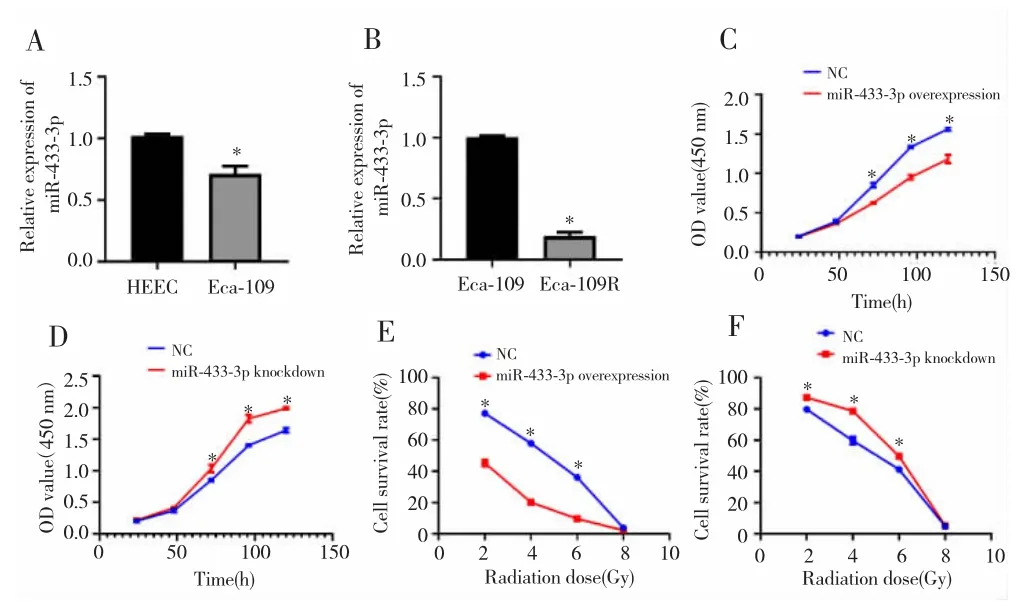
图2 miR-433-3p参与调控Eca-109R细胞放射抵抗Fig.2 miR-433-3p was involved in regulating radio-resistance of Eca-109R cell
2.3 RAD21对Eca-109R细胞活性的影响
qRT-PCR及Western blot检测结果显示,RAD21在Eca-109R细胞中的表达高于亲本Eca-109细胞(P<0.05),见图 3A~B。敲减 RAD21 后,Eca-109R 细胞活性降低(P<0.05),见图 3C;过表达 RAD21 后,Eca-109R细胞活性明显增强(P<0.05),见图3D。不同剂量照射后,RAD21敲减明显降低Eca-109R细胞活性(P<0.05),见图3E;RAD21过表达则增强Eca-109R细胞活性(P<0.05),见图3F。
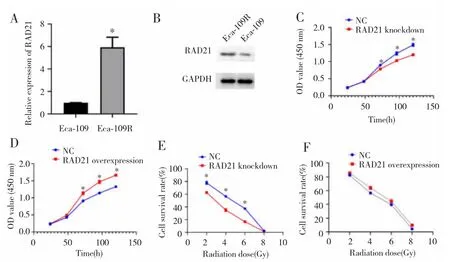
图3 RAD21参与调控Eca-109R细胞放射抵抗Fig.3 RAD21 was involved in regulating radio-resistance of Eca-109R cells
2.4 miR-433-3p与RAD21的相互作用
在Eca-109R细胞中过表达miR-433-3p后,RAD21表达下调,见图4A;而敲减miR-433-3p后,RAD21表达升高,见图4B。进一步双荧光素酶报告基因实验显示,RAD21-Wt+miR-433-3p组荧光素活性显著降低,而RAD21-Mut+miR-433-3p组荧光活性未发生明显改变,提示miR-433-3p可能与RAD21的3′UTR区域相互作用,见图4C。过表达RAD21可以逆转miR-433-3p对Eca-109R细胞活性的抑制作用(miR-433-3p vs miR-433-3p+RAD21,F=4.554,P<0.05),见图 4D。
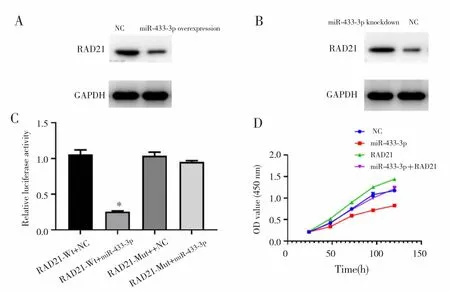
图4 miR-433-3p与RAD21的相互作用Fig.4 The crosstalk between miR-433-3p and RAD21
2.5 苦参碱在Eca-109R细胞中通过调控miR-433-3p/RAD21发挥生物学功能
用0.41 mg/mL苦参碱处理Eca-109R细胞后,miR-433-3p表达较未处理组明显升高(P<0.05),见图 5A;RAD21蛋白表达下降(P<0.05),见图 5B。苦参碱能够解除miR-433-3p敲减对Eca-109R细胞活性的促进作用(F=5.213,P<0.05),见图 5C。苦参碱处理后,敲减miR-433-3p的Eca-109R细胞中RAD21表达较未处理Eca-109R细胞降低(P<0.05),见图5D。
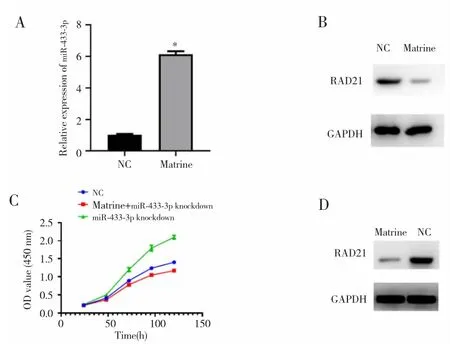
图5 苦参碱在Eca-109R细胞中通过调控miR-433-3p/RAD21发挥生物学功能Fig.5 Matrine regulated Eca-109R cells biological function by regulating miR-433-3p/RAD21
3 讨论
既往研究发现,苦参碱可以通过调控肿瘤细胞中microRNA的表达,发挥相应的生物学功能。有研究用microRNA芯片检测苦参碱作用的胃癌细胞SGC-7901中的microRNA表达变化,发现共有128种miRNAs差异表达,且这些差异表达的microRNAs的生物学功能主要富集在细胞周期调控及MAPK信号通路,参与调控肿瘤进展[10]。LIAO 等[11]也发现,苦参碱作用于肺癌细胞后可上调其miR-133的表达,进而抑制EGFR/Akt/MMP-9通路激活。ZHAO等[12]用苦参碱处理甲状腺癌细胞后发现其可介导miR-21表达下调,且通过miR-21/PTEN/Akt信号通路抑制甲状腺癌细胞的活性。本研究发现,不同浓度苦参碱处理Eca-109R细胞后,Eca-109R细胞活性均受抑制,而敲减miR-433-3p能增强Eca-109R细胞活性,用0.41 mg/mL苦参碱处理Eca-109R细胞后发现能够解除miR-433-3p敲减对Eca-109R细胞活性的促进作用。说明在食管鳞癌细胞中,苦参碱可能通过上调miR-433-3p,增强食管鳞癌的放射敏感性。
miR-433-3p在多种肿瘤中被报道发挥抑癌作用。SUN等[13]在胶质瘤细胞中过表达miR-433-3p,可以显著抑制胶质瘤细胞的体内外增殖能力,及侵袭迁移能力。miR-433-3p通过靶向作用于CREB,在体内外水平增加胶质瘤对替莫唑胺的敏感性。同样,SHI等[14]在食管癌中也发现,过表达miR-433-3p可以抑制食管鳞癌的体外增殖和侵袭能力。RAD21是DNA损伤修复的关键蛋白,一般通过同源重组修复途径参与DNA双链断裂修复;RAD21还可与单链DNA末端结合,介导DNA与DNA的相互作用,协同同源重组修复相关蛋白Rad51参与同源重组修复途径,与放疗敏感性相关[15]。RAD21在肝细胞肝癌中被发现可促进放射线诱导的DNA损伤修复过程,降低肝细胞肝癌对放射治疗的敏感性[16]。RAD21敲减后的消化道肿瘤小鼠模型也对全身照射更加敏感[17]。因此推测RAD21可能作为miR-433-3p的下游基因而介导食管癌的放射抵抗。本研究通过双荧光素酶报告基因实验验证miR-433-3p可作用于RAD21的3′UTR,并下调RAD21,且不管是敲减RAD21还是经不同剂量照射后敲减RAD21,Eca-109R细胞的活性均被被抑制,而过表达RAD21可以逆转miR-433-3p对Eca-109R细胞活性的抑制作用,说明下调RAD21可以增强Eca-109R细胞放射敏感性,而miR-433-3p可能通过靶向负调控RAD21发挥抑癌作用。
综上所述,苦参碱可以抑制放射抵抗食管鳞癌细胞Eca-109R的增殖能力,并增加Eca-109R细胞对电离辐射的敏感性。苦参碱可能通过调控miR-433-3p/RAD21信号通路,影响食管鳞癌的同源重组修复过程,从而增强其电离辐射敏感性。
