食管鳞癌细胞外泌体中miR-130a对血管新生的作用及其机制
2021-03-28郑森元刘芳赫晓磊张志强
郑森元 刘芳 赫晓磊 张志强
作者单位:830054 乌鲁木齐 1新疆医科大学第一附属医院消化病二科;2新疆医科大学第五附属医院老年病科
食管鳞癌是食管癌最常见的分型,因临床症状不明显且缺乏早期诊断标志物,大部分患者确诊时往往已处于中晚期,即使术后患者预后也仍较差,5年生存率低于20%[1-4]。因此,探索食管鳞癌发生发展机制,寻找新型有效的诊断和治疗靶点至关重要。外泌体是一类由多种活细胞分泌的纳米级囊泡,稳定存在于体液中,可发挥细胞间信息传递的作用[5-6],其中肿瘤细胞外泌体可在肿瘤微环境中调控免疫细胞、成纤维细胞、血管内皮细胞而影响肿瘤的生长、转移、免疫逃逸、血管新生等[7-8]。多种外泌体miRNA已被报道能够通过调控血管内皮细胞功能而影响血管新生[9],其中miR-130a可调控血管内皮细胞迁移及血管形成能力,且已有研究指出外泌体中miR-130a可调控胃癌血管新生[10],然而其在食管鳞癌中的研究尚未见报道。本研究通过差速离心法提取食管鳞癌细胞的外泌体并探讨外泌体中的miR-130a在血管新生中的作用及机制,以期为食管鳞癌诊断和治疗提供新的思路。
1 材料与方法
1.1 主要材料及试剂
食管鳞癌细胞TE-13和Eca-109,食管上皮细胞HEEC,人脐静脉血管内皮细胞HUVEC均购自中科院上海细胞库;HiPerFect Transfection Reagent购自QIAZEN公司;miRNA cDNA合成试剂盒、EvaGreen miRNA qPCR MasterMix购自加拿大Abm公司;Matrigel胶、Transwell小室购自福麦斯生物技术有限公司;CD9、CD63、TSG101抗体购自武汉三鹰生物技术有限公司;p-PI3K、PI3K、p-AKT、AKT、GAPDH、山羊抗兔二抗购自沈阳万类生物技术有限公司;miR-130a mimic、miR-130a inhibitor及其阴性对照(NC)均购自汉恒生物技术有限公司。
1.2 细胞培养及转染
TE-13细胞、Eca-109细胞和HEEC细胞于含10%胎牛血清的RPMI 1640培养基中培养,HUVEC细胞培养于含10%胎牛血清及1%内皮细胞生长因子的ECM培养基中培养,隔天换液,待细胞生长至汇合率达80%时进行细胞传代,取对数生长期细胞用于后续实验。
将对数生长期的Eca-109细胞接种于24孔板(1.6×105/孔)中,按照 HiPerFect Trasfection Reagent说明书操作步骤分别转染miR-130a mimic、miR-130a inhibitor及NC,于37℃、5% CO2细胞培养箱中孵育24 h后更换新的培养基,继续培养24 h,备用。
1.3 外泌体的提取与鉴定
将对数生长期的HEEC、TE-13和Eca-109细胞,以及转染 miR-130a mimic、miR-130a inhibitor和 NC的Eca-109细胞分别接种于细胞培养皿,培养24 h后将培养基更换为含10%无外泌体胎牛血清的RPMI 1640培养基,48 h后收集上清液,根据差速离心法提取各组细胞的外泌体(即HEEC exo、TE-13 exo、Eca-109 exo、Eca-109/miR-130a mimic exo、Eca-109/miR-130a inhibitor exo、Eca-109/miR-130a NC exo),于-80℃冰箱保存。在透射电镜下观察外泌体的形态结构,Western blot检测外泌体标志蛋白CD9、CD63、TSG101的表达情况。
1.4 MTT法检测HUVEC细胞的增殖能力
将HUVEC细胞接种至96孔板(1×104/孔),待细胞贴壁后,分别加入含10 μg/mL的HEEC exo、TE-13 exo和Eca-109 exo及等体积PBS(或Eca-109/miR-130a mimic exo、Eca-109/miR-130a inhibitor exo、Eca-109/miR-130a NC exo)的完全培养基,每组设3个复孔。分别于培养0 h、24 h、48 h、72 h向每孔加入5 mg/mL的MTT溶液20 μL,孵育4 h后,每孔加入150 μL 二甲亚砜溶液继续培养,用酶标仪检测490 nm波长处的光密度(OD)值。以时间为横坐标,OD值为纵坐标,绘制细胞生长曲线。
1.5 小管形成实验检测HUVEC细胞的小管形成能力
选取对数生长期的HUVEC细胞,调整细胞密度至3×105/mL并接种至含Matrigel胶的96孔板(100 μL/孔)培养;待细胞贴壁后,每孔更换为含10 μg/mL的HEEC exo、TE-13 exo和 Eca-109 exo及等体积PBS(或 Eca-109/miR-130a mimic exo、Eca-109/miR-130a inhibitor exo、Eca-109/miR-130a NC exo)的完全培养基,每组设3个复孔,于37℃、5% CO2培养箱中培养6 h后,在显微镜下观察并拍照,比较各组小管拟态形成情况。实验重复3次。
1.6 Transwell小室实验检测HUVEC细胞的迁移能力
用不含胎牛血清及血管内皮生长因子的ECM培养基重悬 HUVEC 细胞(密度为 5×104/mL)后,取 200 μL细胞悬液接种至Transwell小室上室,每孔加入HEEC exo、TE-13 exo和 Eca-109 exo及等体积PBS(或Eca-109/miR-130a mimic exo、Eca-109/miR-130a inhibitor exo、Eca-109/miR-130a NC exo),并调整外泌体浓度至10 μg/mL;下室加入600 μL完全培养基,每组设3个复孔。于37℃、5% CO2培养箱中培养24 h后,取出小室,清洗,用甲醇固定30 min,结晶紫染色10 min,清洗并晾干后,于显微镜下观察、拍照并计数。实验重复3次。
1.7 qRT-PCR检测食管鳞癌外泌体中miR-130a的表达
用The exoRNeasy serum/Plasma Kit试剂盒提取各组细胞外泌体中的miRNA,按照miRNA cDNA Synthesis试剂盒说明书的操作步骤将提取的RNA逆转录为cDNA,并用核酸定量仪进行定量。根据EvaGreen miRNA qPCR试剂盒指示配置反应体系,进行qPCR反应,反应条件:95℃预热5 min;95℃反应15 s,60℃反应 30 s,72℃反应 30 s;反应序列:miR-130a Forward 为 5′-CATAAACATTGCCGTGGGAGAGC-3′,Reverse 为 5′-TCTGACTCTACCACAGC-3′;miR-39a Forward 为 5′-GCTCCCAAAGCCGTGGGATCGA-3′,Reverse为5′-CATACTCGGAGACTCT-3′。以miR-39 为内参,采用2-ΔΔCt法计算miR-130a mRNA的相对表达量。
1.8 Western blot检测HUVEC细胞中PTEN/PI3K/AKT信号通路相关因子的表达
用RIPA蛋白裂解液和PMSF蛋白酶抑制剂分别提取各组细胞的总蛋白,并用BCA进行蛋白定量,沸水浴加热变性后,行SDS-PAGE凝胶电泳并转膜,用5%脱脂牛奶封闭 2 h,分别加入 CD9、CD63、TSG101、p-PI3K、PI3K、p-AKT、AKT、PTEN、Ang1 和 iNOS 一抗(稀释比例均为1∶1 000),4℃孵育过夜,用TBST洗膜;加入二抗,室温孵育1.5 h,TBST洗膜后,加入ECL化学发光液显色,曝光并拍照。以GAPDH为内参,采用Image J软件对曝光结果进行定量分析。
1.9 统计学方法
采用Graphpad Prsim 8.0软件进行统计分析,计量数据以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用Bonferroni检验,双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 外泌体的鉴定结果
透射电镜观察结果显示,采用差速离心法所提取的HEEC、TE-13和Eca-109细胞外泌体均具有双层膜结构,形状呈“杯托”状,粒径分布在50~100 nm,符合外泌体的结构特征,见图1A。Western blot检测结果显示,HEEC、TE-13和Eca-109细胞外泌体均表达外泌体标志蛋白CD9、CD63、TSG101,符合外泌体的生物学特征,见图1B。

图1 HEEC、TE-13和Eca-109细胞外泌体的结构及相关标志蛋白的表达情况Fig.1 The morphology and expression of related marker proteins of HEEC,TE-13 and Eca-109 cell exosomes
2.2 食管鳞癌细胞外泌体对HUVEC细胞增殖、迁移及血管拟态形成的影响
MTT法、Transwell小室及小管形成实验检测结果显示,共培养后各组HUVEC细胞的增殖、迁移及小管形成数目比较差异均有统计学意义(F=189.80,472.10,43.50;均 P<0.001),其中与 PBS 组相比,HEEC exo组细胞增殖、迁移及小管形成数目差异均无统计学意义(P>0.05),但 TE-13 exo组和 Eca-109 exo组细胞的增殖、迁移及小管形成数目均明显升高(P<0.01)。见图2。
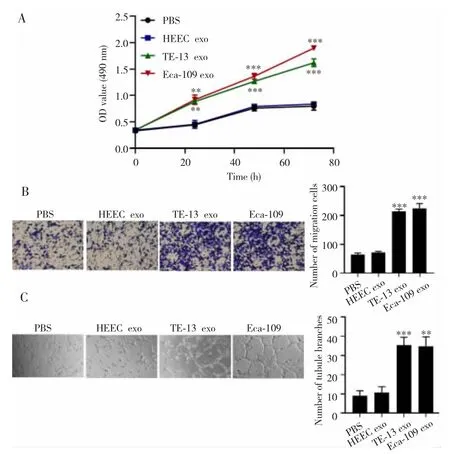
图2 食管鳞癌细胞外泌体对HUVEC细胞增殖、迁移及血管拟态形成的影响Fig.2 Effects of esophageal squamous cell carcinoma exosomes on the proliferation,migration and vascular mimicry of HUVEC cells
2.3 miR-130a在食管鳞癌细胞外泌体中的表达情况
qRT-PCR检测结果显示,HEEC、TE-13和Eca-109细胞外泌体中miR-130a的表达水平比较差异有统计学意义(F=91.24,P<0.001),其中 TE-13和 Eca-109细胞外泌体中miR-130a的表达水平均高于HEEC细胞(P<0.01),见图 3A。
Eca-109细胞分别转染 miR-130a mimic、miR-130a inhibitor和NC后,细胞外泌体均符合外泌体的生物学特征,3组细胞外泌体中miR-130a的表达水平差异有统计学意义(F=298.60,P<0.001),其中与Eca-109/miR-130a NC exo组相比,Eca-109/miR-130a mimic exo组中 miR-130a的表达水平上调(P<0.001),而Eca-109/miR-130a inhibitor exo组miR-130a的表达水平下调(P<0.001),见图3B~D。说明成功获得差异表达miR-130a的外泌体,可用于后续研究。

图3 miR-130a在食管鳞癌细胞外泌体中的表达Fig.3 Expression of miR-130a in exosomes of esophageal squamous cell carcinoma
2.4 食管鳞癌细胞外泌体中miR-130a对HUVEC细胞增殖、迁移及血管拟态形成的影响
差异表达miR-130a的外泌体与HUVEC共孵育后,MTT法、Transwell小室及小管形成实验检测结果显示,各组HUVEC细胞增殖、迁移细胞数差异有统计学意义(F=196.40,186.60,118.60;P<0.001)。其中,与Eca-109/miR-130a NC exo组相比,Eca-109/miR-130a mimic exo组HUVEC细胞的增殖、迁移细胞数及血管拟态形成能力均增强(P<0.01),Eca-109/miR-130a inhibitor exo组HUVEC细胞的增殖、迁移细胞数及血管拟态形成能力均降低(P<0.01)。见图4。

图4 食管鳞癌细胞外泌体中miR-130a对HUVEC细胞增殖、迁移及血管拟态形成能力的影响Fig.4 Effects of exosomal miR-130a in esophageal squamous cell carcinoma on the proliferation,migration and vascular mimicry formation of HUVEC cells
2.5 食管鳞癌细胞外泌体中的miR-130a可激活PTEN/PI3K/AKT信号通路
将PBS及各组外泌体与HUVEC细胞共孵育,Western blot检测结果显示,各组HUVEC细胞中PTEN表达水平、PI3K和AKT磷酸化水平及Ang1与iNOS的表达水平比较差异均有统计学意义(F=432.30,100.50,302.40,174.20,131.70;均 P<0.001),且 TE-13 exo 和Eca-109 exo组细胞PI3K和AKT磷酸化水平及Ang1与 iNOS的表达水平较 PBS组增加(P<0.001),PTEN表达水平较PBS组降低(P<0.001)。见图5A。
差异表达miR-130a的外泌体与HUVEC共孵育后,Western blot检测结果显示,各组HUVEC细胞中PTEN表达水平、PI3K和AKT磷酸化水平及Ang1和iNOS表达水平差异均有统计学意义(F=202.70,472.20,221.50,105.80,418.20;均 P<0.001)。与 Eca-109/miR-130a NC exo组相比,Eca-109/miR-130a mimic exo组HUVEC细胞PI3K与AKT磷酸化水平及Ang1与iNOS的表达水平显著上调(P<0.001),而PTEN表达水平下调(P<0.001);与 Eca-109/miR-130a NC exo组相比,Eca-109/miR-130a inhibitor exo组HUVEC细胞PI3K与AKT磷酸化水平及Ang1与iNOS的表达水平显著下调(P<0.001),而PTEN表达水平上调(P<0.001)。见图5B。

图5 食管鳞癌细胞外泌体中miR-130a对PTEN/PI3K/AKT信号通路的影响Fig.5 Effects of exosomal miR-130a in esophageal squamous cell carcinoma on PTEN/PI3K/AKT signaling pathway
3 讨论
血管是肿瘤微环境的重要组成部分,肿瘤微环境血管新生增加为肿瘤生长提供氧气和营养物质,且可促进肿瘤转移,因此抑制血管新生成为肿瘤治疗的重要措施[11]。肿瘤外泌体对肿瘤血管新生的调控作用主要是通过将肿瘤细胞的遗传物质,如miRNA、lncRNA、蛋白质等遗传物质转移至血管内皮细胞,调控其细胞增殖、迁移等功能,进而促进肿瘤微环境的血管新生[12-15]。miR-130a被报道可促进HUVEC细胞增殖和迁移并诱导肿瘤耐药[16-17]。本研究将食管鳞癌细胞外泌体与HUVEC细胞共孵育后,发现HUVEC细胞增殖和迁移能力及血管拟态形成增强,说明食管鳞癌细胞外泌体能够促进血管新生。进一步在食管鳞癌细胞外泌体中高表达miR-130a,同样发现可促进HUVEC细胞增殖、迁移以及小管形成,而抑制其表达则HUVEC细胞增殖、迁移以及小管形成受抑制,提示食管鳞癌细胞外泌体可能通过高表达miR-130a而促进血管新生。
PTEN/PI3K/AKT信号通路是调控肿瘤血管新生的重要信号通路,既往研究表明,激活PTEN/PI3K/AKT信号通路可促进下游Ang1、iNOS等促血管生成因子的表达,进而诱导肿瘤血管新生[18-21]。本研究发现高表达miR-130a的食管鳞癌细胞外泌体亦可显著抑制PTEN的表达,并且促进PTEN/PI3K/AKT信号通路激活,而抑制miR-130a表达则获得相反的结果,说明食管鳞癌细胞可能通过分泌高表达miR-130a的外泌体激活PTEN/PI3K/AKT信号通路,进而诱导血管新生。
综上所述,本研究初步证实食管鳞癌细胞能够通过分泌高表达miR-130a的外泌体而激活血管内皮细胞的PTEN/PI3K/AKT信号通路而诱导血管新生,但miR-130a发挥调控功能所调控的具体靶基因需进一步研究。
