依达拉奉右莰醇对大鼠液压冲击脑损伤模型的神经保护作用
2022-11-08唐会昌李忆蒙
徐 伟,张 山,唐会昌,李忆蒙
(邯郸市中心医院神经外四科,邯郸 056000;*通讯作者,E-mail:dpx699@163.com)
外伤性脑损伤是由于大脑受到直接的机械损伤而发生的,并引起中枢神经系统退化和神经元细胞死亡。颅脑外伤后不仅是最初的原发性损伤会导致脑功能障碍,在很大程度上也与继发性脑损伤密切相关,继发性脑损伤首先会产生一系列生化降解过程的损伤级联反应,主要包括氧化应激、炎症、凋亡和兴奋性氨基酸毒性等,致使神经细胞进一步受损或致死,因此避免继发性脑损伤引起的神经元死亡对脑组织起一定的保护作用,如何减轻神经损伤是临床亟待解决的重要课题[1,2]。目前临床上除少数患者需要手术治疗外,多强调维持营养、水、电解质、酸碱平衡等预防各种并发症。急需有效的治疗措施来降低脑组织破坏水平,减缓/抑制神经细胞的进一步损伤。依达拉奉是一种抗氧化剂和自由基清除剂,可清除多种自由基[3]。有研究显示[4,5],依达拉奉作为一种脑保护剂可减轻脑水肿,可能通过抑制脂质出现过氧化反应,捕获自由基数量减少,减少自由基浓度,保护神经细胞不被自由基损伤,从而降低危重型颅脑损伤病人的死亡率和致残率。右莰醇是双环单萜类化合物,可抑制炎性细胞因子的表达,进而可能减少细胞凋亡、坏死[6]。依达拉奉和右莰醇两种活性成分组成的复方制剂即为依达拉奉右莰醇,在依达拉奉和右莰醇以4 ∶1的配比联合应用时,研究发现可用于减轻急性脑梗死血管内治疗开通良好患者的神经损伤情况[7]以及应用于急性缺血性脑卒中的神经保护[8],但在颅脑外伤后脑损伤中的作用国内目前未见相关报道。基于此,本研究通过建立大鼠液压冲击脑创伤动物模型,并应用依达拉奉右莰醇进行干预,以此来证实依达拉奉右莰醇的神经保护作用。
1 材料和方法
1.1 实验动物
本研究选取大鼠购于河北医科大学实验动物中心,均为雄性SD大鼠,总共96只,年龄8~12周,体质量250~350 g,平均(304.7±8.6)g。在本实验开始前,于河北医科大学实验室动物房适应性喂养1周,相对湿度40%~70%,室温(25±2)℃,采用标准鼠饲料常规喂养,鼠饲料和饮水自由进食。本研究已经获得邯郸市中心医院医学伦理委员会批准,审查批件号[2021-(伦审)-056]。
1.2 动物分组及建模
将96只大鼠随机分为3组:假手术组、脑损伤组、依达拉奉右莰醇组,每组32只。采用河北医科大学第二医院孙国柱等[9]设计的液压冲击装置建立大鼠液压冲击脑损伤模型,打击强度(1.50±0.20)个大气压,造成中度脑损伤。大致步骤为:称重,随后腹腔注射10%水合氯醛麻醉大鼠,固定于手术台上,对大鼠头部去毛并消毒,剪开头皮、分离骨膜、暴露颅骨,采用牙科钻磨在颅骨上开一直径为5 mm的圆形骨窗。将自制打击管固定于圆形骨窗上,以待后续注入药物使用。假手术组大鼠只行麻醉后颅骨开窗,不行液压冲击处理。脑损伤组和依达拉奉右莰醇给药组将液压冲击仪强度调整为2.026×105Pa,随后再将打击管与液压冲击仪器连接,从而进行打击,大鼠出现四肢抽搐,有数秒呼吸抑制现象时提示建模成功。在建模成功后,依达拉奉右莰醇组大鼠用经尾静脉注射给药方法,每次剂量为3 mg/kg,于造模后12 h、24 h、3 d、7 d连续给药4次;假手术组和脑损伤组大鼠则给予注射等量生理盐水。
1.3 脑组织含水量测定
分别在造模后12 h、24 h、3 d、7 d采用腹腔注射10%水合氯醛麻醉大鼠,迅速处死大鼠,每组2只。脑组织含水量的测定采用干湿质量法。称取湿重前需用滤纸吸取表面水分,称取干重前则再将脑组织置于110 ℃恒温烤箱中烘烤24 h。脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.4 酶联免疫吸附试验(ELISA)检测炎性细胞因子水平
分别在造模后12 h、24 h、3 d、7 d采用腹腔注射10%水合氯醛麻醉大鼠,迅速处死大鼠,每组2只,取出血肿周围脑组织,加入0.9%生理盐水制成10%组织匀浆并在低温3 000 r/min离心20 min后取上清液,实验过程中严格按照大鼠ELISA试剂盒说明书进行操作。采用全自动酶标分析仪测定其吸光度值(波长为450 nm),分别计算白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的表达水平。
1.5 脑组织中活性氧族(ROS)和超氧化物歧化酶(SOD)的测定
分别在造模后12 h、24 h、3 d、7 d采用腹腔注射10%水合氯醛麻醉大鼠,迅速处死大鼠,每组2只并将水肿脑组织称重,制作10%的组织匀浆(10 mmol/L磷酸盐缓冲液)。在12 000g条件下取组织匀浆5 ml离心20 min,取上清液。ROS采用二氯荧光素乙酰乙酸盐荧光分光光度法检测(上海润裕生物科技有限公司),SOD采用黄嘌呤氧化酶法检测(上海润裕生物科技有限公司)。上述检测方法的所有操作步骤均严格按照试剂盒说明书进行。
1.6 免疫组织化学染色和单链DNA(ssDNA)、羟基脲(Hu)、8-羟化脱氧鸟苷(8-OHdG)或四羟壬烯醛(4-HNE)阳性细胞的定量分析
1.6.1 免疫组织化学染色 分别在造模后12 h、24 h、3 d、7 d采用腹腔注射10%水合氯醛麻醉大鼠,然后注入300 ml 0.1 mol/L磷酸盐(PBS,pH 7.4~7.5),在PBS中加入300 ml 4%多聚甲醛,迅速处死大鼠,每组2只并取出脑组织。使用微切片机将病变最大尺寸切成50 μm厚的连续冠状切片。用3% H2O2在TBS缓冲液中浸泡30 min可阻断内源性过氧化物酶活性。切片用含0.1%聚乙二醇辛基苯基醚(TBS-T)的TBS缓冲液洗涤3次,用3%牛血清白蛋白在TBS-T中处理30 min,并与下列一级抗体在室温下孵育过夜:兔多克隆抗ssDNA抗体、单克隆抗Hu抗体、单克隆抗8-OHdG抗体、单克隆抗4-HNE抗体。清洗后,切片进一步与大鼠试剂盒(由过氧化酶结合的抗小鼠或抗兔二抗组成,购于上海纪宁生物)孵育,室温下处理60 min。大鼠试剂盒含有预吸收的大鼠血清,并在损伤大鼠组织中表现出可忽略的大鼠血清非特异性结合。
1.6.2 ssDNA、Hu、8-OHdG或4-HNE阳性细胞的定量分析 使用二氨基联苯胺进行标记5 min,用苏木精复染,定量Hu、8-OHdG和4-HNE阳性细胞数量。按照上述步骤,用正常大鼠血清代替初级抗体进行阴性对照染色。为明确ssDNA、Hu、8-OHdG和4-HNE阳性细胞的数量,记录500 μm内所有二氨基联苯胺标记的细胞受损区域(皮层),不包括白质。取3个连续切片中显微镜下二氨基联苯胺标记细胞数的平均值。使用CCD相机(北京星光光技术有限公司)放大测量区域的图像,并通过计算机对每张图像中测量的面积和体积进行跟踪和测量。根据平均阳性细胞数和体积计算出二氨基联苯胺标记细胞数。ssDNA、Hu、8-OHdG和4-HNE阳性细胞数均以阳性细胞数量/100 μm3表示。
1.7 Hu或胶质纤维酸性蛋白(GFAP)双免疫荧光染色ssDNA
大鼠液压冲击脑损伤后,采集的切片用50 mmol/L甘氨酸在TBS中冲洗并在37 ℃下封闭2 h,以减少非特异性荧光。用TBS-T清洗切片,用3%牛血清白蛋白在TBS-T中阻断,并在室温下与抗ssDNA抗体(1 ∶300)孵育过夜。广泛清洗后,切片进一步与Alexa Fluor 488抗兔IgG(北京百奥莱博科技有限公司)室温下孵育80 min。然后,广泛清洗切片,并与小鼠单克隆抗Hu抗体(1 ∶300)或小鼠单克隆抗GFAP(1 ∶300)抗体(星形胶质细胞标记物)在室温下孵育过夜。大量清洗后,切片进一步与Alexa Fluor 555抗小鼠IgG(北京百奥莱博科技有限公司)室温下孵育80 min。随后使用共聚焦激光显微镜扫描。
1.8 统计学方法
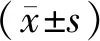
2 结果
2.1 各组大鼠脑组织含水量比较
假手术组各时间点大鼠脑组织中基础含水量基本相当。与假手术组比较,脑损伤组大鼠各时间点脑组织含水量均明显增加(P<0.05)。与脑损伤组比较,依达拉奉右莰醇组大鼠各时间点脑组织含水量均明显降低(P<0.05,见表1)。

表1 各组大鼠脑组织含水量的比较
2.2 各组大鼠炎性细胞因子水平比较
与假手术组比较,脑损伤组大鼠各时间点脑组织中IL-1β、IL-6和TNF-α水平均明显升高,差异均有统计学意义(P<0.05)。与脑损伤组比较,依达拉奉右莰醇组大鼠各时间点脑组织中IL-1β、IL-6和TNF-α水平均明显降低,差异均有统计学意义(P<0.05,见表2~4)。

表2 各组大鼠脑组织中IL-1β水平的比较

表3 各组大鼠脑组织中IL-6水平的比较

表4 各组大鼠脑组织中TNF-α水平的比较
2.3 各组大鼠脑组织中ROS和SOD含量比较
与假手术组比较,脑损伤组各时间点脑组织中ROS含量均升高,差异均有统计学意义(P<0.05);与脑损伤组比较,依达拉奉右莰醇组大鼠各时间点脑组织中ROS含量均有所降低(P<0.05,见表5)。与假手术组比较,脑损伤组各时间点脑组织中SOD含量均降低(P<0.05);与脑损伤组比较,依达拉奉右莰醇组大鼠各时间点脑组织中SOD含量均有所升高(P<0.05,见表6)。

表5 各组大鼠脑组织中ROS含量的比较

表6 各组大鼠脑组织中SOD含量的比较
2.4 8-OHdG、4-HNE、ssDNA和Hu阳性细胞定量分析
在脑损伤组大鼠各时间点脑组织损伤区域周围出现大量8-OHdG、4-HNE、ssDNA阳性细胞,而在依达拉奉右莰醇组各时间点脑组织损伤区域周围只有少数8-OHdG、4-HNE、ssDNA阳性细胞出现,两组在各时间点8-OHdG、4-HNE、ssDNA阳性细胞表达量上对比差异均有统计学意义(P<0.05)。在脑损伤后12 h、24 h、3 d、7 d,脑损伤组和依达拉奉右莰醇组Hu阳性细胞数量逐渐增多,且在第7天时最显著,此时Hu阳性细胞表达量比较差异有统计学意义(P<0.05,见表7~10)。
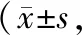
表7 各组大鼠8-OHdG阳性细胞定量分析阳性数/100 μm3)
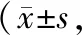
表8 各组大鼠4-HNE阳性细胞定量分析阳性数/100 μm3)
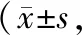
表9 各组大鼠ssDNA阳性细胞定量分析阳性细胞数量/100 μm3)
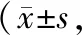
表10 各组大鼠Hu阳性细胞定量分析阳性细胞数量/100 μm3)
2.5 Hu或GFAP双免疫荧光染色ssDNA
在脑损伤组中观察到大量的ssDNA免疫阳性细胞、Hu免疫阳性细胞和GFAP免疫阳性细胞。ssDNA免疫阳性细胞对Hu和GFAP呈双免疫阳性(见图1)。相反,在依达拉奉右莰醇组中,只有少数ssDNA免疫阳性细胞,但有较多Hu免疫阳性细胞和GFAP免疫阳性细胞,而未观察到Hu或GFAP双标记的ssDNA免疫阳性细胞(见图2)。

A.绿色显示大量ssDNA免疫阳性细胞 (×100);B.红色为Hu和GFAP免疫阳性细胞 (×200);C.红色为Hu和GFAP免疫阳性细胞 (×400);D.黄色显示Hu和GFAP呈双免疫阳性 (×200);E.黄色显示Hu和GFAP呈双免疫阳性 (×400)图1 建模后7 d脑损伤组Hu或GFAP对ssDNA双免疫荧光染色Figure 1 Double immunofluorescence staining of ssDNA by Hu or GFAP at 7 d after modeling in brain injury group

A.绿色显示大量ssDNA免疫阳性细胞 (×100);B.红色为Hu和GFAP免疫阳性细胞 (×200);C.红色为Hu和GFAP免疫阳性细胞 (×400);D.未观察到Hu和GFAP双标记的ssDNA免疫阳性细胞 (×200);E.未观察到Hu和GFAP双标记的ssDNA免疫阳性细胞 (×400)图2 建模后7 d依达拉奉右莰醇组Hu或GFAP对ssDNA双免疫荧光染色Figure 2 Double immunofluorescence staining of ssDNA at 7 d after modeling by Hu or GFAP in edaravone dexcamphenol group
3 讨论
外伤性脑损伤是由于大脑受到直接的机械损伤,导致中枢神经系统退化和神经元细胞死亡。在外伤早期,大脑会出现神经元丢失、兴奋性毒性损伤、微出血、血脑屏障破坏、弥漫性轴索损伤及自由基产生等,在细胞、代谢、分子级联作用下出现神经炎症,进一步表现为脑组织水肿、脑细胞损伤/萎缩/死亡、脑容量变化等[10,11]。李萍等[12]研究证明抑制神经炎症反应,下调炎症因子的表达水平,可改善脑组织水肿情况。大量研究资料表明,依达拉奉能通过多种信号通路抑制炎症激活、促进抗氧化途径、拮抗恢复凋亡相关调节因子等来减轻炎症性损伤和氧化应激损伤,从而对脑外伤组织发挥神经保护作用,包括抑制神经功能缺损、细胞凋亡和结构损伤[13,14]。本研究结果显示,依达拉奉右莰醇组大鼠各时间点脑组织含水量及炎性因子IL-1β、IL-6和TNF-α水平均显著低于脑损伤组,差异均有统计学意义(P<0.05)。表明依达拉奉右莰醇干预治疗后可有效减轻脑损伤大鼠的脑组织水肿,减少炎症因子含量,抑制脑外伤诱发的炎症反应,从而降低对损伤周围脑组织神经元的损害,保护脑神经功能。
Reis等[15]研究显示,脑外伤后存在的高活性分子如活性氧自由基产生过多,不仅会直接对神经细胞造成损伤,还可间接通过炎症介质诱发神经细胞凋亡和炎性损伤。而自由基可诱导神经元和胶质细胞膜脂质过氧化,产生4-羟基-2-壬烯醛(4-HNE),并可直接引起神经元和胶质细胞DNA损伤,产生8-羟基-20-脱氧鸟苷(8-OHdG)[16,17]。这些膜过氧化和DNA损伤的级联反应可诱导神经元和胶质细胞凋亡,可检测为免疫阳性单链DNA(ssDNA)和神经元功能障碍[18]。表明4-HNE和8-OHdG可用作实验性脑损伤后的凋亡前标志物,ssDNA用作凋亡标志物。吴志宝等[19]通过建立大鼠液压冲击脑损伤模型,检测氧化应激损伤活性指标活性氧族、丙二醛、超氧化物歧化酶、血红素氧化酶1和磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶1的表达,证实自由基诱导的氧化应激在脑损伤中具有重要作用,早期调控氧化应激状态有助于减轻继发性脑损伤。本研究显示,与假手术组比较,脑损伤组各时间点脑组织中ROS含量升高、SOD含量降低(P<0.05);与脑损伤组比较,依达拉奉右莰醇组大鼠各时间点脑组织中ROS含量降低、SOD含量升高(P<0.05)。表明脑损伤后脑组织中会产生大量活性氧类物质,致使内源性抗氧化系统功能下降,最终导致神经细胞和血管内皮细胞产生过氧化反应,从而发生氧化应激损伤。王旭平等[20]发现通过绞股蓝总苷拮抗谷氨酸介导的氧化性神经损伤机制可能与提高神经细胞内抗氧化酶活性,清除氧自由基对线粒体膜的损伤有关。王鹏等[21]证实二十二碳六烯酸减轻全脑缺血/再灌注诱导的神经元损伤机制可能与抑制氧化应激反应、激活线粒体途径和抑制ERK信号通路有关。提示在脑损伤过程中,自由基诱导的信号通路可引起细胞损伤甚至凋亡。本研究结果显示,依达拉奉右莰醇组大鼠各时间点脑组织损伤区域周围8-OHdG、4-HNE、ssDNA阳性细胞数量少于脑损伤组,差异有统计学意义(P<0.05)。因此认为依达拉奉右莰醇可能吸收了脑外伤产生的自由基并抑制其功能,从而防止自由基介导的神经细胞凋亡和胶质细胞变性后死亡。此外,本研究显示,与脑损伤组比较,依达拉奉右莰醇组中与ssDNA共定位的Hu和GFAP免疫阳性细胞较少,且脑损伤后第7天(即慢性期)损伤区域周围有更多的Hu阳性细胞数量表达;在依达拉奉右莰醇组中,只有少数ssDNA免疫阳性细胞,但有较多Hu和GFAP免疫阳性细胞,而未观察到Hu或GFAP双标记的ssDNA免疫阳性细胞。Hu或GFAP与神经元存活及功能有密切关系,在脑损伤后期,Hu或GFAP免疫阳性细胞数量增加,提示可能存在反应性星形胶质细胞增生活跃,在损伤脑组织周围可以形成胶质副界膜,减少脑损伤区范围的扩大,在损伤-正常脑组织之间起桥梁运输的作用,并通过分泌细胞因子、生长因子等修复神经元、诱导再生神经元的迁移及促进轴突再生,从而恢复脑组织神经系统的正常功能[22-24]。上述结果进一步支持依达拉奉右莰醇治疗抑制脑损伤后自由基介导的神经元和胶质细胞凋亡。
综上所述,脑损伤后依达拉奉右莰醇治疗可改善脑水肿情况,抑制炎症反应,下调炎症因子的表达,抑制自由基诱导的神经元变性和损伤区周围细胞凋亡。
