miR-106b对肝癌细胞放疗敏感性的影响及其作用机制
2021-03-28王正陈闯丁志龙徐震吕春阳
王正 陈闯 丁志龙 徐震 吕春阳
作者单位:223002 淮安 淮安市第二人民医院肝胆外科
肝癌是全世界发病率和死亡率较高的恶性肿瘤之一,且近年来呈逐年递增趋势,严重威胁人类生命健康[1]。手术是肝癌首选的治疗方式,但大多数患者确诊时已为中晚期,失去手术治疗机会,且即使可手术的患者术后5年复发风险仍较高,因此总体治疗效果并不理想[2-3]。随着放疗设备和技术的不断发展,放疗在不可切除肝癌患者中的作用凸显,但是放疗抵抗成为极大影响疗效的一大问题[4]。微小RNA(miRNA)是一类可调节并修饰不同靶点的单链非编码小分子RNA。既往研究显示,miRNA在调控肿瘤细胞对放化疗敏感性中发挥重要作用[5],其中miR-106b在肝癌HepG2细胞中表现出增强细胞迁移、侵袭功能[6],在结肠癌中发现能增强肿瘤细胞的放疗抵抗作用[7],但在肝癌放疗中miR-106b的作用及机制并不清楚。本研究旨在构建miR-106b下调的肝癌HepG2细胞模型,探讨miR-106b对肝癌细胞放疗敏感性的影响及可能的作用机制。
1 材料与方法
1.1 主要材料及试剂
人肝癌细胞株 HepG2、SMMC-7721、SK-HEP-1、Huh7及正常肝细胞株QSG7701购自美国ATCC细胞库;胎牛血清购自澳大利亚AusGeneX公司;CCK-8试剂购自日本同仁化学研究所;Annexin V-FITC/PI细胞凋亡检测试剂盒购自哈尔滨新海基因检测有限公司;PI3K、AKT、PCNA、Bax及 GAPDH 抗体购自 Abcam公司;p-PI3K抗体购自Bioworld公司;p-AKT抗体购自美国Omnimabs公司;辣根过氧化物酶标记的羊抗兔购自美国Santa公司;无序siRNA、miR-106b siRNA、miR-106b引物、U6引物均由生工生物工程(上海)股份有限公司合成。
1.2 细胞培养及分组
将 HepG2、SMMC-7721、SK-HEP-1、Huh7、QSG7701细胞培养于含10%胎牛血清、双抗(青霉素、链霉素各100 U/mL)的DMEM培养基中,并置于37℃、5% CO2培养箱中培养,细胞融合率达70%~80%时,用胰蛋白酶消化、传代培养。
取对数生长期的HepG2细胞制备成1×105/mL的单细胞悬液,以100 μL/孔接种于96孔培养板,分为空白对照组、阴性对照组和miR-106b下调组,其中空白对照组为未转染的HepG2细胞,阴性对照组、miR-106b下调组分别为使用LipofectamineTM2000转染试剂转染无序siRNA、miR-106b siRNA的HepG2细胞。
1.3 qRT-PCR 法检测 PI3K、AKT、miR-106b mRNA的表达
将对数生长期的正常肝细胞QSG7701及肝癌细胞 HepG2、SMMC-7721、SK-HEP-1、Huh7 分别制备成1×105/mL单细胞悬液,以100 μL/孔接种于96孔板。用6 Gy 6 MV-X射线处理转染后的各组HepG2细胞,培养48 h后收集细胞,用TRIzol试剂提取细胞中的总RNA,逆转录合成cDNA,采用qRT-PCR法检测miR-106b、PI3K、AKT mRNA表达水平。PCR反应条件:95 ℃ 10 min;95 ℃ 10 s,55 ℃ 25 s,72 ℃ 2 min,40 个循环;72 ℃ 10 min。miR-106b 上游引物:5′-CCTGCCGGGGCTAAAGTGCT-3′,下游引物:5′-CCTGCTGGAGCAGCAAGTAC-3′;PI3K 上游引物:5′-AGATGCTTTCAAACGCTAT-3′,下游引物:5′-GCTGTCGCTCACTCCA-3′;AKT 上游引物:5′-TCTATGGCGCTGAGATTGTG-3′,下游引物:5′-CTTAATGTGCCCGTCCTTGT-3′;内参 U6 上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′;内参 β-actin 上游引物:5′-ACGTTGACATCCGTAAAGACC-3′,下游引物:5′-GCCACCAATCCACACAGAGT-3′。采用 2-ΔΔCt法,以 U6 为内参计算miR-106b mRNA的相对表达量,以β-actin为内参计算PI3K、AKT mRNA的相对表达量。
1.4 克隆形成实验检测HepG2细胞的克隆形成率和细胞存活分数
取对数生长期的HepG2细胞制备成3×103/mL单细胞悬液,以2 mL/孔接种于6孔细胞板上,置于培养箱中培养过夜。次日,室温下分别接受不同剂量(0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)6 MV-X 射线照射,射野覆盖全细胞培养板;继续培养14 d,PBS洗涤,每孔用3 mL甲醇固定10 min,0.1%结晶紫溶液染色,在显微镜下观察并拍照,统计各孔单个多于50个细胞的克隆数并计算克隆形成率(plating efficiency,PE)及细胞存活分数(survival fraction,SF)。PE=(克隆数/细胞数)×100%;SF=(受照射组细胞PE/对照组细胞PE)×100%。
1.5 CCK-8法检测辐射诱导HepG2细胞增殖情况
转染后的各组HepG2细胞接受6 Gy 6 MV-X射线处理,培养48 h后,加入CCK-8试剂,继续培养2 h,应用全自动酶标仪检测各孔450 nm波长处的光密度(OD)值。
1.6 流式细胞仪检测辐射诱导HepG2细胞凋亡情况
转染后的各组HepG2细胞接受6 Gy 6 MV-X射线处理,培养48 h后收集细胞,用胰蛋白酶消化,PBS洗涤后,加入400 μL 1×结合缓冲液调整成细胞浓度为1×106/mL的细胞悬浮液;按照Annexin V-FITC/PI凋亡检测试剂盒操作说明书步骤,分别加入Annexin V-FITC、PI各 5 μL,避光孵育 1 h,应用流式细胞仪检测细胞凋亡率。
1.7 Western blot检测辐射诱导HepG2细胞中p-PI3K/PI3K、p-AKT/AKT、PCNA、Bax蛋白表达
转染后的各组HepG2细胞接受6 Gy 6 MV-X射线处理,培养48 h后收集细胞,用蛋白提取试剂盒提取各组细胞中的总蛋白,用BCA蛋白测定试剂盒测定蛋白浓度并进行定量。各组取等量蛋白质,经电泳分离、转至PDVF膜、含5%脱脂奶粉的TBST封闭1 h后,分别加入 p-PI3K、PI3K、p-AKT、AKT、PCNA、Bax、GAPDH抗体(稀释比例均为1∶500),4℃孵育过夜;加入辣根过氧化物酶标记的羊抗兔二抗(1∶5 000),室温孵育1 h,根据免疫反应化学发光法显色,Tanon 600图像分析系统拍摄图像并分析条带灰度。目的蛋白相对表达量=目的蛋白灰度值/内参GAPDH灰度值。
1.8 统计学方法
采用SPSS 24.0软件进行数据分析。计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,若组间差异有统计学意义,进一步两两比较采用SNK-q检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 miR-106b在肝癌细胞系中的表达
qRT-PCR 实验结果显示 ,QSG7701、HepG2、SMMC-7721、SK-HEP-1、Huh7 细胞中 miR-106b 表达水平组间比较差异有统计学意义(F=40.363,P<0.001),其中肝癌细胞系中miR-106b表达水平均高于 QSG7701细胞(均 P<0.05),且 HepG2细胞中miR-106b表达水平最高,故选用HepG2细胞进行后续实验。见图1。
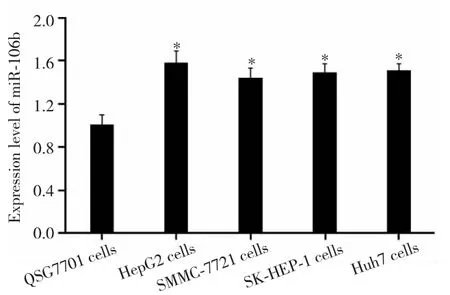
图1 qRT-PCR检测miR-106b在肝癌细胞系中的表达Fig.1 Expression of miR-106b in liver cancer cell lines detected by qRT-PCR
2.2 不同照射剂量对HepG2细胞PE、SF水平的影响
采用不同剂量(0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)照射后,与0 Gy相比,随剂量升高HepG2细胞的PE、SF水平均降低(均P<0.05),其中6 Gy与8 Gy照射的PE、SF水平差异无统计学意义(均 P>0.05),见图 2。因此,本研究选择6 Gy进行后续实验。

图2 不同剂量照射后HepG2细胞的PE和SF水平Fig.2 PE and SF levels of HepG2 cells treated with different irradiation doses
2.3 转染后HepG2细胞中miR-106b mRNA的表达
qRT-PCR检测结果显示,6 Gy照射后,空白对照组、阴性对照组、miR-106b下调组HepG2细胞中miR-106b mRNA表达水平组间比较差异有统计学意义(F=11.366,P=0.001),其中miR-106b下调组miR-106b mRNA表达水平较其余两组均降低(均P<0.05),见图3。

图3 qRT-PCR检测转染后HepG2细胞中miR-106b mRNA的表达Fig.3 Expression of miR-106b mRNA in HepG2 cells after transfection detected by qRT-PCR
2.4 下调miR-106b对辐射诱导HepG2细胞增殖的影响
CCK-8检测结果显示,经6 Gy照射后,空白对照组、阴性对照组、miR-106b下调组HepG2细胞OD值组间比较差异有统计学意义(F=6.047,P<0.001),其中miR-106b下调组OD值较其余两组降低(均P<0.05)。见图4。

图4 下调miR-106b对辐射诱导HepG2细胞增殖的影响Fig.4 Effect of down-regulation of miR-106b on the proliferation of HepG2 cells induced by radiation
2.5 下调miR-106b对辐射诱导HepG2细胞凋亡的影响
流式细胞仪检测结果显示,经6 Gy照射后,空白对照组、阴性对照组、miR-106b下调组HepG2细胞凋亡率组间比较差异有统计学意义(F=40.224,P<0.001),其中miR-106b下调组细胞凋亡率较其余两组升高(均 P<0.05)。见图 5。

图5 下调miR-106b对辐射诱导HepG2细胞凋亡的影响Fig.5 Effect of down-regulation of miR-106b on the apoptosis of HepG2 cells induced by radiation
2.6 下调miR-106b对辐射诱导HepG2细胞中PI3K、AKT mRNA表达的影响
qRT-PCR检测结果显示,经6 Gy照射后,空白对照组、阴性对照组、miR-106b下调组HepG2细胞中PI3K和AKT mRNA表达水平组间比较差异均有统计学意义(F=32.212,55.207,均 P<0.001),其中与空白对照组、阴性对照组相比,miR-106b下调组PI3K和AKT mRNA表达水平降低(均P<0.05)。见图6。

图6 下调miR-106b对辐射诱导HepG2细胞中PI3K、AKT mRNA表达的影响Fig.6 Effect of down-regulation of miR-106b on the expression of PI3K、AKT mRNA in HepG2 cells induced by radiation
2.7 下调miR-106b对辐射诱导HepG2细胞中p-PI3K/PI3K、p-AKT/AKT、PCNA、Bax蛋白表达的影响
Western blot检测结果显示,经6 Gy照射后,空白对照组、阴性对照组、miR-106b下调组p-PI3K/PI3K、p-AKT/AKT、PCNA、Bax蛋白水平组间比较差异均有统计学意义(均P<0.05)。与空白对照组、阴性对照组相 比,miR-106b 下调 组 p-PI3K/PI3K、p-AKT/AKT、PCNA蛋白表达水平降低(均P<0.05),而Bax蛋白表达水平升高(P<0.05)。见图 7。

图7 下调miR-106b对辐射诱导HepG2细胞中p-PI3K/PI3K、p-AKT/AKT、PCNA、Bax蛋白表达的影响Fig.7 Effect of down-regulation of miR-106b on the expression of p-PI3K/PI3K,p-AKT/AKT,PCNA and Bax proteins in HepG2 cells induced by radiation
3 讨论
miRNA是一类长度为17~25个核苷酸的非编码小分子RNA。近年来,随着生物分子机制研究的不断深入,miRNA被发现可通过与靶基因特定区域结合,干扰靶基因转录后表达水平,在多种肿瘤发生、发展过程中起原癌或抑癌基因作用[8]。miR-106b属于miRNA家族的一员,既往研究发现miR-106b在多种肿瘤中高表达,且可能参与肿瘤细胞增殖、分化和凋亡等进程,还可影响化疗敏感性[9]。本研究发现miR-106b在肝癌细胞中呈高表达,进一步采用不同剂量射线照射HepG2细胞,发现PE、SF水平随着照射剂量升高逐渐降低;在经6 Gy照射的HepG2细胞中下调miR-106b表达后,发现细胞增殖能力受抑制,细胞增殖相关蛋白PCNA表达也下调,而细胞凋亡能力增强,凋亡相关蛋白Bax表达上调,提示下调miR-106b表达可在放疗基础上抑制细胞增殖能力并诱导凋亡。
PI3K/AKT信号通路是致癌基因与多种受体联系的关键信号转导途径,与人类多种肿瘤的发生发展密切相关,在细胞增殖、凋亡、迁移、血管生成过程中均扮演重要角色[10]。有研究报道,PI3K/AKT信号通路激活可致使肺癌细胞耐药性和放疗抵抗性[11]。阻断PI3K/AKT信号通路也被发现抑制肝癌HepG2细胞侵袭和转移[12]。miR-106b也可通过靶向PTEN而激活PI3K/AKT信号通路,促进垂体肿瘤细胞增殖和侵袭[13]。SHI等[14]同样发现,miR-106b-5p 通过靶向PTEN途径激活PI3K/AKT通路而促进肝细胞癌干细胞维持与转移。本研究在辐射诱导HepG2细胞中同时下调miR-106b,发现细胞中p-PI3K/PI3K、p-AKT/AKT蛋白表达水平均降低,提示下调miR-106b表达可能通过阻断PI3K/AKT通路活化从而增强放疗敏感性,抑制细胞增殖及诱导凋亡。
综上所述,miR-106b在肝癌细胞中呈高表达,下调其表达可以增强放疗对HepG2细胞增殖的抑制作用,介导细胞凋亡,且可能通过阻断PI3K/AKT通路活化增强HepG2细胞的放疗敏感性。miR-106b可能是肝癌治疗的一个潜在靶点,但这一结论需进一步研究验证。
