miR-491-5p靶向FGFR4调节肝母细胞瘤细胞增殖和迁移
2021-03-28赵天娇耿建磊温婵任慧刘锋魏平
赵天娇耿建磊温婵任慧刘锋魏平
作者单位:050051 石家庄 1河北省优抚医院普外科;河北省儿童医院2普外科,3医务处;4河北医科大学基础医学院
肝母细胞瘤起源于胚胎发生时的祖细胞,是儿童常见的肝脏恶性肿瘤[1],发病率约占儿童恶性肿瘤总数的1%,发病率持续增长,且预后较差[2]。然而目前其发病分子机制尚未明确,也缺乏有效的治疗靶点。microRNA(miRNA)是一类进化保守、长度较短的非编码RNA,已被证实在肿瘤细胞增殖、凋亡及上皮-间质转化中发挥关键作用[3]。近年来,miR-491-5p也被发现在宫颈癌[4]、乳腺癌[5]等发挥抑癌作用。在肝母细胞瘤中也发现miR-491-5p低表达,且与肿瘤生长、转移和糖酵解相关[6]。FGFR4是含有酪氨酸激酶结构域的家族成员之一,在乳腺癌和胃癌中高表达且与肿瘤侵袭和放化疗抗性相关,而miR-491-5p通过调节 FGFR4可促进胃癌细胞转移[7-10]。在肝癌细胞中FGFR4同样过表达且促进肝癌细胞进展[11]。但是FGFR4是否参与小儿肝母细胞瘤的发生发展尚未明确。
GSK3β/β-catenin信号通路是肿瘤细胞增殖和迁移的重要通路,其中GSK3β是一种丝氨酸/苏氨酸激酶,通过磷酸化β-catenin氨基末端的3个保守氨基酸残基,调控细胞质中β-catenin蛋白的稳定性。当稳定的β-catenin蛋白在细胞质积累至一定量时,随即转入核内,与核转录因子TCF/LEF结合并导致靶基因C-myc启动子暴露,使其激活并表达,致使肿瘤细胞恶性增殖和迁移[12]。研究发现上调FGFR4表达可介导GSK3β/β-catenin信号通路激活并促进结肠癌转移[13]。而miR-491-5p和FGFR4在肝母细胞瘤细胞增殖和迁移中是否具有调控作用有待进一步探讨。本研究通过检测miR-491-5p和FGFR4在肝母细胞瘤细胞中的表达并分析miR-491-5p与FGFR4的靶向关系及两者对GSK3β/β-catenin信号通路的影响,为阐明肝母细胞瘤发病机制及寻找治疗靶点提供依据。
1 材料与方法
1.1 主要材料及试剂
收集河北省儿童医院2018年3月至2019年10月收治的15例小儿肝母细胞瘤组织样本及其相应的癌旁正常组织。所有患者年龄均<4岁,术后病理诊断为小儿肝母细胞瘤,术前未行化疗或放疗。本研究获本院伦理委员会批准,家属知情同意。
正常肝细胞LO2和肝母细胞瘤细胞HuH-6购自中国科学院上海细胞生物学研究所;RPMI-1640培养基、DMEM培养基、胎牛血清、胰酶和CCK-8试剂盒购自美国Gibco公司;Trizol试剂购自上海联迈生物工程有限公司;qRT-PCR试剂盒购自赛默飞世尔科技(中国)有限公司;miR-491-5p mimics、miR-491-5p inhibitor由 Genepharma公司合成;LipofectamineTM2000购自美国Invitrogen公司;pcDNA3.1质粒购自云舟生物科技有限公司;双荧光素酶活性检测试剂盒和8 μm孔径的Transwell小室购自北京平皓生物技术有限公司;FGFR4、GSK3β、p-GSK3β、β-catenin、p-β-catenin、C-myc和 p-C-myc抗体购自 Abcam 公司;兔抗β-actin抗体和兔抗鼠IgG抗体购自美国Cell Signaling Technology公司。
1.2 细胞培养、转染及分组
正常肝细胞LO2用含有10%胎牛血清的RPMI-1640培养基在37℃、5% CO2培养箱中培养;肝母细胞瘤细胞HuH-6用含有15%胎牛血清的DMEM培养基培养于37℃、5% CO2培养箱中。将FGFR4基因序列克隆进入pcDNA3.1载体。HuH-6细胞转染前1 d用胰酶消化后计数,接种至6孔板(3.0×104/孔)内过夜培养。按照LipofectamineTM2000转染试剂说明书将 50 ng的miR-491-5p mimic、mimic NC分别转染至HuH-6细胞,分别记为mimic组和mimic NC组,置于37℃、5% CO2培养箱中培养16 h,更换新鲜培养基。再将pcDNA3.1空载体和pcDNA3.1-FGFR4质粒分别转染HuH-6细胞(已转染miR-491-5p mimic),分别记为mimic+Pc组和mimic+Pc-FGFR4组,然后置于37℃、5% CO2培养箱中培养24 h,更换新鲜培养基。
1.3 qRT-PCR检测miR-491-5p和FGFR4 mRNA的表达
采用Trizol试剂提取组织样本或细胞中的总RNA,并用反转录试剂盒反转录为cDNA;应用qRTPCR法扩增miR-491-5p和FGFR4 mRNA的表达水平。PCR反应条件:95℃变性15 s,57℃退火30 s,72℃延伸10 s,进行40个循环。反应体系:cDNA模板2 ng,上下游引物各 0.4 μL,SYBR Primix Ex TaqTM 5 μL,ddH2O补充至10 μL。以β-actin为内参,采用2-△△Ct法计算miR-491-5p与FGFR4 mRNA的相对表达水平。miR-491-5p正向引物序列:5′-TTGACTTAGCTGGGTAGTGGGGA-3′,反向引物序列:5′-CAACCCAGCCAGGTAGAAGGGA-3′;FGFR4 正向引物序列:5′-TCCTACCTGAGGATGCTGGCCGCT-3′,反向引物序列:5′-ACCGTCGGCTCCGAAGCTGCTGCCGA-3′;β-actin正向引物序列:5′-CCGTTGCCCTGAGGCTCTTT-3′,反向引物序列:5′-GATCTGTCTGTCTTCTGTCTC-3′。
1.4 Western blot检测 FGFR4 和 GSK3β/β-catenin 通路相关蛋白的表达
用RIPA细胞裂解液裂解未转染及已转染的HuH-6细胞,提取细胞总蛋白,用BSA法检测细胞蛋白浓度。每组取120 μg蛋白进行变性、SDS-PAGE、转膜,5%脱脂牛奶4℃封闭1 h,然后加入鼠抗人的FGFR4、GSK3β、p-GSK3β、β-catenin、p-β-catenin、C-myc和p-C-myc抗体(均1∶1 500)摇床4℃孵育过夜,TBST洗膜3次;加入HRP标记的兔抗鼠二抗(1∶2 000),37℃孵育1 h,TBST洗膜3次后,显影、曝光并采集图片,用Image J软件分析条带灰度值。
1.5 Transwell小室实验检测细胞迁移能力
取转染后的HuH-6细胞,更换无血清的DMEM培养基培养12 h,用胰酶消化、培养基重悬细胞后计数。取200 μL细胞悬液(2.5×104个)接种于Transwell小室上室,下室加入15%胎牛血清的DMEM培养基,培养24 h;用棉签擦除上室细胞,95%乙醇固定10 min,结晶紫染色15 min,PBS洗涤3次后,在显微镜下观察计数迁移细胞数。
1.6 CCK-8实验测定细胞增殖能力
取未转染的HuH-6细胞,经胰酶消化、培养基重悬细胞后计数。以2.5×104/孔接种至96孔板,待细胞生长融合至60%时,按方法1.2进行细胞转染,并置于上述条件的培养箱中培养。每组设置5个复孔。分别于48 h和72 h,向每孔加入10 μL的CCK-8溶液,继续孵育2 h,用酶标仪检测波长450 nm处的光密度(OD)值。
1.7 双荧光素酶报告基因实验检测miR-491-5p和FGFR4的靶向关系
将 FGFR4 3′UTR 野生型/突变型(WT/MUT)分别克隆至荧光素酶报告载体pmirGLO载体中,然后分别将miR-491-5p mimic和mimic NC与pmirGLO-FGFR4-WT或pmirGLO-FGFR4-MUT共转染至HuH-6细胞中。48 h后收集上述共转染的细胞,应用荧光素酶活性检测试剂盒检测荧光素酶的活性。
1.8 统计学方法
取3次独立实验结果,采用SPSS 20.0软件进行数据分析。计量数据以均数±标准差(±s)表示。癌组织和癌旁正常组织miR-491-5p与FGFR4的表达比较采用配对样本t检验。两组间比较采用独立样本t检验。多组间比较采用单因素方差分析,多重比较采用Tukey检验。以双侧P<0.05为差异统计学意义。
2 结果
2.1 miR-491-5p、FGFR4在小儿肝母细胞瘤组织和肝母细胞瘤细胞中的表达
qRT-PCR检测结果显示,小儿肝母细胞瘤组织中miR-491-5p的表达低于癌旁正常组织(t=54.653,P=0.005),而FGFR4的表达高于癌旁正常组织(t=32.592,P=0.015),见图1A~B。HuH-6细胞中miR-491-5p mRNA的表达低于 LO2 细胞(t=26.371,P=0.012),见图 1C;FGFR4 mRNA及蛋白表达则高于正常肝细胞LO2(t=39.572,P=0.013;t=79.158,P=0.011),见图 1D~E。
2.2 过表达miR-491-5p的HuH-6细胞中FGFR4的表达
qRT-PCR及Western blot检测结果显示,mimic组、mimic NC组和Control组细胞中FGFR4 mRNA和蛋白表达量差异均有统计学意义(F=13.715,P<0.01;F=12.157,P<0.01),多重比较结果显示,mimic 组 FGFR4 mRNA和蛋白表达量低于Control组和mimic NC组(P<0.05),见图 2。
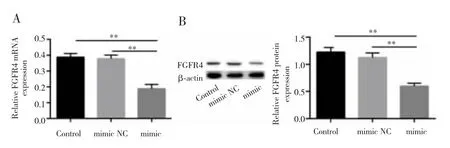
图2 过表达miR-491-5p对HuH-6细胞中FGFR4表达的影响Fig.2 Effect of overexpression miR-491-5p on the FGFR4 expression in HuH-6 cells
2.3 miR-491-5p靶向结合FGFR4
通过靶基因预测网站TargetScan进行生物学信息预测,miR-491-5p与FGFR4 mRNA的3′UTR之间存在互补配对序列,见图3A。双荧光素酶报告基因实验结果显示,与mimic NC组相比,转染miR-491-5p mimic的野生型组HuH-6细胞的荧光素酶活性降低(t=13.062,P=0.003),而转染miR-491-5p mimic的突变型组HuH-6细胞的荧光素酶活性无明显变化,见图3B。

图3 miR-491-5p与FGFR4的靶向关系Fig.3 Targeting relationship between miR-491-5p and FGFR4
2.4 过表达miR-491-5p抑制HuH-6细胞迁移和增殖
单因素方差分析显示,mimic组、mimic NC组和Control组细胞迁移数及OD值比较差异均有统计学意义(F=18.527,P=0.016;F=20.916,P=0.013),多重比较发现,mimic组细胞迁移数及OD值均低于Control组与 mimic NC 组(P<0.05),见图 4。

图4 过表达miR-491-5p对HuH-6细胞迁移和增殖的影响Fig.4 Effect of overexpression of miR-491-5p on the migration and proliferation of HuH-6 cells
2.5 上调miR-491-5p和FGFR4表达促进HuH-6细胞增殖和迁移
单因素方差分析显示,mimic组、mimic+Pc组、mimic+Pc-FGFR4组和Control组细胞迁移数及OD值比较差异有统计学意义(F=25.379,P=0.012;F=23.157,P<0.018)。多重比较发现,mimic组与mimic+Pc组的HuH-6细胞迁移数和OD值均低于Control组与mimic+Pc-FGFR4组(P<0.05),见图 5。
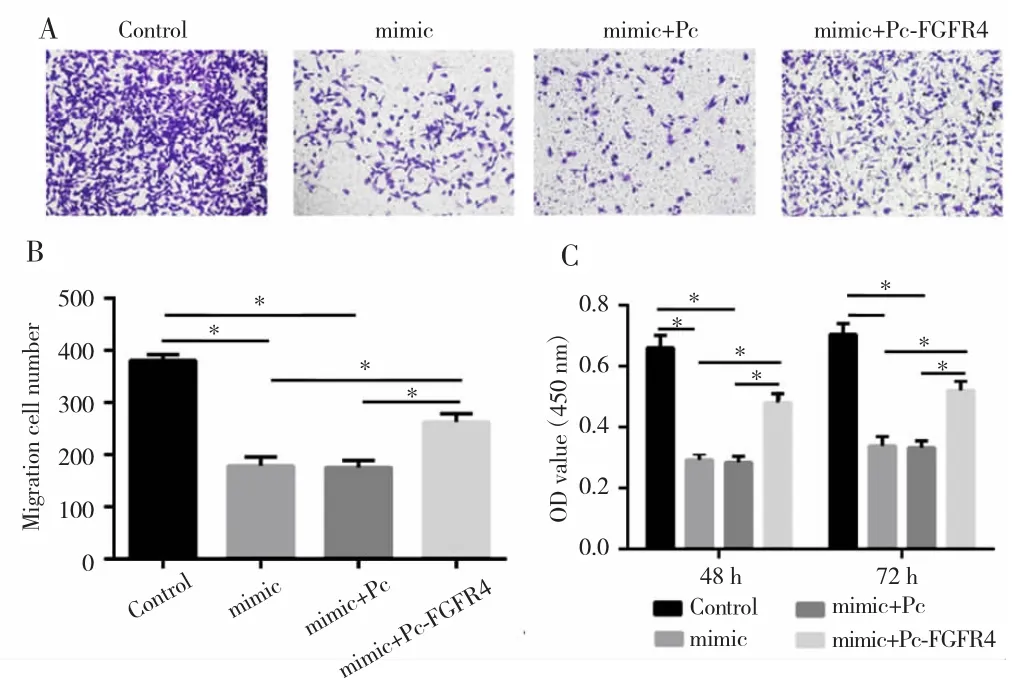
图5 上调miR-491-5p和FGFR4表达对HuH-6细胞增殖和迁移的影响Fig.5 Effect of up-regulation of miR-491-5p and FGFR4 expression on the proliferation and migration of HuH-6 cells
2.6 上调miR-491-5p和FGFR4表达促进GSK3β/βcatenin信号通路激活
单因素方差分析显示,mimic组、mimic NC组和Control 组 p-GSK3β/GSK3β、p-β-catenin/β-catenin 及p-C-myc/C-myc比值比较差异有统计学意义(F=17.547,P=0.017),多重比较显示,mimic组3项指标比值均低于 Control组与 mimic NC 组(P<0.05),见图6A。mimic组、mimic+Pc组、mimic+Pc-FGFR4组和 Control组p-GSK3β/GSK3β、p-β-catenin/β-catenin 及 p-C-myc/C-myc比值比较差异亦有统计学意义(F=25.108,P=0.015),其中mimic组与mimic+Pc组3项指标的比值均低于 Control组和 mimic+Pc-FGFR4组(P<0.05),见图6B。

图6 上调miR-491-5p和FGFR4表达促进GSK3β/β-catenin信号通路激活Fig.6 Up-regulation of miR-491-5p and FGFR4 expression promoted the activation of GSK3β/β-catenin signaling pathway
3 讨论
miRNA是一类小的单链非编码RNA,通过转录后抑制特定目标mRNA的表达,成为基因表达的主要调控因子[14-15]。近年研究发现部分miRNA在肿瘤细胞包括肝母细胞瘤中表达量的改变是影响其功能的主要原因。如ECEVIT等[16]研究发现,miR-17在肝母细胞瘤组织中低表达且与预后相关。CUI等[17]报道miR-186通过Wnt信号通路调节肝母细胞瘤进展。也有研究报道miR-491-5p在小儿肝母细胞瘤中低表达[6]。本研究亦发现miR-491-5p在小儿肝母细胞瘤组织和肝母细胞瘤细胞HuH-6中低表达,且过表达miR-491-5p可抑制HuH-6细胞增殖与迁移。而既往研究显示,miR-491-5p在肿瘤细胞中的功能发挥依赖于其与特定靶向基因的相互作用[18-19]。本研究通过靶基因预测网站TargetScan进行生物学信息预测,发现miR-491-5p与FGFR4 mRNA的3′UTR之间存在互补配对序列,且在细胞中检测发现过表达miR-491-5p可抑制FGFR4表达,说明在肝母细胞瘤细胞中miR-491-5p可靶向负调控FGFR4表达。
FGFR4是FGFR蛋白家族成员之一,在胚胎发育、伤口愈合和血管生成的多种生物学过程中发挥重要作用[20]。已有研究报道显示,FGFR4在结直肠癌、乳腺癌中过表达,且与患者生存率低下有关[21-22]。在肝癌细胞研究中也发现沉默FGFR4可抑制细胞增殖和侵袭并促进细胞凋亡[23]。本研究发现,FGFR4在小儿肝母细胞瘤组织和HuH-6细胞中高表达,过表达FGFR4可逆转miR-491-5p对HuH-6细胞增殖和迁移的抑制作用,说明miR-491-5p可能通过调控FGFR4影响HuH-6细胞增殖和迁移。而既往研究报道,miR-491-5p靶向基因FGFR4被激活后,会导致受体二聚、自磷酸化和下游信号通路激活,而这些信号通路影响细胞分化、增殖、转移、血管生成和化疗耐受等[24]。GSK3β/β-catenin信号通路是参与调控肿瘤增殖和迁移的重要通路[25]。研究显示,FGF19激活FGFR4可介导GSK3β/β-catenin信号通路促进肝细胞癌上皮-间质转化[26]。本研究进一步检测 GSK3β/β-catenin 信号通路相关因子的表达,发现过表达miR-491-5p可抑制GSK3β/β-catenin信号通路激活,而过表达FGFR4不仅可逆转miR-491-5p对HuH-6细胞增殖和迁移的抑制作用,还减弱了miR-491-5p对GSK3β/β-catenin信号通路的抑制作用,表明miR-491-5p可能通过FGFR4调控 GSK3β/β-catenin 信号通路。
综上所述,miR-491-5p在小儿肝母细胞瘤组织中低表达,而FGFR4高表达,miR-491-5p可能通过靶向调控FGFR4表达而阻止GSK3β/β-catenin信号通路从而抑制肝母细胞瘤细胞增殖与迁移。
