香芹酚对食源粪肠球菌生物膜形成的抑制作用
2020-08-03靳盼盼刘亚文邵美丽孙芝兰吴海虹许晓曦
靳盼盼 刘亚文 邵美丽 刘 芳 孙芝兰 吴海虹 许晓曦
(1 东北农业大学食品学院 哈尔滨150030 2 江苏省农业科学院农产品加工研究所 南京210014)
粪肠球菌(Enterococcus faecalis)长期以来被认为是哺乳动物肠道无害共生菌,然而近20年的研究表明,该菌是主要的临床感染病原体,可以引发心内膜炎、尿路感染及伤口感染等多种疾病,检出率仅次于大肠杆菌[1-2]。在食品中作为食源性腐败菌,因其对外界适应能力强,耐受性强,且具有很强的生物膜形成能力,使食品在贮存与分销过程中容易发生交叉污染、腐败的现象,导致食品腐败变质,造成经济损失。在食品生产过程中,当腐败菌以生物膜形式存在时,由于生物膜为细菌生长提供天然屏障,所以使其不易消除,对外界环境耐受性强且会固着在食品机械设备表面,从而成为后续食品流通过程中潜在的污染源[3-6]。Sharma等[7]对引起灭菌乳产品腐败和相关疾病的腐败菌和病原菌进行溯源检测,在产品加工过程中的接触表面和设备表面检测到相应腐败菌和病原菌形成的生物膜,表明生物膜的形成对食品安全和卫生形成隐患。
近年来,有研究表明植物精油成分可抑制细菌生物膜的形成等微生物特性[8-11]。精油中的一些成分可以影响细菌形成生物膜的初始粘附,生物膜胞外基质的合成,细菌的群体感应等,被认为是抑制生物膜形成的主要机制[12-13]。香芹酚是牛至和百里香等植物精油的主要成分,低剂量的香芹酚可以降低细菌的运动和侵袭性,减少金黄色葡萄球菌和沙门氏菌菌株生物膜的形成[13-14]。Burt 等[15]研究表明香芹酚在亚抑菌浓度下可以破坏紫色杆菌细菌群体感应,有效抑制细菌生物膜的形成,减少紫色色杆菌素产物和几丁质酶的活性,然而对已形成的生物膜无明显作用。目前有关香芹酚对粪肠球菌及其生物膜抑制方面的研究较少,本研究以从低温肉制品中分离的优势腐败菌粪肠球菌为对象,首先研究香芹酚对粪肠球菌R612-Z1 生长的影响,然后通过分析亚抑菌浓度下的香芹酚对生物膜内菌落总数、菌体泳动能力、生物膜胞外多糖含量的影响,利用扫描电镜和激光共聚焦显微镜观察生物膜的微观结构状态,最后用荧光定量PCR 分析相关基因表达量变化,研究香芹酚对其生物膜形成的抑制作用和可能机制,为开发低温食品防腐保鲜技术和优化安全卫生检测标准提供理论依据。
1 材料和方法
1.1 菌株和材料
粪肠球菌R612-Z1,本实验室从盐水鸭中分离并保存。香芹酚(纯度>99%),湖北鑫润德化工有限公司;脑心浸液(Brain Heart Infusion)培养基,北京陆桥;24 孔细胞培养板,美国康宁;总RNA 提取试剂盒,北京天根;反转录试剂盒,大连宝生物;NuncTMLab-TekTM8 孔腔室盖玻片、LIVE/DEAD Bac LightTM细胞活性测定试剂盒,美国赛默飞。
1.2 仪器与设备
扫描电子显微镜,德国蔡司;PE 激光共聚焦显微镜,美国铂金埃尔默;实时荧光定量PCR 仪,美国罗氏;5810 高速离心机、核酸蛋白测定仪,德国艾本德;恒温振荡培养箱,中国知楚。
1.3 试验方法
1.3.1 菌种培养 将粪肠球菌R612-Z1 接种于无菌脑心浸液肉汤培养基(BHI)中,培养至对数期时,接种环蘸取少量菌液在BHI 固体培养基上划线分离纯化,37 ℃过夜培养后,挑取单一菌落到含有5 mL BHI 液体培养基的试管中振荡过夜,制备冻存菌液(40%甘油),存放在-40 ℃冰箱中备用。每次试验前,冻存甘油菌按照1%比例接种到对应培养基,过夜活化。细菌培养条件为37 ℃,200 r/min。
1.3.2 香芹酚对粪肠球菌的最小抑菌浓度(MIC)的测定 按照二倍稀释法测定香芹酚对粪肠球菌R612-Z1 的最小抑菌浓度,将活化好的菌液1%接种到5 mL 新鲜BHI 培养基并加入香芹酚,菌液和香芹酚按比例混合,使其香芹酚最终的质量浓度为1 024,512,256,128,64,32,16,8 μg/mL,对照组为未加入香芹酚的菌液。37 ℃,200 r/min 振荡培养24 h。首先肉眼观察浑浊度,香芹酚的质量浓度小,试管内澄清的质量浓度可推测为最小抑菌浓度,每个梯度的试管中取200 μL 液体到96 孔板中,于600 nm 波长处测定吸光度,以无菌生长的最低香芹酚浓度为MIC。
1.3.3 香芹酚对粪肠球菌R612-Z1 生长的影响按1.3.2 方法制备含各梯度香芹酚的菌液后,于37 ℃静置培养24 h,每隔2 h 振荡均匀后,在96孔板中依次加入200 μL 各梯度菌液混合物,于600 nm 波长处测定吸光度,绘制细菌生长曲线,分析不同浓度的香芹酚对菌株生长的影响。
1.3.4 香芹酚对粪肠球菌R612-Z1 泳动能力的影响 采用软琼脂平板法[16-18]测定香芹酚对其泳动能力(swimming 和swarming)的影响,首先准备swimming 培养基(10%胰蛋白胨、5%氯化钠、2.5%葡萄糖和0.3%琼脂);swarming 培养基(10%胰蛋白胨、5%氯化钠、10%酵母膏、0.5%葡萄糖和0.5%琼脂)。高温蒸汽灭菌并冷却至适宜温度后加入香芹酚,使其最终浓度为1/4 MIC、1/8 MIC,对照组为未加入香芹酚的软琼脂平板。取过夜活化后的菌液按照1%接种到BHI 培养基,将培养至对数期的菌液离心,12 000 r/min,5 min,移除上清液,将菌泥用0.1 mol/L PBS 缓冲液(pH=7.4) 洗涤3次后,紫外分光光度计于600 nm 波长处调节吸光度为0.8~1.0,转移3 μL 菌悬液滴加到软琼脂平板的中心,将swimming 软琼脂平板和swarming 软琼脂平板分别静置于37 ℃恒温培养箱培养8 h 和20 h 后,测定并记录细菌在两种平板上的扩散直径。
1.3.5 香芹酚对粪肠球菌生物膜形成的影响
1) 生物膜内菌数的测定 按1.3.2 节的方法制备各梯度含香芹酚的菌液后,依次加入梯度为MIC、1/2 MIC、1/4 MIC、1/8 MIC 的菌液到24 孔细胞培养板中,对照组为不加香芹酚的菌液,每孔1 mL 菌液,分别在12,24,48,72 h 对每孔生物膜中进行菌落测定。在待测时间点,首先将上层培养基吸出,每孔加入1 mL 0.1 mol/L 无菌PBS 缓冲液(pH=7.4)洗涤2 次后,加入1 mL 生理盐水并使用无菌棉签擦拭细胞培养孔,确保孔内的生物膜被全部擦除,将棉签和孔内液体加入含有9 mL 生理盐水的试管中,涡旋振荡5 min,使棉签上附着及生物膜内包裹的细菌充分游离到液体中[19]。按照梯度稀释法将试管内液体稀释后,吸取稀释液,涂布均匀后倒置于37 ℃恒温培养箱中,静置培养24 h 后菌落计数。
2) 生物膜胞外多糖的含量测定 按1.3.2 节的方法制备含有不同梯度香芹酚的菌液,对照组为不加香芹酚的菌液,每孔1 mL 菌液,培养生长至12,24,48,72 h 的生物膜,移除上层培养基并洗涤后每孔加入1 mL 无菌PBS 溶液,冲洗细胞培养孔,收集孔内悬浊液,5 000×g,4 ℃离心20 min,收集菌泥,将菌泥重悬于含有0.22%甲醛的0.85%NaCl 水溶液中,先将菌悬液置于80 ℃水浴锅加热30 min,放入低温离心机15 000×g,4 ℃离心30 min,离心收集上清[20]。使用苯酚-硫酸法测定生物膜胞外多糖的含量[21]。
1.3.6 香芹酚对粪肠球菌生物膜微观状态的影响
1) 扫描电镜(SEM)观察 SEM 可以观察到生物膜内菌体聚集状态,从而探究生物膜的成熟程度不同对膜内细菌状态的影响。按上述1.3.2 节的方法配制含有不同梯度香芹酚的菌液,对照组为不加香芹酚的菌液。在NuncTMLab-TekTM8 孔腔室载玻片培养板中每孔加入400 μL 菌液,在试验进行期间每24 h 更换上层培养基以确保细菌生长条件,分别在生物膜培养至12,24,48,72 h取样。样品具体处理参见1.3.5 节,无菌PBS 溶液洗涤并晾干后,去掉上层隔板,按照样品分区切割载玻片,放入4 ℃冰箱中使用2.5%戊二醛溶液固定12 h,室温自然晾干后使用1%锇酸溶液固定90 min,然后依次用体积分数为30%,50%,80%,90%,100%的乙醇梯度脱水10 min[21],最后使用100%叔丁醇洗涤完毕。玻片用于SEM 观察前喷金处理,图片放大倍数为5 000 倍[22]。
2) 激光共聚焦显微镜(CLSM)观察 CLSM可以观察到生物膜在成熟期间的厚度变化。按
1.3.2 节的方法制备含有不同梯度香芹酚的菌液,对照组为不加香芹酚的菌液。在NuncTMLab-TekTM8 孔腔室培养板中每孔加入400 μL 菌液,在试验进行期间每24 h 更换上层培养基以确保细菌生长条件,分别在生物膜培养至12,24,48,72 h 取样。样品具体处理参见1.3.5 节,无菌PBS溶液洗涤2 次并室温晾干后,参考LIVE/DEAD Bac LightTM细胞活性测定试剂盒说明书对生物膜进行染色处理。处理后的样品可以在-20 ℃避光保存[22-23]。使用CLSM 观察生物膜的厚度,根据试剂盒中配制的荧光染料探针SYTO-9 和PI,设置观察参数,其中SYTO-9 和PI 的激发波长为485,535 nm;发射波长为498,637 nm,使用60 倍油镜观察视野下的生物膜状态。
1.3.7 香芹酚对粪肠球菌生物膜菌体内相关基因表达量的影响 按1.3.2 节的方法制备处理组为1/4 MIC 香芹酚菌液,对照组为不加香芹酚的菌液,选取培养至24 h 的生物膜,培养方法和前处理方法参考1.3.5 节的方法,确保孔内生物膜完全被收集,12 000×g,4 ℃低温离心2 min,收集菌泥,根据天根生物RNA 提取试剂盒说明书方法提取菌体总RNA,并迅速按照反转录试剂盒说明书将RNA 反转为cDNA。以cDNA 为模板进行PCR 扩增,PCR 反应体系和条件按照说明书推荐设置。表1为荧光定量PCR 引物。为了评估与生物膜形成相关目标基因的相对表达变化采用2-△△Ct法分析试验数据,其中△△Ct=Ct处理组(Ct目标基因-Ct管家基因)-Ct对照组(Ct目标基因-Ct管家基因),以log2(2-△△Ct)>1 或log2(2-△△Ct)<-1 作为基因高表达的评价标准。

表1 荧光定量PCR 引物序列Table 1 Primer sequence for real-time PCR
1.4 数据统计与分析
本试验过程中涉及的试验重复3 次,平行2次。使用SPSS 17.0 处理试验数据并采用ANOVA进行Dunett T3 差异分析,以平均值和标准差表示,P<0.05 为差异显著。
2 结果与分析
2.1 香芹酚对粪肠球菌R612-Z1 的最小抑菌浓度(MIC)
根据对粪肠球菌R612-Z1 生长情况的肉眼观察,以及测定的培养物的OD600值,确定香芹酚对粪肠球菌R612-Z1 的最小抑菌质量浓度为512 μg/mL。
2.2 不同质量浓度香芹酚处理下粪肠球菌R612-Z1 的生长曲线
由图1可知,粪肠球菌R612-Z1 在香芹酚处理质量浓度为512 μg/mL 时,细菌生长被抑制,而当处理质量浓度为256 μg/mL 时,细菌前12 h 的生长过程被抑制,12 h 后与对照组基本重合;128 μg/mL 香芹酚处理时,4 h 前生长速度略低于对照组,之后与对照组生长曲线重合,最大生长量相同;64 μg/mL 香芹酚处理和对照组的生长曲线重合,因此接下来的试验中主要采用质量浓度为128 μg/mL 以及64 μg/mL 的香芹酚处理,探究其
对生物膜的抑制影响。
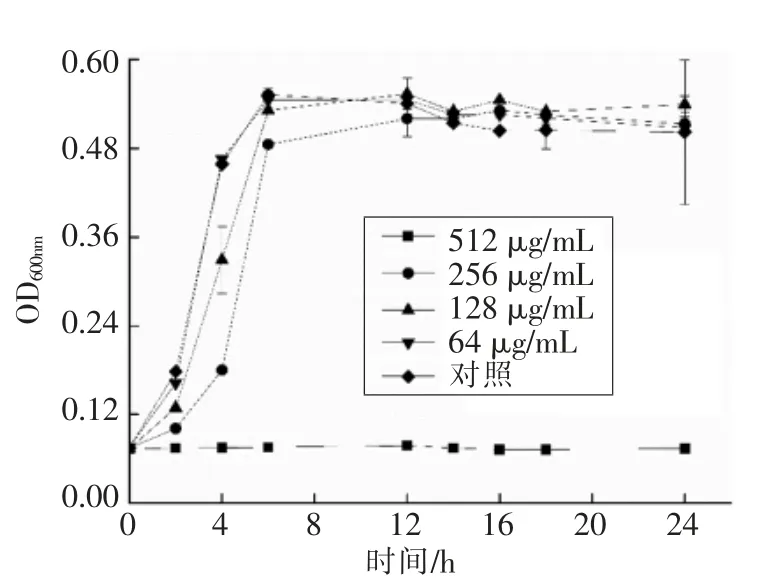
图1 不同香芹酚浓度下粪肠球菌R612-Z1 生长曲线Fig.1 Growth inhibition of E.faecalis R612-Z1 cells in carvacrol solutions at different concentrations
2.3 香芹酚对粪肠球菌涌动能力的抑制
细菌生物膜形成初期主要依靠鞭毛的泳动能力,使得菌体移动到附着材料表面,然后在菌毛的作用下粘附固着,形成生物膜[25-26]。菌体的泳动能力分为两种,swarming 代表一种群体菌体运动行为,swimming 代表一种单一菌体运动行为。如图2所示,当香芹酚的处理质量浓度分别为128 μg/mL和64 μg/mL 时,对细菌的泳动能力(swimming)和丛动能力(swarming)有明显的抑制作用(P<0.05),而不同处理浓度之间无显著差异(P>0.05)。由于鞭毛所参与的泳动对生物膜的早期形成起关键作用,此结果表明香芹酚可能会通过影响生物膜早期形成时菌体的初期粘附能力来抑制生物膜的形成。
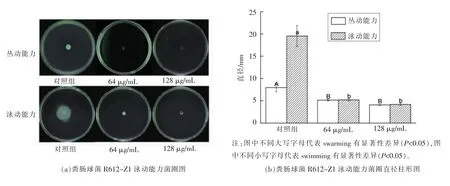
图2 香芹酚对粪肠球菌R612-Z1 泳动能力的抑制作用Fig.2 Inhibition of surge capacity of E.faecalis R612-Z1 by carvacrol
2.4 香芹酚对粪肠球菌R612-Z1 生物膜形成的影响
2.4.1 生物膜内菌数的变化 图3为不同香芹酚浓度下生物膜内菌体数量的变化。粪肠球菌R612-Z1 12 h 形成的生物膜内活菌总数比其它培养时间内活菌总数略低,这与生物膜成熟时间有关,此时生物膜并未完全成熟。24 h 后生物膜内活菌总数基本保持一致,说明生物膜已经成熟,并且处于一个比较稳定的状态。在选取的4 个时间点内,处理组和对照组的活菌总数无显著性差异(P>0.05),说明质量浓度在128,64 μg/mL 下的香芹酚对生物膜内活菌总数没有显著影响。
2.4.2 生物膜内胞外多糖含量的变化 从生物膜的大量研究中发现,胞外多糖在维持细菌生物膜的三维结构中发挥不可替代的作用,作为生物膜的结构基础,进而成为功能的主要承担者[25,27]。因此,为抑制生物膜的形成,主要的研究思路即为抑制或减少胞外多糖的合成和分泌。通过苯酚-硫酸法测定糖浓度-吸光度线性关系为y=0.0086x+0.0753(R2=0.99),可以进行后期多糖的含量测定。如图4a 所示,对照组和处理组生物膜胞外多糖含量都随培养时间的延长而增加,说明菌体会持续合成胞外多糖来形成稳定的生物膜结构。培养12 h 时,处理组与对照组胞外多糖含量无显著差异(P>0.05),128 μg/mL 与64 μg/mL 处理组对粪肠球菌R612-Z1 生物膜胞外多糖抑制率分别为4.8%和8.13%,此时为粪肠球菌R612-Z1 生物膜形成的初期阶段,胞外多糖分泌含量较低;培养24 h 后,虽然两个处理组之间胞外多糖含量无显著差异(P>0.05),对粪肠球菌R612-Z1 生物膜胞外多糖抑制率分别为20.29%和20.34%,但是都显著低于对照组的胞外多糖含量(P<0.05);培养48 h 后,128 μg/mL 胞外多糖含量显著低于64 μg/mL处理组(P<0.05),对粪肠球菌R612-Z1 生物膜胞外多糖抑制率分别为30.98%和20.03%;培养72 h后,128 μg/mL 处理组显著低于对照组(P<0.05),抑制率较48 h 时下降为22.97%。而64 μg/mL 处理组与对照组无显著差异(P>0.05),此时抑制率为5.16%。
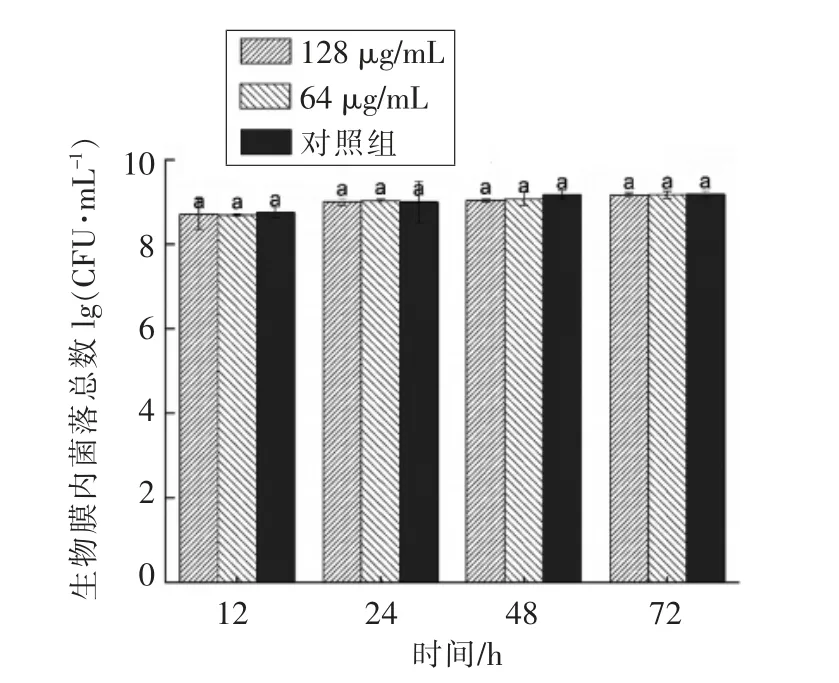
图3 香芹酚对粪肠球菌R612-Z1 生物膜内菌数的影响Fig.3 Effect of carvacrol on the bacterial counts in Enterococcus faecalis R612-Z1biofilm
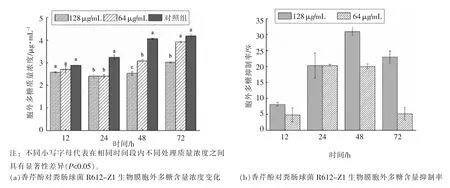
图4 香芹酚对粪肠球菌R612-Z1 生物膜胞外多糖合成的影响Fig.4 Effect of carvacrol on extracellular polysaccharide production of E.faecalis R612-Z1 biofilm
2.5 香芹酚对粪肠球菌R612-Z1 生物膜微观状态的影响
2.5.1 SEM 观察生物膜内菌体聚集后的微观状态
如图5所示,使用SEM 观察粪肠球菌R612-Z1生物菌膜内菌体的聚集状态,培养12 h 后,菌体单层粘附于表面无细菌聚集体形成,随培养时间的延长,菌体之间出现聚集联结,与同一时间对照组相比,经过128 μg/mL 香芹酚处理的粪肠球菌R612-Z1 生物膜,细胞个体形态无明显变化,细胞之间连接不致密,细胞层数变薄。

图5 香芹酚对粪肠球菌R612-Z1 生物膜菌体聚集状态的影响(5 000×)Fig.5 Effect of caracol on cell aggregation in E.faecalis R612-Z1 biofilm (5 000×)
2.5.2 CLSM 观察生物膜成膜厚度的变化 通过CLSM 观察在生物膜成熟过程中粪肠球菌R612-Z生物膜成膜厚度及结构的变化,如图6所示,发现未添加香芹酚的对照组生物膜随着生物膜的不断成熟,生物膜厚度逐渐增加,生物膜结构之间越来越紧密,而在相同培养时间内,处理组与对照组之间有明显差异,处理组生物膜厚度相对较低,并且生物膜之间有明显裂缝、凹凸不平,生物膜结构相对松散、不致密。
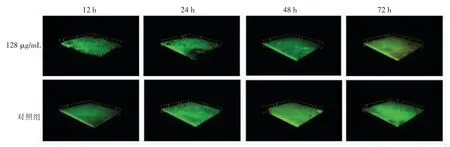
图6 香芹酚对粪肠球菌R612-Z1 生物膜成膜厚度的影响Fig.6 Effect of carvacrol on the thickness of Enterococcus R612-Z1 biofilm
2.6 香芹酚对粪肠球菌生物膜菌体内相关基因表达量的影响
对照组与128 μg/mL 香芹酚处理组生物膜菌体内各目标基因的表达量变化如图6所示,培养24 h 后,对照组生物膜菌体中的14 种目标基因的表达量显著低于对照组生物膜菌体中的基因表达量(log2(2-△△Ct)<-1);ebpR、ebpA、ebpC 是参与生物膜形成初期粘附的相关基因,epaA~epaR 则是参与生物膜成熟过程中胞外多糖合成的基因,这些与生物膜形成相关的表达基因均出现显著下调,结合上述香芹酚处理之后生物膜的表观变化,两者之间的相互一致说明香芹酚可以抑制生物膜形成并可能主要通过两个方面发挥作用,一方面是影响生物膜初始粘附,另一方面是减少胞外多糖的合成。
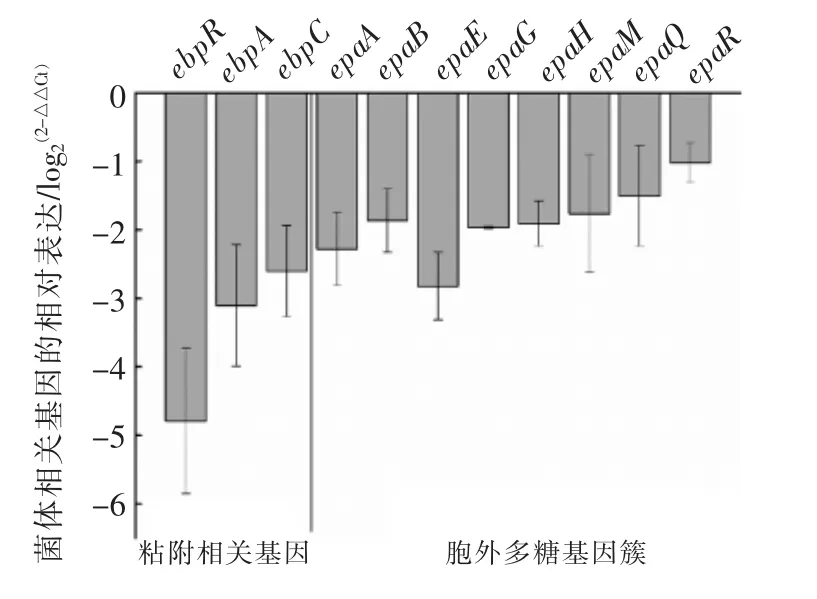
图7 粪肠球菌R612-Z1 生物膜内菌体细胞内相关基因表达量变化Fig.7 Changes of relative expression levels of biofilm-related genes in E.faecalis R612-Z1
3 结论
近年来,随着人们对食品安全问题的重视,关于寻求安全的天然提取物来抑制生物膜形成的研究越来越多。丁荣荣等[28]研究提出大蒜提取物通过干扰铜绿假单胞菌PAO1 群体感应系统来抑制其生物膜的形成,降低与生物膜形成相关特性的表达。朱军莉等[29]研究表明茶多酚和葡萄籽提取物在亚抑菌浓度下表现出较强的抗铜绿假单胞菌生物被膜作用,主要通过影响假单胞菌初期的粘附。本试验选取亚抑菌浓度香芹酚处理粪肠球菌R612-Z1 形成的生物膜,发现香芹酚在亚抑菌浓度下对粪肠球菌R612-Z1 生物膜有明显的抑制作用,该浓度下粪肠球菌生物膜内活菌总数与对照组无显著差异,说明香芹酚对生物膜活菌无影响,不会增加菌体的抗逆性;SEM 和CLSM 观察发现香芹酚存在时生物膜结构松散,细胞之间连接不致密,膜厚度降低并且有裂缝、不平整;菌体泳动试验和与粘附相关基因的表达量变化结果表明香芹酚会影响生物膜形成初期菌体的粘附能力;胞外多糖含量定量检测和该合成基因簇中相关基因表达量的变化说明香芹酚能够明显抑制生物膜成熟阶段胞外多糖的合成。本研究结果说明亚抑菌浓度香芹酚对粪肠球菌R612-Z1 生物膜有明显的抑制作用,其作用主要通过抑制菌体的初期粘附和胞外多糖的合成来完成,然而有关香芹酚如何通过影响菌体内的调控因子来调控粘附和多糖合成过程仍需进一步研究。
