曝气对人工湿地胞外多糖累积影响及表征分析
2020-12-26武晗琪倪利晓杜存浩
武晗琪,倪利晓,2,杜存浩
(1.河海大学环境学院,江苏 南京 210098;2.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098)
0 引言
基质、水生植物、微生物作为人工湿地的三要素,能通过物理拦截、化学吸附、生物降解去除水体中的污染物[1-2]。而阻碍湿地大规模运行的主要问题就是湿地堵塞,一旦发生堵塞,水流不通淤积,滋生蚊蝇,加速水质恶化。近年来,众多研究学者从水力条件、基质成分、微生物构成等多个方面分析堵塞产生原因[3-6]。引起湿地堵塞的主要有以下几类原因:悬浮物的累积,植物根系不断增长,反应产生的沉淀物、生物膜[7-10]。其中生物膜又是造成堵塞的主要原因[10]。生物膜主要构成是微生物和及其分泌的胞外聚合物(EPS)[11]。EPS的吸附能力强,絮凝性好,不仅可以作为保护层防治细胞被有毒物质杀死,又能作为营养源向细胞提供所需的营养物质[12]。但过量的EPS 会导致基质孔隙率降低,形成生物堵塞[13-15]。EPS的主要成分又为蛋白质和多糖[16]。BASUVARAJ M 等[17]认为EPS的成分比EPS的含量对堵塞的影响更大。大分子的多糖和其凝胶化行为会使孔隙内多糖含量增加,且累积不易去除,与生物堵塞更显著相关[18-19]。因此,研究潜流人工湿地的胞外多糖的累积对探究人工湿地堵塞形成具有重要意义。
曝气能够改善湿地的水力效率和微生物降解的作用[20]。通过曝气溶氧,一方面可以通过切割作用提高氧气有效转移率:另一方面溶解氧的提高有利于植物根系吸收氧气,加强植物吸收作用及微生物好氧反应[21]。因此,本文以垂直潜流人工湿地作为研究对象,探讨不同程度的曝气对人工湿地胞外多糖的累积和特性粘度影响,同时提取纯化胞外多糖探究其成分构成,以期为深入了解人工湿地堵塞形成奠定基础。
1 材料和方法
1.1 实验装置
潜流人工湿地示意见图1。

图1 潜流人工湿地示意
本实验装置由4 组均质亚克力塑料桶 (桶高100 cm,内径45 cm)组成。桶底分别填上厚度5 cm,d50为5 mm 的砾石和厚度60 cm,d50为2 mm 的粗砂(d10=0.5 mm,不均匀系数Cμ=4.2,初始孔隙率n=0.31)。取水管位置分别位于桶高20,40 和60 cm处。污水由装置上方的进水口引入,出水口位于底端。盘式曝气器直径为10 cm,表面孔隙率约为0.5,置于距地面40 cm 处,以期获得较优的污染物去除效果。
1.2 运行方式
2018年12月10日启动装置。利用流量计控制进水流量为0.1 m3/d,进水负荷控制在0.5 m3/(m2·d)。气水比为6∶1 时有利于处理高负荷污水[22]。故本实验分别设置气水比为0∶1,3∶1,6∶1,9∶1 这4 组反应器。利用脉冲曝气方式,每日定时曝气(19∶00~次日7∶00,每小时曝气停歇比为1∶2),至2019年7月10日停止运行。
1.3 实验水质及基质取样
为排除进水中的多糖和多聚糖杂质对实验结果产生干扰,本实验采用模拟实验用水。主要污染物浓度见表1。其中用乙醇、氯化铵和磷酸二氢钾分别作为模拟用水的外加碳源、氮源和磷源。

表1 实验进水水质主要污染物平均质量浓度 mg·L-1
利用柱状土壤采样器采集基质层内部10,30 及50 cm 处样品。将所采取样品的平均值表征该平面的胞外多糖相关检测值。
1.4 实验指标
本实验检测的指标中胞外多糖浓度采用热提取法测定[23];蛋白质含量采用Bradford 法测定[23];DNA含量采用二苯胺比色法测定:特性粘度采用旋转粘度计(NDJ-1)测定。
1.5 胞外多糖纯度分析及红外光谱分析
纯度分析:将所得多糖的利用紫外分光光度计(SP-752)于190~400 nm 区间内扫描分析确定。
傅里叶红外光谱(FT-IR)分析:采用FT-IR 光谱仪(Nicolet Nexus 470型),官能团分析利用KBr 压片法[24]。
1.6 微观结构分析
将精制多糖喷镀金膜,采用扫描电镜 (FEIQuanta-200)观察其微观结构。
2 结果与讨论
2.1 胞外多糖累积浓度的时间变化
各组的胞外多糖浓度随反应时间的变化见图2。装置运行后,实验组的胞外多糖含量在各个采样时间内小于空白组。且随着气水比的增大,胞外多糖浓度降低。实验结束时,气水比3∶1,6∶1 和9∶1 组的胞外多糖累积含量分别下降了36%,57%和74%。气水比0∶1 组,在湿地开始运行60 d 内(12月10日至2月10日),胞外多糖浓度保持中高速增长。在60 d 至120 d 时(2月10日至4月10日),出现高速增长,而后速度降缓。这可能是因为实验开始于冬季,不利于微生物的生长,而2~4月的温度已上升至微生物适宜生长温度,能加快微生物繁殖,引起胞外多糖含量激增。随着时间推进,温度继续上升,微生物生长再次受到限制,胞外多糖浓度降低。气水比分别为3∶1,6∶1 和9∶1 组在整个运行时间内各增速都比较稳定。对图2 中各组数据进行线性回归分析,得到相关增量方程见表2。气水比0∶1 组的k值最高,达3.663。实验组的k值都明显低于未曝气组。随着曝气程度增加,k值减小,这意味着曝气能够减缓胞外多糖的累积速率,降低基质中胞外多糖的含量。

图2 各组胞外多糖随时间的变化

表2 各组胞外多糖特性积累方程
2.2 基质胞外多糖累积浓度的空间变化
实验前后各组在不同深度的胞外多糖含量见图3。随着工况的运行,各组的胞外多糖浓度在不同深度上都有不同程度的提升。在水深10 cm 和30 cm 处,实验组的胞外多糖累积含量显著低于空白组,推测可能溶氧的升高提高微生物的活性,加快微生物代谢速率,降低有机物的累积。实验结束时,气水比0∶1 组在水深10 cm 和30 cm 的胞外多糖含量最高,占据了系统总量的75%以上,考虑水流方向是自上向下流动,推测气水比0∶1 组的微生物主要积累于中上层部分。同时系统中的溶解氧主要依靠进水中的溶解氧和大气溶氧,造成溶解氧沿程损耗,底部的溶解氧含量较低,不利于微生物生长,降低胞外多糖分泌。气水比3∶1 和6∶1 组在深度方向上都出现先降低后增大的趋势。实验结束时在水深30 cm 处,气水比6∶1 组多糖累积仅为2.62 mg/g 基质,是空白组在同一位置同一时间的0.20倍,是自身同一位置初始值的6.39倍。实验组在水深50 cm 处的胞外多糖含量明显升高,可能是一方面是由于残余溶解氧进入基质底层,从而破坏了原有的厌氧还原态环境,抑制细菌的活性,有机质不能充分降解而使胞外多糖大量积累所产生。另一方面则是因为上层曝气强度所产生的高速气流与进水混合所产生的湍流对基质颗粒的摩擦剪切作用剥离大量的胞外多糖与进水颗粒物质混合体,随进水在底层重新沉降所额外产生的积累量。白少元等[25]在相似的研究中也发现底层堵塞物含量略高于表层。
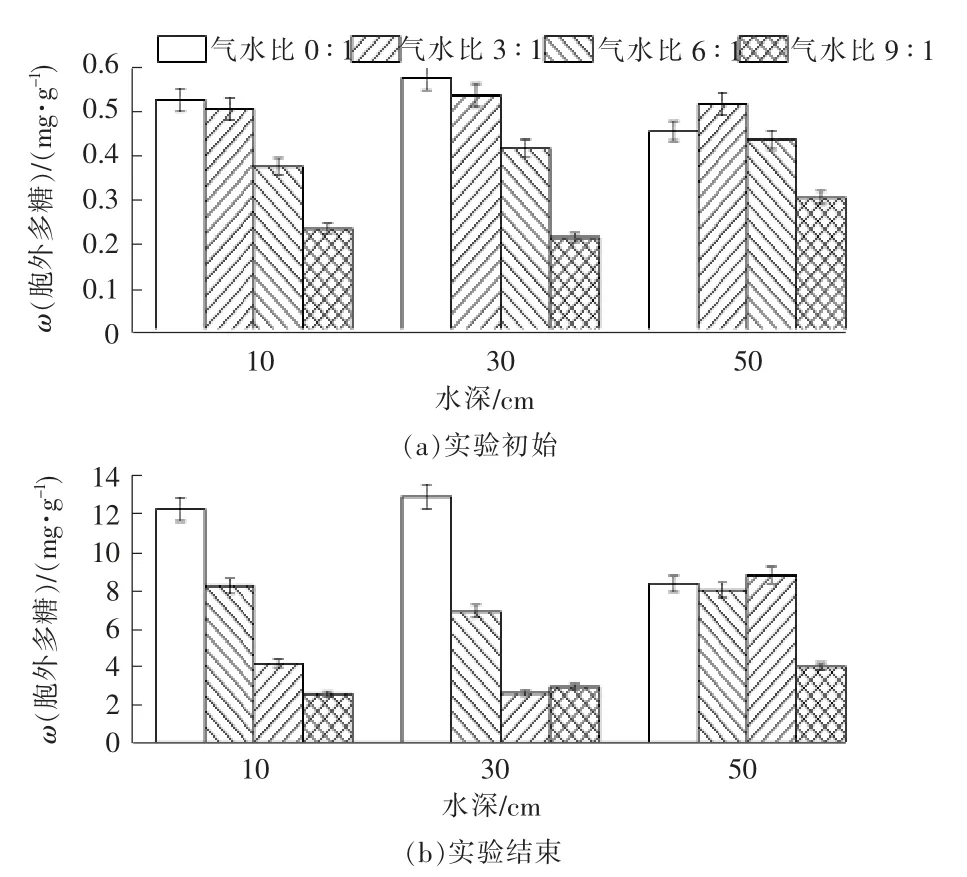
图3 各组胞外多糖随深度变化
2.3 曝气对胞外多糖特性粘度的影响
利用精制胞外多糖分别配置成质量浓度为25,50,100,200 和400 mg/L 的梯度溶液测定动力粘度获得的特性回归曲线见图4。胞外多糖浓度与其对应的特性粘度之间的反馈作用遵从二级指数关系,说明随着基质表面胞外多糖积累量的增长,其对过水的阻滞作用也将越来越显著。当胞外多糖积累量达到一定浓度时,粘度的影响将超出浓度增长的影响。

图4 胞外多糖特性粘度曲线
各组胞外多糖浓度及纯水对应的特性粘度见图5。其中,气水比0∶1 的特性粘度最高(2.10 ± 0.11 mPa·s),与纯水相比其特性粘度增加了近2.4倍。而曝气组的特性粘度分别下降了13.4%(气水比3∶1),30.1%(气水比6∶1)及41.7%(气水比9∶1),这意味着曝气能降低胞外多糖的特性粘度,提升过水能力。最低浓度的胞外多糖(气水比9∶1),其粘度都高于纯水的特性粘度,这可能暗示湿地运行出现生物膜且分泌胞外多糖时,基质孔隙之间的过水阻力要远高于初始状态,并且将大大延长水力停留时间。

图5 各组胞外多糖的特性粘度
2.4 胞外多糖提取、纯化与分析
胞外多糖提取及纯化的主要成分质量浓度见表3。

表3 胞外多糖溶液的提取及纯化的主要成分质量浓度 mg·L-1
胞外多糖含量随着气水比的增加而降低,曝气组平均降幅达到38.8%,验证了曝气对胞外多糖的累积有反作用。经Sevga 法脱蛋白后,各组蛋白含量平均脱除率达83.6%,胞外多糖平均产率为88.9%。经过DEAE 纤维素层析纯化后,蛋白质和DNA 的最终平均脱除率达到98.6%与81.0%,胞外多糖所占比例达97.5%。
层析提纯液在260~280 nm 处的吸收峰见图6,并不明显,表明蛋白质及核酸杂质已经被基本去除,不会妨碍后续的理化测试。

图6 胞外多糖样品紫外扫描特性曲线
2.5 胞外多糖傅里叶红外光谱分析
胞外多糖样品的傅里叶红外光谱扫描图谱见图7。3 433 cm-1处强宽峰的出现代表O-H 基团伸缩振动作用,2 923 cm-1处的吸收峰为糖类C-H 基团的伸缩振动,1 639 cm-1处为-OH 基团的弯曲振动特征吸收峰,1 371 cm-1处为=CH 的变形吸收峰[26]。1 253 cm-1处为C-O-C 基团的伸缩振动所引起的。引起注意的是,在885 cm-1处有细微的吸收峰,这是β型糖苷键特征吸收谱段[27]。FT-IR 图表明该胞外多糖是以β-糖苷键所相连,由O-H,C-H,C-O-C 及=CH 等多种基团组成的复杂分子。

图7 胞外多糖傅里叶红外光谱
2.6 胞外多糖的微观结构
低倍率下胞外多糖样品表面见图8。

图8 胞外多糖SEM
由图8(a)可以看出,胞外多糖表面是粗糙不平的结构分布,形成的孔隙明显低于50 μm,分子单元间强烈的交互作用降低其水化作用,且具有较高的抗非线性形变的能力。由图8(b)可以看出,胞外多糖样品的分子单元是高度无定形的三维结构,表面褶皱度较高并同时存在因表面凹陷扭曲而形成的细微孔洞。这些分子单元通过嵌合或缠结共同形成多孔状松散网格骨架结构。推测一方面胞外多糖利用网格结构吸附含于进水中的小粒径物质,使其失去流动性并留存其中。另一方面,这种以多糖分子为基本骨架所形成的凝胶,因其内部含有氢键而具有较高的粘性。这种特性增加了过水的粘滞阻力,所固定的颗粒物质与胞外多糖共同形成了胶状淤泥。
本研究推测胞外多糖的特性粘度及其与颗粒形成的胶状淤泥是造成堵塞的关键因子之一。高粘滞状态使得基质孔隙内混流态,增加了短流及返混等不利水力现象发生的可能,从而最终延长系统的水力停留时间同时进水中的各种粒径的颗粒物质被截留的几率大大增加,与其共同形成复合胶体,挤占孔隙空间,加深堵塞程度。冯嵩[28]提出利用杀菌剂,溶解已存在的胞外多糖,提升系统的水力传导能力。
3 结论
(1)曝气能够明显减缓胞外多糖累积速率,降低胞外多糖含量及其特性粘度。
(2)通过一系列分析方法表明胞外多糖是以β-糖苷键所相连,由O-H,C-H,C-O-C 及=CH 等多种基团组成的高度无定形的复杂分子,其分子表面有褶皱,同时存在细微孔洞。据此推测胞外多糖特性粘度及其与颗粒形成的胶状淤泥是造成堵塞的关键因子之一。
