嗜热链球菌MN-BM-A01对小鼠免疫的调节作用
2020-08-03李周勇史玉东王辰元
陈 云 李周勇 史玉东 王 然 王辰元 赵 亮*
(1 中国农业大学食品科学与营养工程学院 北京食品营养与人类健康高精尖创新中心 北京100083 2 内蒙古蒙牛乳业(集团)股份有限公司研发中心 呼和浩特011500 3 食品质量与安全北京实验室 北京100083)
随着消费者生活水平的提高,对食品的需求不再仅限于数量,而更关注健康[1]。发酵乳制品具有调节肠道菌群,提高免疫力,预防癌症等功能[2-3],其消费比重不断增加。发酵剂是发酵乳制品生产的关键。发酵剂一般具备两种性能,即生产性能(包括产香性、产粘性、产酸性、蛋白分解活力及乳糖分解性能)和益生特性(降血脂,免疫调节,降血压等)[4-6],对兼具生产和益生功能的菌株[7]的开发是未来发酵乳制品的研究方向。
我国地缘辽阔,不同地域的自然环境和气候条件,造就了特色各异的传统自然发酵乳制品[8],如:酸牛乳、酸马奶、酸羊奶、酸驼奶等。这些民族传统发酵乳制品中的乳酸菌经过千百年的自然选择与进化,一些具有优良发酵特性和益生作用的乳酸菌被保留下来。不同少数民族在制备传统发酵乳制品时所用的原料、工艺等不同,使我国乳酸菌资源具有生物多样性和基因多样性[9]。
嗜热链球菌(Streptococcus thermophilus)MNBM-A01 是从甘南藏族自治州地区自然发酵酸乳中分离获得的一株高产胞外多糖嗜热链球菌菌株,该菌株具备良好的产酸、产粘和产香特性,具备作为发酵剂的良好特征[10]。为进一步研究该菌株的益生功能,本文以小鼠为模型,研究其免疫调节作用,为该菌株的工业应用和开发提供理论支持。
1 材料与方法
1.1 试验材料
菌种:嗜热链球菌MN-BM-A01,保藏号CGMCC No.11383,分离自甘肃省甘南藏族自治州舟曲县拱坝乡传统制作方法发酵的酸牛奶中。MN-BM-A01 菌株在12%脱脂乳培养基中活化3代,以2%的接菌量接种于12%脱脂乳,于37 ℃培养18 h,利用0.01 mol/L、pH 7.4 的磷酸盐缓冲液(PBS)调整其菌数为1.0×109CFU/mL,按用量分装4 ℃保存备用。
试验动物:清洁级昆明小鼠,雄性,平均体重(20±2)g,144 只,内蒙古大学实验动物研究中心。
试 剂:0.01 mol/L、pH 7.4 PBS;DEPC 水、氯仿、75%乙醇,北京陆桥技术有限公司;小鼠sIgA ELISA 试剂盒、小鼠IgG ELISA 试剂盒、小鼠IgM ELISA 试剂盒、小鼠LYZ ELISA 试剂盒,美国GBD 公司;NK 细胞活性检测WST-8 试剂盒,日本D0JINDO 公司;动物组织总RNA 提取试剂盒,德国QIAGEN 公司;其余试剂均为分析纯级。
1.2 仪器及设备
ELX808 酶标仪、ELX50 洗板机,美国Biotek公司;超净工作台,新加坡ESCO 公司;CP21GⅡ高速冷冻离心机,日立公司;恒温培养箱(37,43℃),西班牙J.P.SELECTA 公司;Premium U410 超低温冰箱,美国NBS 公司;G560E 漩涡混合器,美国SCIENTIFIC Instruments 公司;电子称,梅特勒公司;HV-110 高压灭菌锅,日本Hirayama 公司;Sartorius pH 计,北京赛多利斯仪器系统有限公司。
1.3 试验方法
1.3.1 实验动物分组及饲喂方式 实验动物适应性饲养7 d,待体重均达(20±2)g 后将小鼠随机分为4 组,分组饲喂,自由饮水,自由采食。试验组小鼠每日1 次灌胃,对照组以同样的方法给予生理盐水,连续30 d。饲喂前1 天收集粪便;最后1天收集粪便,各指标检测时按各自饲养时间要求取小鼠进行实验[11],小鼠分组及饲喂方式如表1所示。
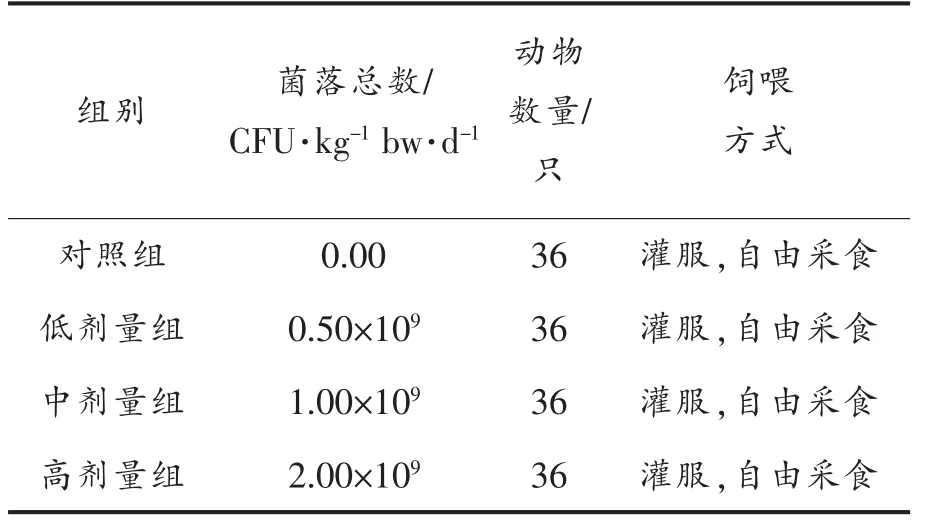
表1 实验分组及饲喂方式(饲喂30 d)Table 1 The experimental group and feeding way (feeding 30 days)
1.3.2 小鼠体重及免疫脏器指数 (Immune organ index,IOI)测定[12]饲喂期间每隔10 d 测量体重1 次,计算平均体重,绘制体重变化曲线。分别在饲养14 d 及28 d 时,处死小鼠,无菌取出胸腺和脾脏,将周围组织剥离干净,用滤纸吸净组织表面血液后称重,按式(1)计算免疫脏器指数。

1.3.3 小鼠血清中IgG、IgM 含量测定[12]14 d 灌胃后的第2 天,摘除眼球取血于离心管中,待析出血清时,于3 000×g 离心15 min,上清液分装于管中,然后封口置于-20 ℃低温保存,待测。用免疫球蛋白(IgG、IgM)ELISA 试剂盒检测,具体步骤按照试剂盒说明书完成。
1.3.4 小鼠粪便中sIgA 含量的测定 收集7 d 和14 d 老鼠粪便,用PPST 溶解,3 000×g 离心去除杂物,用sIgA ELISA 试剂盒检测sIgA 含量,具体步骤按照试剂盒说明书完成。
1.3.5 淋巴细胞转化试验[13]当T 细胞受ConA(刀豆蛋白)刺激后发生母细胞增值反应,活细胞特别是增值细胞中的线粒体水解酶可将MTT (一种淡黄色唑氮盐)分解为蓝紫色结晶,其光密度值能反应出细胞增值情况。
试验方法:取脾脏,分离出淋巴细胞,利用MTT 试剂盒进行测定。ConA 孔的光密度值减去不加ConA 孔的光密度值代表淋巴细胞的增值能力。受试样品吸光值差值显著高于对照组(P<0.05),判定阳性。
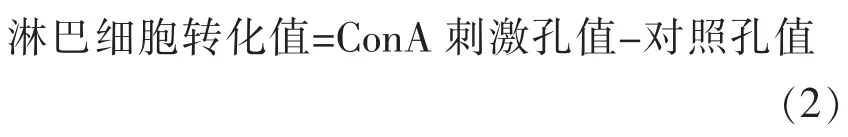
1.3.6 血清溶血素测定[14]用SRBC 免疫动物后,血清中出现SRBC 抗体(溶血素),在补体参与下,与SRBC 一起孵育,可发生溶血反应,释放血红蛋白,通过测定血红蛋白含量反映动物血清中溶血素的生成水平(HC50)。
绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中摇动脱纤维,放入4 ℃冰箱保存备用。取羊血,用生理盐水洗涤3 次,离心。将积压SRBC用生理盐水配成细胞悬液,每只鼠腹腔注射0.2 mL 进行免疫,4~5 d 后,收集血清。取血清用SA缓冲液稀释并置于试管内,依次加入SRBC、补体。另设不加血清的对照管(以SA 缓冲代替),水浴后离心,取上清液,加都氏试剂,同时取体积分数10%的SRBC 加都氏试剂,充分混匀,于540 nm 波长处以对照管作空白,分别测定各管光密度值。

1.3.7 碳廓清试验[15]在一定范围内,小鼠体内碳颗粒被清除速率与血碳浓度成指函数关系。以血碳为纵坐标,时间为横坐标,两者呈直线关系。此直线率K 表示吞噬率。动物肝脏、脾脏影响吞噬率,一般以矫正吞噬指数a 表示。
小鼠尾静脉注射稀释的印度墨汁,按每10 g质量0.1 mL 计算。待墨汁注入,立即计时,注入墨汁后2,10 min,分别从内眦静脉丛取血20 μL,并将其加到2 mL Na2CO3溶液中。在600 nm 波长处测光密度值(OD600nm),以Na2CO3溶液作空白对照。将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,称质量。

式中,OD1,OD2——分别为反应10,20 min 时的光密度值;t2,t1——分别为10,20 min。
受试样品吞噬指数a 显著高于对照组 (P<0.05),判定阳性。
1.3.8 NK 细胞活力检测[16]正常情况下,细胞中LDH 不能透过细胞膜,当细胞受到NK 细胞杀伤后LDH 释放到胞外。而LDH 可将MTT 分解成蓝色颗粒,且颗粒生成量与活细胞数量及细胞活化状态呈线性关系。
脾脏分离出NK 细胞与YAC-1 淋巴瘤细胞共同培养,利用CCK-8 试剂盒检测NK 细胞活力。
受试样品的NK 细胞活力显著高于对照(P<0.05),判定阳性。
1.3.9 统计学分析 利用SPSS17.0 对结果进行统计学处理,组间均数比较采用t 检验,P<0.05 为差异显著,具有统计学意义。
2 结果与分析
2.1 小鼠体重及免疫脏器指数
2.1.1 小鼠体重 在规定饲养时间检测各组小鼠体重变化,其结果如表2所示。

表2 小鼠体重变化(n=12)Table 2 The change of body weight in mice (n=12)
由表2可知,4 个试验组小鼠体重随饲养时间延长逐渐升高。采用SPSS17.0 数据处理软件进行统计学分析,组间均数比较采用t 检验。结果显示,不同试验组在不同饲养时期,组间无显著差异。说明MN-BM-A01 低、中、高剂量组不影响小鼠体重增长。试验期间,各组小鼠健康状况良好,无腹泻、增肥等不良现象,未发现小鼠有中毒或自然死亡。
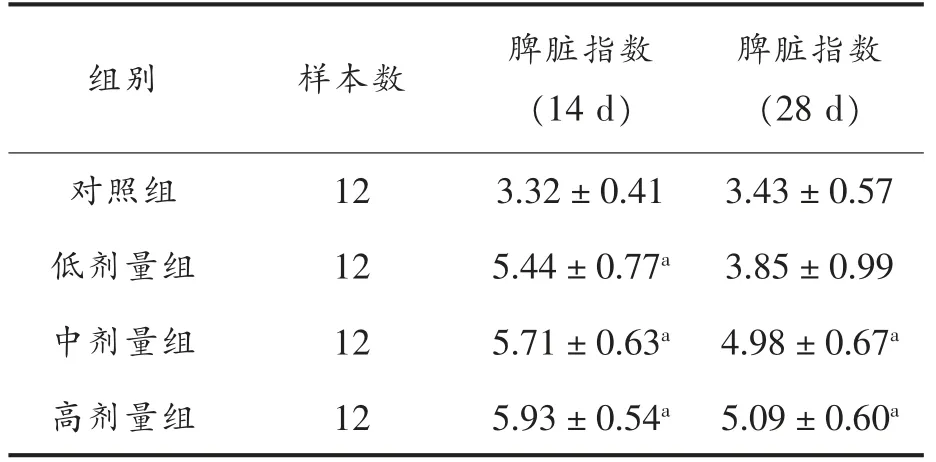
表3 脾脏指数(mg/g)Table 3 The spleen index (mg/g)
2.1.2 免疫脏器指数 小鼠免疫脏器指数测定结果如表3及表4所示。
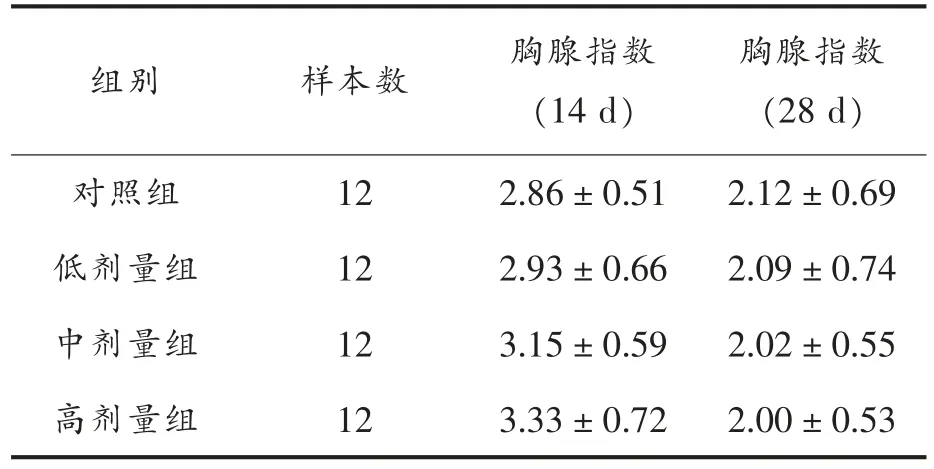
表4 胸腺指数(mg/g)Table 4 The thymus index (mg/g)
由表3可以看出,14 d 后,MN-BM-A01 低剂量组、中剂量组及高剂量组脾脏指数与对照组相比显著提高(P<0.05)。28 d 后,低剂量组与对照组无显著差异,中剂量组和高剂量组与对照组相比显著提高(P<0.05)。上述结果表明,MN-BM-A01对14 d 小鼠脾脏指数有显著影响,而随着时间延长会逐渐减弱,到28 d 时,低剂量组对小鼠脾脏指数影响不显著。
由表4可以看出,14 d 及28 d 后,低剂量组、中剂量组及高剂量组胸腺指数与对照组相比,均无明显差异。表明MN-BM-A01 对小鼠胸腺指数影响不显著。
2.2 血清IgG 及IgM 含量
小鼠血清中IgG 及IgM 含量测定结果如表5所示。
由表5可以看出,MN-BM-A01 低剂量组、中剂量组、高剂量组血清中IgG 含量均显著高于对照组(P<0.05),各剂量组间无显著差异。结果表明,MN-BM-A01 可以有效提高血清中IgG 含量。
MN-BM-A01 中剂量组、高剂量组血清中IgM含量显著高于对照组(P<0.05),低剂量组血清中IgM 含量与对照组无明显差异。同时,中剂量组和高剂量组血清中IgM 含量显著高于低剂量组(P<0.05)。表明MN-BM-A01 的中高剂量可以有效提高血清中IgM 的含量,而低剂量对血清中IgM 含量影响不显著。
2.3 小鼠粪便中sIgA 含量
小鼠粪便中sIgA 含量测定结果如表6所示。
由表6可以看出,MN-BM-A01 高剂量组粪便中sIgA 含量显著高于对照组(P<0.05);低剂量组和中剂量组小鼠粪便中的sIgA 含量与对照组相比差异不显著。
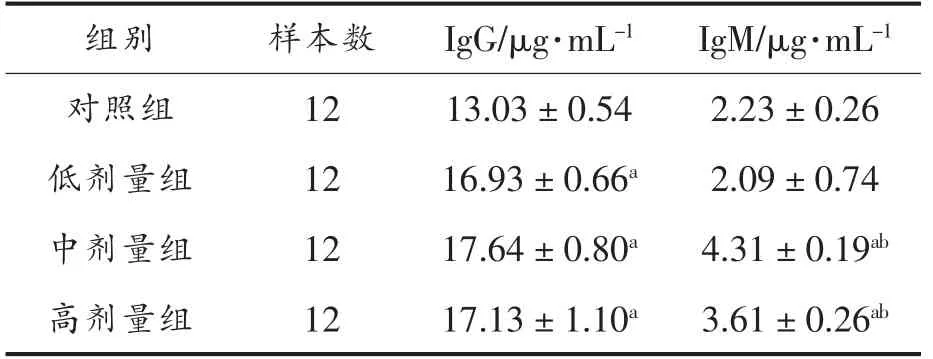
表5 血清中IgG 及IgM 含量测定结果Table 5 The determination results of serum IgG and IgM content
2.4 淋巴细胞转化
试验对MN-BM-A01 3 个剂量组进行了淋巴细胞转化试验,其结果如图1所示。
由图1可以看出,低剂量组光密度值差为0.41,经t 检验后表明与对照组0.36 无明显差异。中剂量组和高剂量组光密度值差均显著高于对照组(P<0.05)。由于有中、高两个剂量组显著高于对照组,小鼠淋巴细胞转化试验(细胞免疫)结果为阳性。MN-BM-A01 可以显著促进脾淋巴细胞增殖。
2.5 血清溶血素
试验对MN-BM-A01 3 个剂量组进行血清溶血素测定,通过测定血红蛋白含量反映动物血清中溶血素的生成水平 (HC50)。试验结果如图2所示。

表6 粪便中sIgA 测定结果Table 6 Faeces sIgA determination results
由图2可以看出,MN-BM-A01 低剂量组HC50为19.42,中剂量组为20.16,高剂量组为21.33,经t 检验,结果表明,各剂量组与对照组(18.24)均无明显差异。由于3 个剂量组中没有一个剂量组显著高于对照组,小鼠血清溶血素测定试验结果为阴性。
2.6 碳廓清试验
试验对MN-BM-A01 低、中、高3 个剂量组进行了碳廓清试验,并与对照组进行对比,其结果如图3所示。
由图3可以看出,MN-BM-A01 低、中、高剂量组碳廓清指数分别为0.59,0.65 和0.78,均显著高于对照组的0.33(P<0.05)。因此,小鼠碳廓清试验结果为阳性。结果证实MN-BM-A01 显著提高小鼠吞噬细胞吞噬能力。
2.7 NK 细胞活力
小鼠NK 细胞活力测定结果如图4所示。
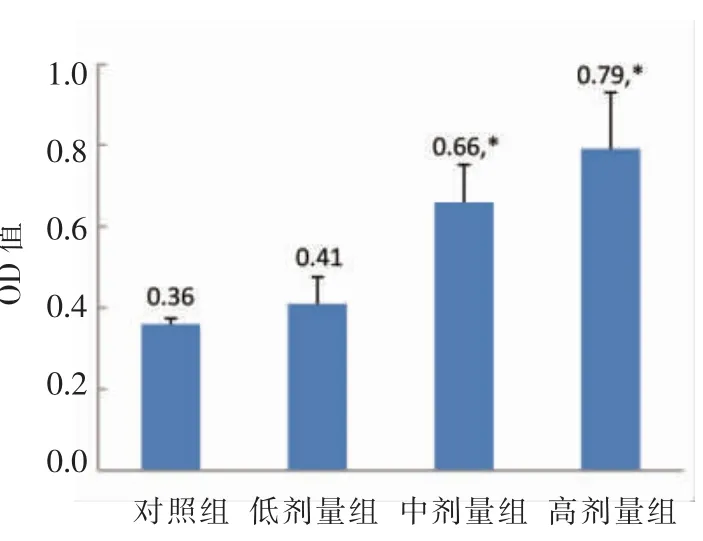
图1 淋巴细胞转化能力Fig.1 The lymphocyte transformation capability
由图4可知,MN-BM-A01 3 个剂量组中,低剂量组与中剂量组NK 细胞活力与对照组无明显差异;高剂量组NK 细胞活力为22.16,显著高于对照组(12.05),P<0.05。结果显示,MN-BM-A01高剂量显著提高小鼠NK 细胞杀伤活性。
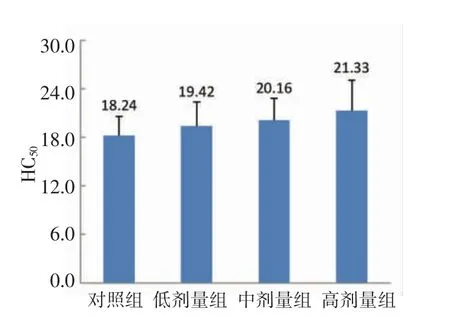
图2 半数溶血值测定结果Fig.2 Half hemolysis value determination results

图3 碳廓清指数Fig.3 The carbon clearance index
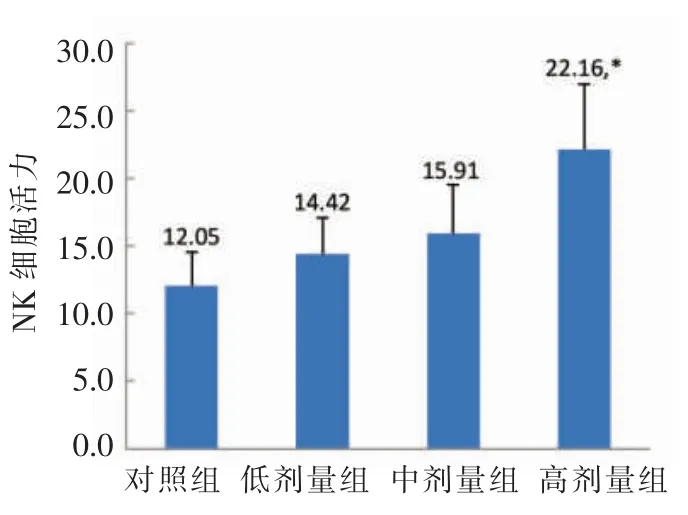
图4 NK 细胞活力Fig.4 NK cells activity
3 结论
以清洁级雄性昆明小鼠为动物模型,对MNBM-A01 菌株的免疫调节作用进行试验评价。结果显示:饲喂MN-BM-A01 菌株的小鼠健康状况良好,可以有效提高血清中IgG、IgM 的含量以及小鼠粪便中sIgA 的含量,促进脾淋巴细胞增殖,提高吞噬细胞和NK 细胞活力。MN-BM-A01 菌株具有增强小鼠免疫力的作用。
