薄荷油纳米乳液的稳定机制及抑菌特性
2020-08-03张潇元王中江江连洲车佳玲朱一方钟春艳
张潇元 潘 悦 王中江 江连洲 车佳玲 朱一方 钟春艳
(1 北京市农林科学院农业信息与经济研究所 北京100097 2 东北农业大学食品学院 哈尔滨150030)
纳米乳液是粒径在10~200 nm 之间的一种乳化运输体系,与常规微米级液滴粒径的乳液相比,纳米级粒径的乳液赋予体系特殊的小尺寸、高表面活性和强吸附等特性,进而对体系的物理化学稳定性和所运载营养物质的体内吸收起到增强效果。同时,通过纳米乳液针对特定功能性物质而构建的营养素的包埋与传递,在极大程度上解决了挥发型营养素水性介质中溶解度差,生物利用率低,易挥发,易氧化,对光、热敏感等问题。纳米乳液在贮存过程中无絮凝、聚集、沉淀、奥斯特瓦尔德熟化现象[1],被看成是一种“近热力学稳定”体系[2]。
近年来,制备纳米乳液的方法大致可分为低能乳化法和高能乳化法,其中高能乳化法主要利用高压微射流、高压均质机和超声波处理。高压均质法作为制备纳米乳液的主要方法,其原理是将制备好的粗乳液随高压通过细小的均质头,经过强烈振动和液压剪切作用,使粗乳液形成极小粒径的乳液。Chu 等[3]采用高压均质结合有机溶剂挥发的方法,通过向油相中加入挥发性有机溶剂,形成乳液后再蒸发油相液滴内的有机溶剂,降低分散相液滴粒径,成功制备了以酪蛋白酸钠为乳化剂粒径17 nm 的β-胡萝卜素纳米分散体。Chu 等[4]研究了以该方法制备纳米乳液的物理稳定性,结果发现以酪蛋白酸钠为乳化剂时乳液表现出很好的抗热、酸和离子强度的作用。然而,随着人们对食品安全以及纳米颗粒潜在生物毒性关注度的提高,这些合成或半合成的化学乳化剂在食品配方中的使用引起人们的普遍担心。选用一种较为安全的生物兼容乳化剂,是现在研究的重点[5]。
本研究以大豆分离蛋白、磷脂酰胆碱为乳化剂,通过高压均质机乳化制备薄荷油纳米乳液,研究薄荷油纳米乳液的微观结构、稳定性和抑菌特性,为制备均一、稳定的薄荷油纳米乳液,提高薄荷油的稳定性和生物利用度提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 (Soybean protein isolate,SPI)蛋白质量分数89.21%,山东省高唐蓝山集团;磷脂酰胆碱(Phosphatidyl choline,PC),北京索莱宝科技有限公司;薄荷油、胰酪胨大豆肉汤、胰酪胨大豆酵母浸膏琼脂、甘油,美国Sigma 公司;单增李斯特菌、金黄色葡萄球菌,中国检验检疫微生物菌种保藏管理中心;氢氧化钠、磷酸二氢钠、磷酸氢二钠均为分析纯级试剂。
1.2 设备与仪器
T18 Basic 型高速分散机,德国IKA 公司;实验型高压均质机,英国Stansted Fluid Power 公司;超净工作台,美国PE 公司;激光扫描3D 共聚焦显微镜,英国Malvern 仪器有限公司;Zetasizer Nano ZSP 型纳米粒径电位仪,英国Malvern 仪器有限公司。
1.3 试验方法
1.3.1 薄荷油纳米乳液的制备 参照Lee 等[6]的方法将SPI 和PC 溶于0.1 mol/L、pH 值7.0 的磷酸盐缓冲液中,置于25 ℃条件下连续搅拌120 min,形成水相,在高速分散器的搅拌下把薄荷油作为油相加到水相中,20 000 r/min 剪切5 min,形成粗乳液。将粗乳液通过高压均质机进一步均质乳化即得薄荷油纳米乳液。高压均质处理方法及条件设定参考Sorgentini 等[7]并略做修改。高压均质机的均质压力为80 MPa,均质次数4 次,采用冰水浴保持低温。
1.3.2 纳米乳液的冷冻扫描电镜观察 使用冷冻扫描电镜观察薄荷油纳米乳液的微观结构[8]。将1滴纳米乳液浸泡在约-180 ℃的液态氮泥浆中。将样品在真空条件下转移到低温电子显微镜样品制备室。在-90 ℃制备室内,使用精密的旋转刀将冷冻样本断裂并升华3 min。随后置于离子溅射仪的样品舱中,在11 mA 的电流下喷金2 min,样品取出后,装入扫描电子显微镜观察室进行观察。
1.3.3 纳米乳液的稳定性测定
1.3.3.1 pH 值 用0.1 mol/L HCl 和0.1 mol/L NaOH 调节薄荷油纳米乳液pH 值为3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,静置2 h 后,测定乳液的平均粒径、ζ 电位和浊度。
1.3.3.2 离子强度配制0.1,0.2,0.3,0.4,0.5 mol/L 的NaCl 溶液和0.01,0.02,0.03,0.04,0.05 mol/L 的CaCl2溶液。将薄荷油纳米乳液用不同浓度的NaCl 溶液和CaCl2溶液稀释1 倍,静置2 h后,测定乳液平均粒径、ζ 电位和浊度。
1.3.3.3 冷冻-融化 将薄荷油纳米乳液在-18℃冷冻24 h,于室温(25 ℃)解冻,测定乳液平均粒径、ζ 电位和浊度。
1.3.3.4 纳米乳液的贮藏稳定性分析 将制备的薄荷油纳米乳液分别于4,25,55 ℃放置30 d,每5 d 测定1 次乳液的平均粒径、ζ 电位、薄荷油的保留率。
1.3.3.5 纳米乳液中薄荷油含量测定 薄荷油含量的测定参考Kim 等[9]的方法并略做修改,称取适量制备好的薄荷油纳米乳液与少量水均匀混合,再倒入300 mL 去离子水,常压水蒸气蒸馏1.5 h后,待油柱高度在一定时间内不发生变化时,记录油柱体积V。
1.3.3.6 贮藏过程中薄荷油保留率测定 采用1.3.3.5 节中的方法,测定其中所剩薄荷油的含量,薄荷油的保留率按式(1)计算。
式中,m1——最初称量薄荷油纳米乳液的质量,g;m2—— 一段时间后称量薄荷油纳米乳液的质量,g;V1——将质量为m1的薄荷油纳米乳液蒸馏后所得油的体积,mL;V2——将质量为m2的薄荷油纳米乳液蒸馏后所得油的体积,mL。
1.3.4 薄荷油及薄荷油纳米乳液的抑菌特性测定
活动之后,我做了两次安抚。一次是对同学们的安抚,主要是详述解忧杂货店各位店员的付出和努力,以取得同学们的理解和支持;一次是对店员的安抚,毕竟是第一次,积极的肯定会让他们更勇敢地面对自身存在的问题。后来,店长黎一鸣发来了反思总结:
1.3.4.1 抑菌液的制备 将保存在固体培养基上的单增李斯特菌、金黄色葡萄球菌接到液体培养基中,置于37 ℃恒温培养箱振荡36 h。液体培养基中的菌落密度约为109CFU/mL,然后用液体培养基将稀释后的浓度控制在104CFU/mL 范围内。
1.3.4.2 最低抑菌浓度的测定 根据Hammer 等[10]的方法略做修改,通过琼脂稀释法将两倍稀释梯度浓度的对照组薄荷油和薄荷油纳米乳液置于15 mL 的固体培养基中,使其体积分数范围从4%~0.0125%。移取配制好的菌液5 μL 于培养基表面。固体空白培养基和体积分数为4%不含薄荷油的纳米乳液为对照。将平板于37 ℃恒温培养箱中培养24 h。
1.3.4.3 菌落生长曲线的测定 为进一步测定单增李斯特菌和金黄色葡萄球菌在加有最低抑菌浓度下的纯薄荷油和薄荷油纳米乳液的生长情况,研究采用平板计数法观察菌落总数随时间变化的情况。分别在0,1,3,6,9,12,24,36 h 取菌液0.1 mL,通过十进制制备稀释液,将其涂布于固体培养基中,于37 ℃恒温培养24 h 后计数,绘制微生物生长曲线。
1.3.5 数据统计分析 每次试验做3 次平行,结果用平均值±标准差表示,利用SPSS Statistics 22软件对数据进行ANOVA 差异显著性分析,P<0.05为显著性差异。采用Origin9.1 软件进行数据分析、图表处理及图谱分析处理。
2 结果与分析
2.1 纳米乳液的冷冻扫描电镜观察
扫描电镜在图像分析中起重要作用,它可以提供高分辨率的信息,其观察效果远远超过了光学显微镜。本研究利用冷冻扫描电镜(Cryo-SEM)技术,对高压均质制备的薄荷油纳米乳液的液滴大小进行验证,同时对纳米乳液表面结构进行可视化处理。将样品放置在支架并安装在运输棒上后,在液氮中冷冻,然后转移到冷冻室冻裂,再将其溅到金/钯上。最后将样品移至扫描电镜室观察液滴表面。试验结果如图1所示,采用SPI 为表面活性剂制备的薄荷油纳米乳液液滴呈规则的球形且表面连续、光滑、无孔隙和裂缝。连续、致密的表面结构一定程度上可以阻止薄荷油中的生物活性成分薄荷醇、薄荷酮在贮藏时挥发,且可以有效阻止O2透过乳滴界面与油相接触,进而阻止生物活性成分氧化。同时,结果表明所述纳米乳液液滴均匀分布且几乎没有可见的表面油脂,稳定性优良。

图1 薄荷油纳米乳液的冷冻扫描电镜图像Fig.1 Microscope images of peppermint oil nanoemulsion by Cryo-scanning electron microscopy
2.2 pH 值对纳米乳液稳定性的影响
研究表明,pH 值会影响大豆分离蛋白的溶解度和乳化稳定性,进而影响纳米乳化体系的动力学稳定性。研究pH 值对薄荷油纳米乳液的物理稳定性的影响十分必要。测定pH 3~10 范围内薄荷油纳米乳液的平均粒径、粒径分布、浊度、ζ 电位的变化如图2所示。结果表明,pH 值在3.0~5.0 范围内,随着pH 值的增加,粒径分布比较分散,此时薄荷油纳米乳液的平均粒径较大,且pH 4.0 时,薄荷油纳米乳液的平均粒径达到最大值1 550 nm,这是因为在SPI 等电点附近,蛋白表面电荷被中和,蛋白质分子间的静电排斥力减小,蛋白的溶解度降低,易发生液滴聚合形成较大的聚合体[11],导致纳米乳液的平均粒径增大,表明酸性环境对薄荷油纳米乳液的破坏作用较大。当pH 值在6.0~10.0 范围内,薄荷油纳米乳液的平均粒径较小,且pH 7.0 时,薄荷油纳米乳液的平均粒径最小,这是因为此时乳液pH 值远离SPI 等电点,乳液的蛋白表面电荷数量增加,静电斥力变强,导致液滴聚集现象减弱,粒径分布较为集中,表明碱性环境内薄荷油纳米乳液表现出良好的稳定性。苏佳琪等[12]研究结果表明,在pH 3.0~10.0 范围内,纳米乳液的平均粒径随着pH 值的增大呈先升高再降低后呈相对稳定的趋势,这与本文研究结果一致。薄荷油纳米乳液的ζ 电位变化如下,pH 值在3.0~6.0 范围内,乳化体系的ζ 电位绝对值先减小后增加,主要原因在于酸性环境中随着pH 值的增加,SPI 表面的H+离子逐渐解离,其表面电性减弱,薄荷油纳米乳液的ζ 电位绝对值逐渐减小,在SPI 等电点附近薄荷油纳米乳液的ζ 电位绝对值达到最小值,随着pH 值的增加,此时SPI 表面暴露出更多的带电基团,乳液的ζ 电位绝对值逐渐增大;pH 值大于7.0 时,SPI 表面带电基团完全解离,乳液的ζ 电位趋于稳定[13]。薄荷油纳米乳液的浊度变化呈先增大后减小后逐渐稳定的趋势,结果表明,碱性环境中薄荷油纳米乳液的浊度变化较小。综上所述,以SPI-PC 为表面活性剂制备的薄荷油纳米乳液具有较强的酸碱抵抗力,且在碱性环境下,纳米乳液表现出良好的物理稳定性。
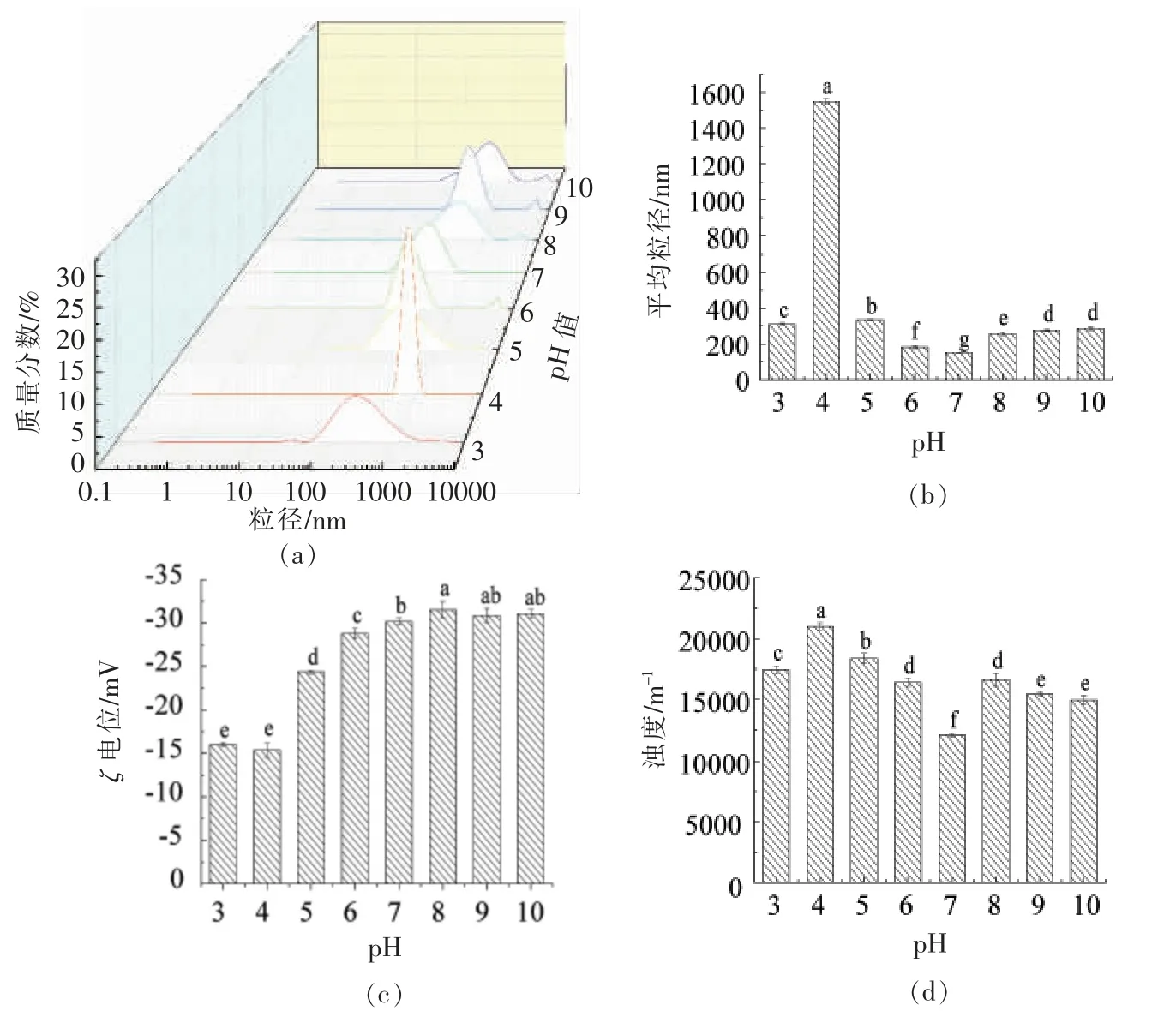
图2 pH 值对纳米乳液平均粒径、粒径分布、ζ 电位、浊度的影响Fig.2 Effect of pH value on the average size,particle size distribution,ζ-potential and turbidity of nanoemulsion
2.3 离子强度对纳米乳液稳定性的影响
Na、Ca 离子对薄荷油纳米乳液稳定性的影响类似但不完全相同,Ca 离子浓度增加对薄荷油纳米乳液的平均粒径、粒径分布、浊度、电位的影响更大。这是由于盐离子对乳液稳定性的影响主要由蛋白质的疏水作用而发挥其功能,故离子价态不同,对乳液的稳定性影响程度也不同。陈霞等[20]研究表明随着离子价态的增大,蛋白稳定性随之下降;朱振宝等[21]也发现Ca 离子对乳液稳定性影响明显大于Na 离子。上述结果表明薄荷油纳米乳液是具有一定抵抗盐离子能力而存在的乳化体系。
2.4 薄荷油纳米乳液贮藏稳定性分析
2.4.1 纳米乳液的物理稳定性分析 大量研究表明,在乳液的运输贮藏过程中,温度对其理化稳定性具有显著影响。具体表现为温度升高会引起乳液奥斯特瓦尔德熟化加剧以及布朗运动增强,进而引起乳液的破乳或液滴聚合等现象。因此,如何构建一种乳化体系,在乳液的保质期内保持良好的物理稳定性是纳米乳液应用于食品、保健品等领域的重要问题。
本研究将薄荷油纳米乳液在4,25,55 ℃条件下贮藏30 d,结果如图5所示。在3 个贮藏温度下,薄荷油纳米乳液都出现平均粒径和ζ 电位增大的现象。在4 ℃贮藏30 d 后,乳液的平均粒径由151.1 nm 增加到182.1 nm,在25 ℃贮藏30 d 后,薄荷油纳米乳液的平均粒径分别增大到221.3 nm。在55 ℃时,乳液的平均粒径变化趋势一致,增大到236.4 nm。已有研究表明,在长期贮藏过程中温度升高时乳液表面活性剂发生降解,从而失去活性。同时布朗运动加剧导致乳液液滴间的碰撞加剧,导致液滴聚合,进而导致薄荷油纳米乳液的粒径增大[22]。然而薄荷油纳米乳液在4,25,55 ℃条件下贮藏30 d,平均粒径仍能保持在纳米级的液滴范围内且未出现破乳或相分离现象,同时薄荷油纳米乳液的ζ 电位均处于-35~-30 mV 之间,维持在乳液稳定的范围内。上述结果表明薄荷油纳米乳液在长期贮藏过程中具有良好的物理稳定性。
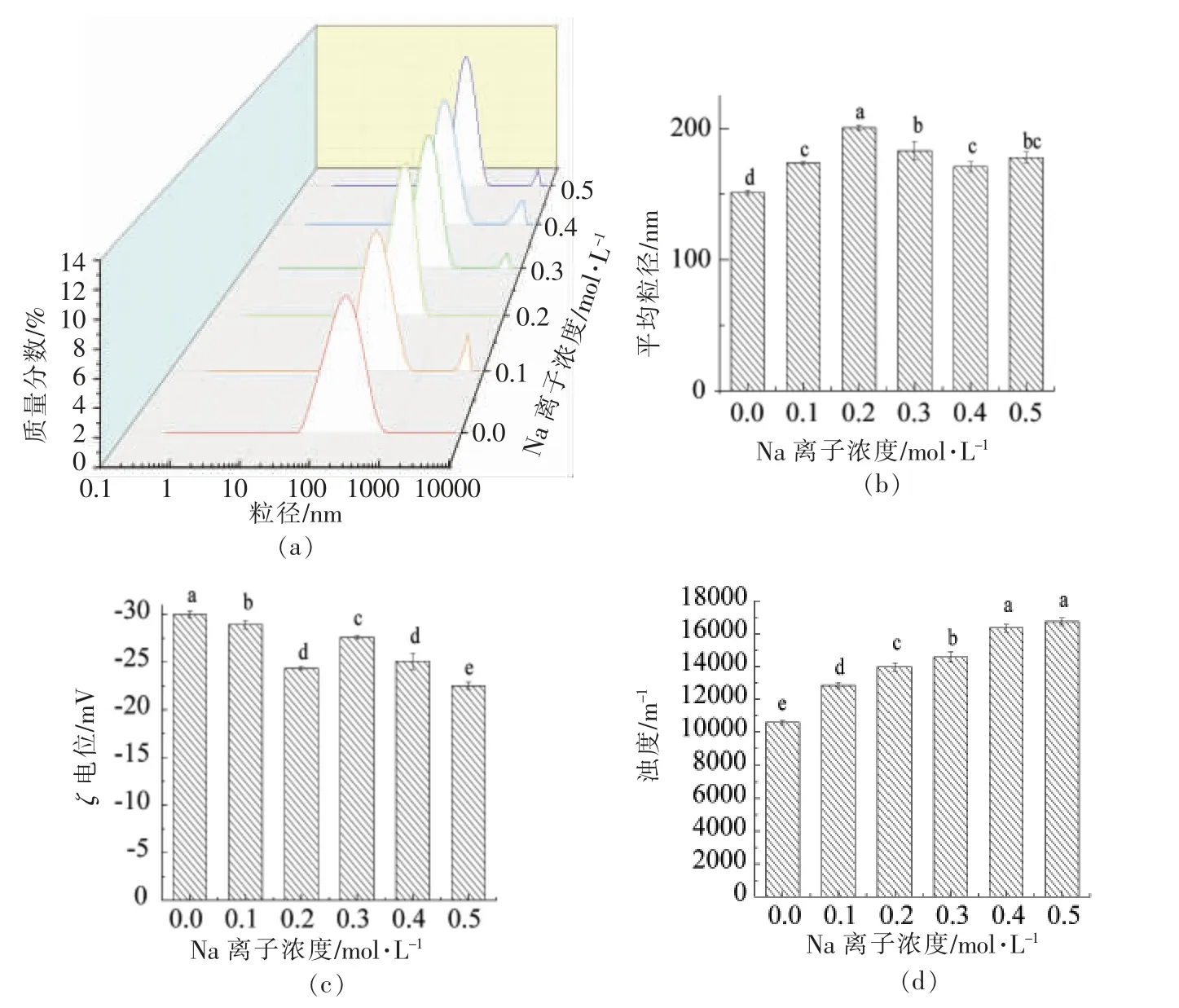
图3 Na 离子浓度对纳米乳液平均粒径、粒径分布、ζ 电位、浊度的影响Fig.3 Effect of Na+ concentration on average size,particle size distribution,ζ-potential and turbidity of nanoemulsion
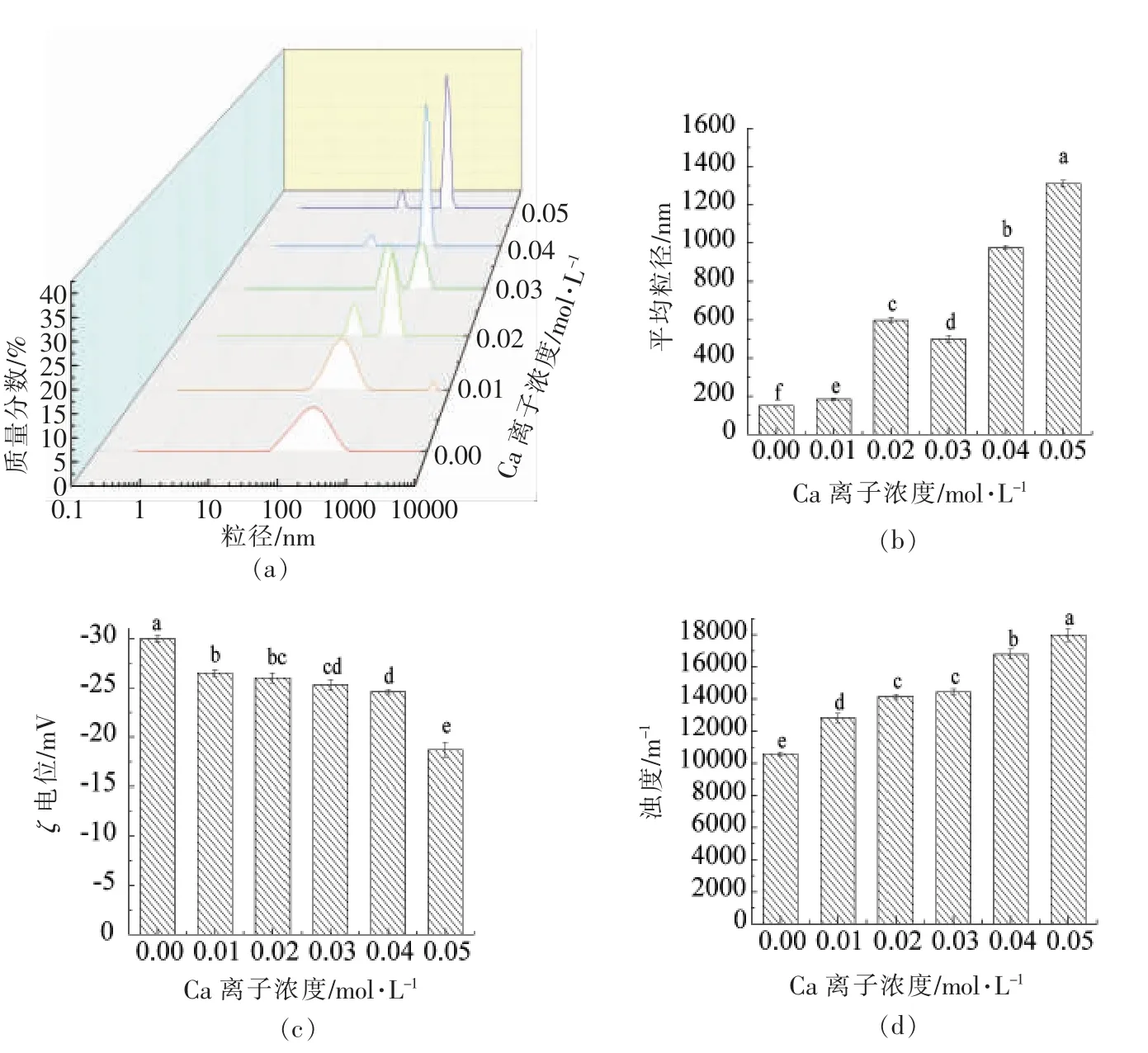
图4 Ca 离子浓度对纳米乳液平均粒径、粒径分布、ζ 电位、浊度的影响Fig.4 Effect of Ca2+ concentration on average size,particle size distribution,ζ-potential and turbidity of nanoemulsion
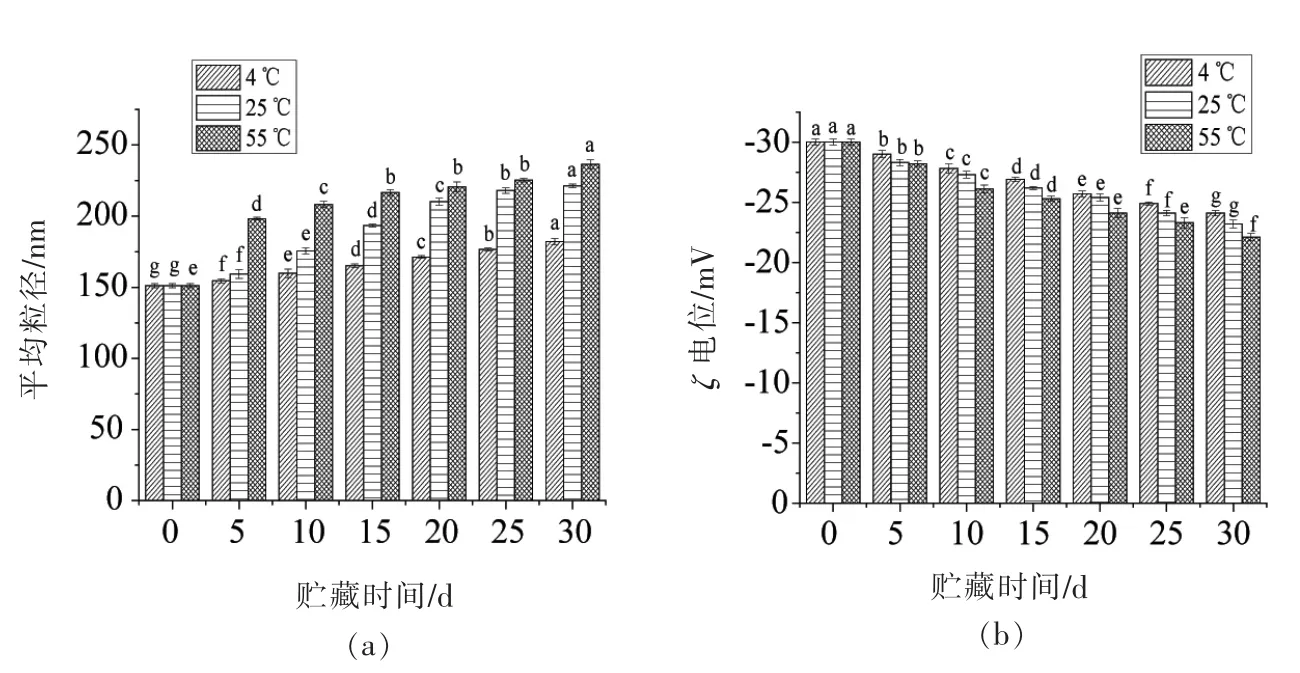
图5 贮藏过程中纳米乳液平均粒径和ζ 电位的变化Fig.5 Change of average size and ζ-potential of nanoemulsion during storage
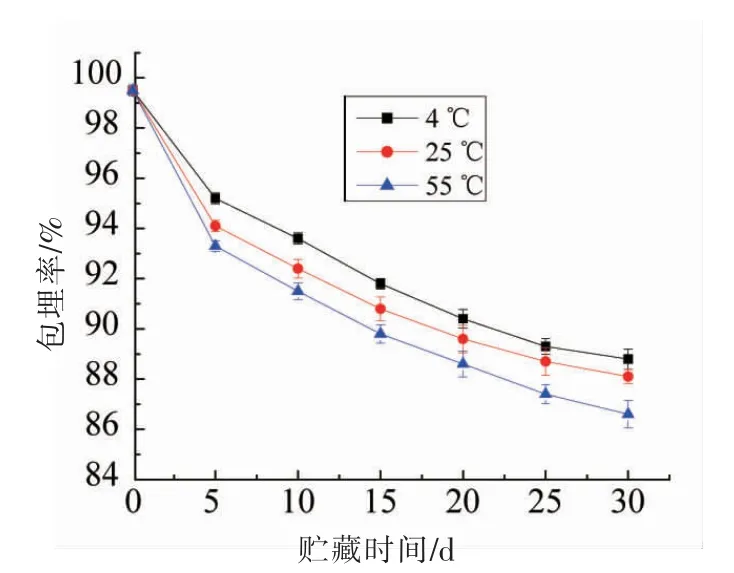
图6 薄荷油包埋率随贮藏时间的变化Fig.6 Change of embedding rate of peppermint oil with storage time
2.4.2 纳米乳液的化学稳定性分析 将薄荷油纳米乳液分别置于4,25,55 ℃下贮藏30 d,然后进行化学稳定性比较分析,通过测定3 个温度下薄荷油的包埋率反映生物活性物质的化学稳定性[23]。如图6所示,在薄荷油纳米乳液贮藏期间,薄荷油的含量逐渐减小,且随着贮藏时间的延长,包埋率的下降速率逐渐减小。根据纳米乳液物理稳定性试验结果表明,随着贮藏时间的延长,乳化体系的平均粒径增大,液滴界面面积减小,液滴与水相中自由基及促氧化剂的接触面积减小,导致纳米乳化体系包埋率的降低速率减小[24]。贮藏30 d 后,薄荷油在乳液中的包埋率均在85%以上,贮藏性良好。结合乳液平均粒径与ζ 电位变化可知,纳米乳化体系在高温下促进液滴聚合,建议将制备好的薄荷油纳米乳液置于4 ℃下贮藏。
2.5 纳米乳液抗菌特性的研究
本研究选用两种典型的革兰氏阳性菌株单增李斯特菌和金黄色葡萄球菌为检测菌,考察薄荷油在纳米乳液包埋前、后的抗菌特性变化。
2.5.1 纳米乳液最小抑菌浓度测定 通过琼脂平板稀释法检测了空白对照薄荷油和薄荷油纳米乳液对单增李斯特菌和金黄色葡萄球菌的最低抑菌浓度,由表1所示,空白对照薄荷油对两种菌株的最低抑菌浓度均为0.5%,表明薄荷油对两种菌株的抑制效果一致,分析原因由于两种菌株均为革兰氏阳性菌,细胞壁结构相近,因此两种菌株对薄荷油及薄荷油纳米乳液的敏感性相近。Vuuren等[25]研究结果表明,薄荷油作为抑菌剂对微生物的抑菌效果处于中等抑制范围,与本研究结果一致。与空白对照薄荷油的抑菌效果相比,薄荷油纳米乳液的最低抑菌浓度也为0.5%,此结果表明制成纳米乳液乳化体系并未改变薄荷油的抑菌能力,主要原因在于纳米乳化体系会对营养物起到保护作用,进一步阻止其氧化和挥发。Sharif 等[26]研究的黑孜然精油与黑孜然精油纳米乳液的MIC值均为0.08%,此结果与本试验结果一致。
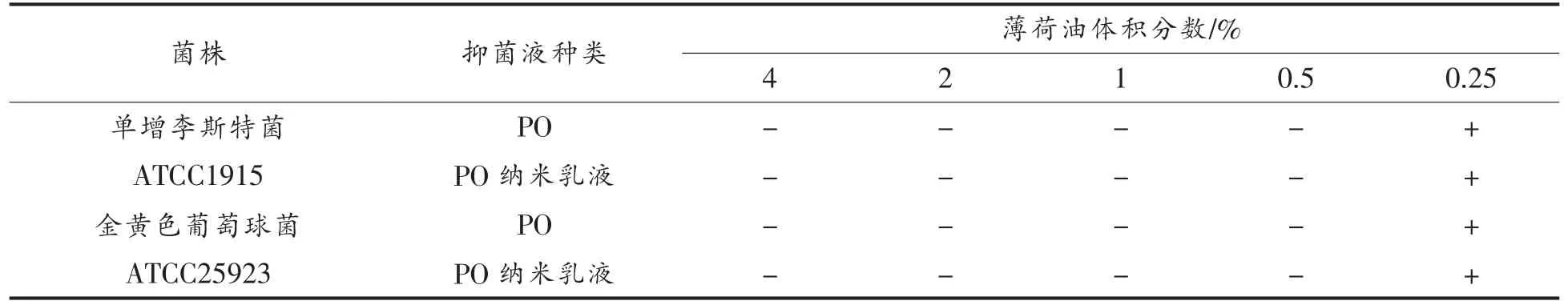
表1 薄荷油和薄荷油纳米乳液对单增李斯特菌和金黄色葡萄球菌抗菌特性的影响Table 1 Antimicrobial properties of peppermint oil and peppermint oil nanoemulsion againt L.monocytogenes and S.aureus
2.5.2 微生物生长曲线的测定 为进一步考察薄荷油与薄荷油纳米乳液对两种菌株生长的影响,将两种菌液同最低抑菌浓度的薄荷油与薄荷油纳米乳液共同培养,通过平板计数法考察36 h 内对其生长曲线的影响。如图7所示,纳米乳液对照组对单增李斯特菌和金黄色葡萄球菌两种菌落均无抑菌作用。薄荷油与薄荷油纳米乳液对两种菌株的生长具有抑制作用,由图7a 可知,经最低抑菌浓度薄荷油纳米乳液处理的单增李斯特菌液,其菌落总数在第9 小时从104CFU/mL 下降到101CFU/mL,随时间延长又迅速上升,置于恒温培养箱培养36 h 后,薄荷油纳米乳化体系包埋处理的菌落总数控制在103CFU/mL,而纯薄荷油的菌落总数已达到107CFU/mL。比较薄荷油对金黄色葡萄球菌与单增李斯特菌的生长曲线可知,金黄色葡萄球菌的生长更缓慢,表明金黄色葡萄球菌对薄荷油的抑菌能力更敏感,将其在37 ℃恒温培养5 h 后,发现菌落数从104CFU/mL 下降至101CFU/mL,将薄荷油经纳米乳化包埋后的抗菌作用时间延长至24 h 左右,菌落总数才开始回升。恒温培养36 h 后,薄荷油纳米乳液处理的菌落总数增长控制在103CFU/mL 左右,相比之下对照组薄荷油处理的菌落总数已经增长至105CFU/mL。
上述结果表明,虽然薄荷油和薄荷油纳米乳液对单增李斯特菌和金黄色葡萄球菌的最低抑菌浓度相同,然而比较两种菌株恒温培养36 h 的生长曲线可知,薄荷油纳米乳液具有比薄荷油持续时间更长的抑菌能力。主要原因在于纳米级的粒径有利于减小乳液的传质阻力,一定程度上提高了两种菌株被动吸附薄荷油的能力,进一步提高了薄荷油的抑菌能力,薄荷油经纳米乳化体系包埋后,其理化稳定性与溶解度均有所提高,增大了连续相中精油生物活性成分与微生物相互作用的机率,同时在菌液培养过程中,纳米乳液具有控制释放的作用,不仅能够保证薄荷油的生物活性成分免遭破坏,更可以达到延长抑菌时间的效果[27]。此类结果与Wang 等[28]的研究结果类似。
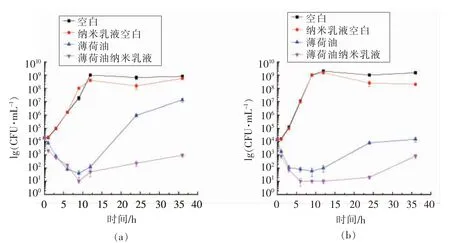
图7 薄荷油和薄荷油纳米乳液对单增李斯特氏菌和金黄色葡萄球菌的生长抑制曲线Fig.7 Time-kill plots for bulk peppermint oil and peppermint oil nanoemulsions against L.monocytogenes and S.aureus
3 结论
本文研究了薄荷油纳米乳液的微观结构、稳定机制及功能特性。冷冻扫描电镜结果表明纳米乳液中薄荷油完全被SPI 包埋,呈核壳状结构。物理稳定性研究发现薄荷油纳米乳液具有良好的pH 值、离子强度抵抗性,碱性环境有利于薄荷油纳米乳液稳定性的保持。Na、Ca 离子对薄荷油纳米乳液稳定性的影响类似但不完全相同,Ca 离子浓度增加对薄荷油纳米乳液稳定性的影响大于Na 离子。在4,25,55 ℃下贮藏30 d 后,乳液的粒径增加30~50 nm,仍保持在纳米级粒径范围内,同时化学稳定性结果表明3 种温度下贮藏30 d的纳米乳化体系的薄荷油保留率均高于85%,乳液无明显分层现象,薄荷油纳米乳液表现出良好的贮藏稳定性。薄荷油纳米乳液的抑菌特性结果显示薄荷油纳米乳液对单增李斯特菌和金黄色葡萄球菌的最小抑菌浓度均为0.5%,此结果与对照组薄荷油的抑菌效果相一致,然而从两种微生物在36 h 的生长曲线结果可知,薄荷油纳米乳液具有时效更长的抑菌特性。
