不同单糖组成的低聚糖对人肠道菌群的调节作用
2020-08-03王海松任鹏飞
王海松 任鹏飞
(1 常熟理工学院生物与食品工程学院 江苏常熟215500 2 安徽农业大学茶与食品科技学院 合肥230036)
肠道是人体消化吸收的重要场所,具有消化功能和屏障功能。肠道内寄居着大约1 014 个微生物,构成了相对稳定的微生态[1-2]。近年来,大量研究表明肠道菌群在调控宿主的免疫系统、激素分泌、大脑(肠-脑轴)及其它代谢通路过程中扮演着重要角色[3-4]。由于许多疾病与肠道菌群紊乱相关[5-6],因此肠道菌群成为代谢综合征的潜在治疗靶点。研究表明,益生元具有调节肠道微生态的作用,在膳食中添加益生元后,肠道微生物发酵益生元产生的代谢物不仅能够影响机体炎症,还能够通过影响激素分泌来调节饱腹感和能量收支、胰岛素功能以及免疫功能[7-8],上述作用可能与益生元选择性促进肠道中的有益菌增殖有关,如与肥胖及糖尿病呈负相关的双歧杆菌和乳杆菌[9];以及被肠道微生物代谢产生的短链脂肪酸(SCFA)相关。而SCFA 也被证实具有降低肠道pH 值,维持肠道渗透压,促进肠道上皮细胞分化,改善肠道屏障功能,调节饱腹感信号等功能[10]。
低聚糖一般被定义为含有3~10 个糖基的碳水化合物[11]。根据生理特性分为可消化性低聚糖和非消化性低聚糖。非消化性低聚糖由于其含有不能被人体自身的淀粉酶水解的单糖链接键型,因此可以“越过”胃、肠道到达结肠,被结肠中的微生物发酵利用,选择性促进有益菌的增殖,并被肠道微生物代谢产生短链脂肪酸,从而被认为是典型的益生元[12-13]。目前,对低聚糖的研究主要集中在其益生功效上,根据原卫生部有关低聚糖类新资源食品的公告,不同低聚糖发挥益生活性的最低剂量不同,如异麦芽低聚糖(葡萄糖基)为15~20 g,低聚果糖(果糖基)为5~20 g,低聚木糖(木糖基)为少于1.2 g,这可能与低聚糖的单糖构成及单糖链接类型有关;然而,单糖链接类型相同的低聚糖,如低聚甘露糖、异麦芽酮糖等,发挥益生活性的最低剂量也不同;可见,构成低聚糖的单糖种类对低聚糖的益生活性有较大影响。
近年来,大量研究表明健康人的粪便菌群结构与结肠菌群结构基本一致[14]。采用粪便微生物进行体外发酵试验是研究评价低聚糖益生功能的常用手段。本研究采用人体胃、肠模拟系统,研究了分别由3 种单糖(己醛糖):葡萄糖、半乳糖和甘露糖构成的聚葡萄糖、聚半乳糖和聚甘露糖对人肠道菌群的调节作用,综合评价不同单糖组成的低聚糖的益生能力。
1 材料与方法
1.1 材料与试剂
乙酸、丙酸、丁酸、戊酸、乙酸乙酯、蛋白胨,阿拉丁试剂(上海)有限公司;盐酸、氢氧化钠、浓硫酸均为分析纯级,国药集团化学试剂有限公司;Ezup 柱式细菌基因组DNA 抽提试剂盒,上海生工生物股份有限公司;阿拉伯半乳聚糖、果胶、木聚糖、淀粉、酵母粉、蛋白胨、半胱氨酸、粘蛋白,北京索莱宝科技有限公司;葡萄糖、半乳糖、甘露糖,国药集团化学试剂有限公司。
1.2 仪器及设备
胃肠道模拟系统,无锡瑞控物联网科技有限公司;Agilent 7890A 气相色谱,美国安捷伦公司;高速离心机,湖南可成仪器设备有限公司;YXQLS-50G 立式压力蒸汽灭菌锅,上海博讯实业有限公司。
1.3 培养基
参照Pieter 等[15]设计制备。
1.4 发酵菌源
以健康成人的粪便作为发酵菌源,要求参加试验的志愿者3 个月内未服用抗生素,且无肠胃病史。
1.5 低聚糖合成和肠道菌群发酵
发酵系统详见图1。结肠模拟罐中加入培养基270 mL,粪菌液30 mL,低聚糖6 g。37 ℃恒温水浴,磁力搅拌器搅拌。结肠模拟器的参数条件:温度(37±0.5)℃,pH 6.15~6.4,保护气体为高纯氮气,发酵时间24 h,每12 h 取发酵液测定短链脂肪酸(SCFA)含量和发酵液菌群总DNA 测序,发酵液pH 通过在线检测系统实时监控。
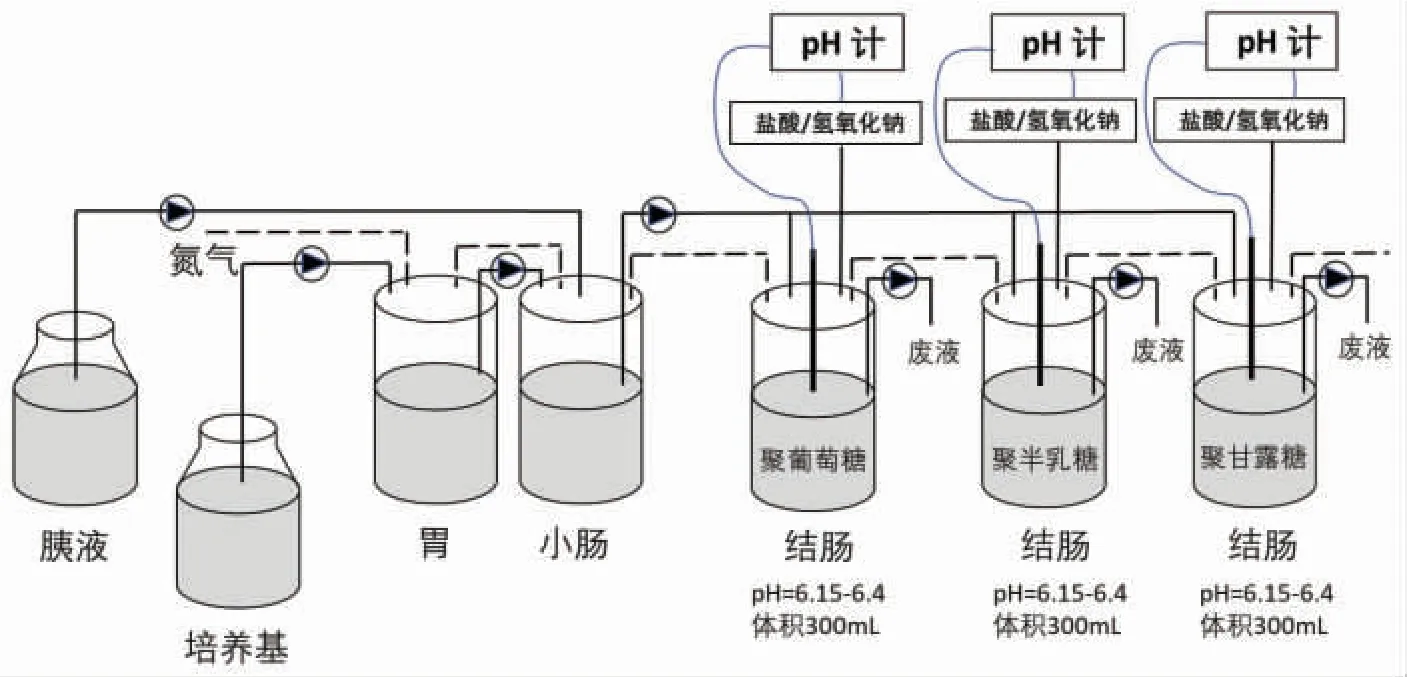
图1 胃肠道模拟系统示意图Fig.1 Schematic of the simulator of the human intestinal microbial ecosystem
1.5.1 低聚糖的合成 低聚糖的合成参考王海松等[16-19]的方法制备。
1.5.2 菌群收集与处理 取适量健康人体新鲜粪样,悬浮于蛋白胨缓冲液(pH 7.0)中,使菌液质量浓度为0.2 g/mL,700 r/min 离心3 min,取上清液。
1.5.3 菌液接种及发酵培养 在培养基中按照2%的添加量分别添加聚葡萄糖(PDX)、聚半乳糖(PGal)、聚甘露糖(PMan)为试验组,按照2%的添加量添加淀粉(Starch)为对照组;按照10%的接种量将1.2.1 节中得到的粪菌上清液接种到培养基中,并留存2 mL 粪菌上清液作为空白组NF。
1.6 发酵液菌群组成及短链脂肪酸的测定
1.6.1 发酵液中菌群DNA 的提取 发酵液菌群总DNA 按照Ezup 柱式细菌基因组DNA 抽提试剂盒说明书进行。
1.6.2 发酵液菌群结构的检测 将1.3.1 节中提取到的DNA 在干冰条件下送往华大基因 (武汉)进行PCR 扩增及16S rRNA 测序。
1.6.3 发酵液中短链脂肪酸的测定 将于-20 ℃保存的各时间点的发酵液室温解冻后,10 000×g室温离心5 min,去除沉淀,取1 mL 上清液,加入25 μL 0.5 mol/L 的硫酸,振动混匀后,用1 mL 乙酸乙酯萃取,用0.45 nm 有机滤膜过滤,采用安捷伦液气色谱系统,进样分析,测定发酵液样品中乙酸、丙酸、丁酸和戊酸的含量。
2 结果与分析
2.1 发酵液中总短链脂肪酸含量的变化
图2为聚葡萄糖(PDX)、聚半乳糖(PGal)和聚甘露糖(PMan)发酵24 h 总短链脂肪酸含量(乙酸、丙酸、丁酸和戊酸之和)变化图。聚葡萄糖、聚半乳糖和聚甘露糖均能被肠道微生物利用,代谢产生短链脂肪酸;发酵至12 h 时,聚葡萄糖、聚半乳糖和聚甘露糖总短链脂肪酸含量比发酵0 h 时升高;其中聚半乳糖积累的总短链脂肪酸含量最高,达到18.7 mmol/L;其次是聚葡萄糖,浓度为13.11 mmol/L;聚甘露糖积累的总短链脂肪酸含量最低,浓度为9.27 mmol/L,约为聚半乳糖总短链脂肪酸含量的49.6%。发酵24 h 时,聚葡萄糖、聚半乳糖和聚甘露糖的总短链脂肪酸含量比发酵12 h 时增加,而与发酵前12 h 相比,增速降低;聚半乳糖积累的总短链脂肪酸含量最高,浓度为20.46 mmol/L,其次是聚葡萄糖,浓度为17.72 mmol/L,聚甘露糖积累的总短链脂肪酸含量最低,浓度为13.23 mmol/L。结果表明:聚葡萄糖、聚半乳糖和聚甘露糖具有良好的发酵利用代谢产生短链脂肪酸的能力,其中聚半乳糖代谢产总短链脂肪酸的含量最高。
2.2 发酵液中乙酸含量的变化
图3为聚葡萄糖(PDX)、聚半乳糖(PGal)、聚甘露糖 (PMan)24 h 乙酸含量的变化。发酵12 h时,聚葡萄糖、聚半乳糖和聚甘露糖乙酸含量比发酵0 h 时增加,其中聚半乳糖积累的乙酸含量最高,达到4.8 mmol/L;其次是聚葡萄糖,乙酸含量为4.22 mmol/L;乙酸含量最低的是聚甘露糖,为1.85 mmol/L;发酵24 h 时,聚葡萄糖、聚半乳糖和聚甘露糖的乙酸含量比发酵12 h 时增加;聚半乳糖积累的乙酸含量最高,达到7.02 mmol/L;其次为聚葡萄糖,乙酸含量为4.82 mmol/L;聚甘露糖积累的乙酸含量最低,浓度为2.71 mmol/L。在发酵过程中,聚半乳糖代谢产生的乙酸含量最高,表明聚半乳糖更有利于乙酸的产生。

图2 总短链脂肪酸在24 h 体外发酵期间的变化Fig.2 Variation of the total short chain fatty acids concentration during 24 hours in vitro fermentation
2.3 发酵液中丙酸含量的变化
图4显示聚葡萄糖(PDX)、聚半乳糖(PGal)、聚甘露糖(PMan)发酵24 h 丙酸含量的变化。发酵12 h 时,聚半乳糖积累的丙酸含量达到整个发酵过程的最高值,为12.41 mmol/L;聚甘露糖的丙酸浓度为5.47 mmol/L,聚葡萄糖的浓度为6.35 mmol/L;发酵24 h 时,聚半乳糖中积累的丙酸和发酵12 h 相比含量降低,浓度为9.95 mmol/L;聚甘露糖和聚葡萄糖的丙酸含量比发酵12 h 时增加,发酵24 h 时含量相同,浓度均为7.5 mmol/L,然而仍低于聚半乳糖发酵24 h 时的丙酸浓度。在发酵过程中,聚半乳糖代谢产生的丙酸含量最高,表明聚半乳糖更有利于丙酸的代谢产生。

图3 乙酸在24 h 体外发酵期间的变化Fig.3 Variation of the acetic acid concentration during 24 hours in vitro fermentation
2.4 发酵液中丁酸含量的变化
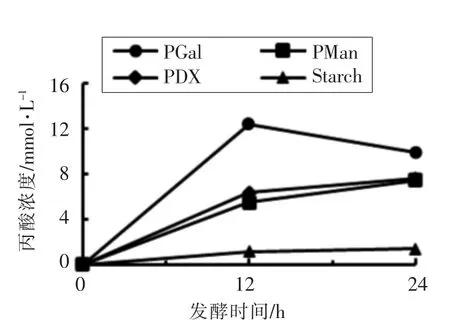
图4 丙酸在24 h 体外发酵期间的变化Fig.4 Variation of the propionic acid concentration during 24 hours in vitro fermentation

图5 丁酸在24 h 体外发酵期间的变化Fig.5 Variation of butyric acid concentration during 24 hours in vitro fermentation
丁酸在人体肠道中具有促进肠道上皮细胞分化,增强肠道屏障的作用[20]。由图5可知,发酵12 h 时,聚葡萄糖(PDX)、聚半乳糖(PGal)和聚甘露糖(PMan)中的丁酸含量比发酵0 h 时增加;丁酸含量最高的是聚葡萄糖,浓度达到2.35 mmol/L;其次是聚甘露糖,浓度为1.76 mmol/L;积累含量最低的是聚半乳糖,浓度为1.39 mmol/L。发酵24 h 时,聚半乳糖和聚葡萄糖中的丁酸含量比发酵12 h 时增加,聚甘露糖的丁酸浓度维持不变趋势;聚葡萄糖的丁酸浓度为3.07 mmol/L,聚半乳糖的丁酸浓度为2.55 mmol/L,聚甘露糖的丁酸浓度为1.85 mmol/L。发酵中,聚葡萄糖代谢产生的丁酸含量最高,表明聚葡萄糖更有利于丁酸的产生。
2.5 发酵液中戊酸含量的变化
由图6可知,聚葡萄糖 (PDX)、聚半乳糖(PGal)和聚甘露糖(PMan)发酵前12 h 时,积累的含量较低;从发酵12 h 开始,聚葡萄糖、聚半乳糖和聚甘露糖中的正戊酸含量开始快速增加;发酵24 h 时,聚葡萄糖积累的正戊酸含量最高,浓度为2.24 mmol/L;其次是聚甘露糖,浓度为1.21 mmol/L;正戊酸积累含量最低的是聚半乳糖,浓度为0.94 mmol/L;表明戊酸的产生主要集中在发酵12 h 后,且随着发酵时间延长开始积累,聚葡萄糖、聚半乳糖和聚甘露糖均能够代谢产生戊酸,其中聚葡萄糖代谢产戊酸的含量最高,说明聚葡萄糖可能更有利于戊酸的产生。
2.6 发酵液中菌群构成分析
图7为聚葡萄糖(PDX)、聚半乳糖(PGal)、聚甘露糖(PMan)、对照组(Starch)在发酵12 h 和24 h 以及空白组(NF)在门水平上的各物种相对丰度图。由图7可知,发酵液中菌群在门水平上,以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)4 个菌门为主,所占比例为98%以上。这与人体肠道中菌群组成结构一致,表明采用粪菌体外发酵试验能很好地模拟人体肠道菌群。发酵12 h时,聚葡萄糖、聚半乳糖、聚甘露糖和对照组在门水平上各物种相对丰度和空白组相比明显发生了变化,厚壁菌门相对丰度降低,拟杆菌门相对丰度增加,变形菌门相对丰度降低,放线菌门相对丰度增加;厚壁菌门在所有的样品中的相对丰度均最高,在聚葡萄糖、聚半乳糖、聚甘露糖、对照组、空白组的相对丰度分别为53.16%,66.67%,59.36%,73.63%,79.20%;与对照组相比,聚葡萄糖、聚半乳糖和聚甘露糖均降低了发酵液菌群中厚壁菌门的相对丰度,增加了发酵液菌群中拟杆菌门的相对丰度,聚半乳糖和聚甘露糖降低了放线菌门的相对丰度,聚葡萄糖增加了变形菌门的相对丰度。
发酵24 h 时,与对照组相比,聚葡萄糖、聚半乳糖和聚甘露糖中厚壁菌门相对丰度增加,拟杆菌门相对丰度降低,放线菌门相对丰度降低;聚葡萄糖组和聚半乳糖组中变形菌门的相对丰度增加,聚甘露糖组中变形菌门的相对丰度减少;这可能与底物被消耗完有关。
图8为聚葡萄糖(PDX)、聚半乳糖(PGal)、聚甘露糖(PMan)、对照组(Starch)在发酵12 h 和24 h 以及空白组(NF) 在属水平上的各物种相对丰度。空白组中主要的属有:布劳特氏菌属、柯林斯菌属、瘤胃球菌属、优杆菌属、梭菌属、多雷亚菌属等;其余各组中的主要属种有:链球菌属、林斯菌属、双歧杆菌属、优杆菌属、粪杆菌属等。发酵12 h 时,与空白组相比,聚葡萄糖、聚半乳糖、聚甘露糖和对照组中的布劳特氏菌属、优杆菌属、柯林斯菌属、粪球菌属、罗氏菌属和瘤胃球菌属相对丰度下降,双歧杆菌属、链球菌属和副拟杆菌属的相对丰度升高。与对照组相比,聚葡萄糖降低了布劳特氏菌属、罗氏菌属、瘤胃球菌属、优杆菌属和柯林斯菌属的相对丰度,增加了双歧杆菌属、副拟杆菌属的相对丰度;聚甘露糖降低了粪球菌属、氏菌属、瘤胃球菌属、优杆菌属和柯林斯菌属的相对丰度,增加了副拟杆菌属的相对丰度;聚半乳糖降低了罗氏菌属、瘤胃球菌属、优杆菌属和柯林斯菌属的相对丰度,增加了副拟杆菌属的相对丰度;其中瘤胃球菌属在聚甘露糖中的相对丰度最低,罗氏菌属在聚半乳糖中的相对丰度最低,优杆菌属和柯林斯菌属在聚葡萄糖中的相对丰度最低,双歧杆菌属、副拟杆菌属在聚葡萄糖中的相对丰度最高。
发酵24 h 时,与对照组相比,聚葡萄糖降低了瘤胃球菌属、布劳特氏菌属、粪球菌属、优杆菌属、柯林斯菌属、副拟杆菌属的相对丰度,增加了链球菌属的相对丰度;聚半乳糖降低了氏菌属、多雷亚菌属、布劳特氏菌属、粪球菌属、优杆菌属、柯林斯菌属、副拟杆菌属的相对丰度;聚甘露糖降低了瘤胃球菌属、氏菌属、优杆菌属、柯林斯菌属、副拟杆菌属的相对丰度;其中瘤胃球菌属在聚甘露糖中的相对丰度最低,多雷亚菌属、罗氏菌属、布劳特氏菌属在聚半乳糖中的相对丰度最低;粪球菌属、柯林斯菌属在聚葡萄糖中的相对丰度最低。

图7 发酵液中菌群在门水平上的相对丰度Fig.7 Relative abundance of microbiota at phylum level

图8 发酵液中菌群在属水平上的相对丰度Fig.8 Relative abundance of microbiota at genus level
3 讨论
本研究旨在探讨聚半乳糖、聚甘露糖和聚葡萄糖的益生能力,结果表明聚半乳糖、聚甘露糖和聚葡萄糖均具有良好的被肠道菌群代谢产生短链脂肪酸的能力,能够起到调节肠道菌群的作用。在本研究中,采用胃肠道模生系统,实时控制pH 值,保持试验温度恒定,按照2%的添加量,对聚半乳糖、聚甘露糖和聚葡萄糖进行严格体外厌氧发酵试验,通过检测发酵液中短链脂肪酸含量变化,结合16S rRNA 测序,分析聚半乳糖、聚甘露糖和聚葡萄糖这类聚糖的代谢产短链脂肪酸能力,以及调节人肠道菌群的作用,综合评价不同单糖组成的聚糖间的益生能力。
人体肠道菌群在门水平上主要是由厚壁菌门、拟杆菌门、变形菌门和放线菌门4 个门组成[21]。其中厚壁菌门和拟杆菌门是优势菌门[22]。肠道菌群利用人体未完全消化的食物成分、部分代谢产物以及肠道黏液等进行新陈代谢活动,并维持自身的数量平衡,通过自身的各项生理活动在多个方面影响宿主健康[23-24]。肠道菌群的动态平衡至关重要。肠道菌群具有生物钟节律和自我调节功能,维持着肠道菌群的动态平衡[25]。Desai 等[26]在间歇性给予人粪菌移植小鼠的膳食纤维时发现,膳食纤维补充期间增殖起来的有益菌在膳食纤维缺乏期迅速减少至原水平。在本研究中,同样发现,在发酵24 h 时,发酵液中菌群组成的变化趋势说明肠道菌群可自我调节自身动态平衡。
短链脂肪酸是肠道微生物利用非消化性碳水化合物发酵产生的代谢产物,为机体提供约10%的能量[27]。在机体内,乙酸可以由大多数细菌代谢产生,如拟杆菌属、双歧杆菌属、消化链球菌属等,能够进入血液循环,在肝脏中代谢,为周边组织提供能源;丙酸主要由拟杆菌门发酵产生,在结肠吸收后主要由肝脏代谢用作能源,抑制胆固醇的合成[28];丁酸主要由厚壁菌门代谢产生,可以促进肠道上皮细胞的分化,是结肠、盲肠能量的首选来源,对肠道的屏障功能至关重要[27]。在本研究中,聚半乳糖、聚甘露糖和聚葡萄糖都展现出良好的产短链脂肪酸的能力,其中聚半乳糖代谢产生的乙酸和丙酸的含量最多,聚葡萄糖代谢产丁酸和戊酸的含量最多。
近年来,大量研究发现,喂饲高脂日粮的小鼠和正常日粮的小鼠相比,拥有更高丰度的厚壁菌门和更低丰度的拟杆菌门[29];这一现象在人体中也逐渐被发现,肥胖人群中的厚壁菌门丰度增加,拟杆菌门丰度降低[30]。试验中,聚半乳糖、聚甘露糖和聚葡萄糖均能够降低发酵液中厚壁菌门的相对丰度,增加拟杆菌门的相对丰度;其中聚葡萄糖组的厚壁菌门相对丰度下降最多,聚甘露糖的拟杆菌门相对丰度增加最多。在属水平上,聚半乳糖、聚甘露糖和聚葡萄糖均能降低粪球菌属、罗氏菌属、瘤胃球菌属、优杆菌属和柯林斯菌属的相对丰度,聚半乳糖和聚葡萄糖能够降低布劳特氏菌属的相对丰度,聚半乳糖和聚甘露糖能够降低多雷亚菌属的相对丰度;聚半乳糖组中的布劳特氏菌属和多雷亚菌属相对丰度降低最多,布劳特氏菌属被认为是脂代谢异常的标志菌[31],在肠易激综合征(IBS)病人体内布劳特氏菌属的丰度要比健康人群显著增高[32];多雷亚菌属的相对丰度和日常摄入菊粉的量呈负相关,在前驱糖尿病人中丰度增加[33-34];聚葡萄糖组中的粪球菌属和柯林斯菌属的相对丰度降低最多。张和平团队发现,柯林斯菌属作为动脉粥样硬化患者的生物标记物[35],与成年蒙古族人心脑血管疾病的高死亡率相关[36]。Wang[37]给与便秘小鼠低聚糖治疗后,粪球菌属的丰度降低;聚甘露糖组中瘤胃球菌属的相对丰度降低最多,瘤胃球菌属能够降解肠道中的黏液蛋白,在缺乏膳食纤维的小鼠体内丰度增加[37]。聚半乳糖、聚甘露糖和聚葡萄糖增加了副拟杆菌属的相对丰度,其中副拟杆菌属在聚葡萄糖组中丰度最高,聚葡萄糖增加了链球菌属和双歧杆菌属的相对丰度;双歧杆菌属是肠道中常见的益生菌,可以介导菌体与宿主表面的粘附,调控宿主免疫功能[38],其含有大量与碳水化合物代谢相关的基因,能将复杂的多糖水解后被其它菌种利用[39];副拟杆菌属可产生大量乙酸及丙酸[40],60-80 岁的健康老年人在鼠李糖乳杆菌(GG 或GG-PB12)联合可溶性玉米纤维干预下,副拟杆菌属的丰度显著增加[41];链球菌属可以代谢产生叶酸,非酒精性脂肪肝患者在短期低碳水化合物饮食干预后链球菌属丰度迅速增加[42]。
总之,在体外发酵试验中,聚半乳糖、聚甘露糖和聚葡萄糖能通过代谢产生短链脂肪酸,调节人肠道菌群结构,促进有益菌的增殖,抑制有害菌的生长。聚半乳糖、聚甘露糖和聚葡萄糖均具有良好的益生能力。
4 结论
本试验利用胃肠道模拟仿生系统,体外模拟在人体肠道pH、温度、营养环境以及正常肠道蠕动情况,研究不同单糖构成的低聚糖对人肠道菌群的调节。结果表明,分别由葡萄糖、半乳糖和甘露糖构成的聚葡萄糖、聚半乳糖和聚甘露糖能够被肠道微生物利用发酵,代谢产生短链脂肪酸;均能调节肠道微生物,刺激有益菌的增殖,抑制有害菌生长。
