北京地区腹泻犬、健康犬粪便粪肠球菌耐药性、毒力基因及多位点序列分型研究
2020-10-21李金鑫高一丁娄银莹黄克斌张颖欣于咏兰
李金鑫,高一丁,娄银莹,黄克斌,于 飞,张颖欣,于咏兰
(中国农业大学动物医学院,北京 海淀 100193)
粪肠球菌(Enterococcusfaecalis,E.faecalis)是包括犬在内的多种哺乳动物肠道共生菌,也是重要的院内感染病原。在人医临床,粪肠球菌引起感染占肠球菌性感染的60%~75%[1],常见感染类型包括心内膜炎、口腔感染、创口感染、血液循环系统、泌尿系统的感染[2],近年来国内已有动物由粪肠球菌引起感染的病例出现[3-4]。肠球菌基因重组的方式较多,包括突变积累、插入序列、转座子诱导和信息素质粒介导重组等[5],大量耐药基因和毒力基因在种群内得以广泛水平传播[6]。犬出现腹泻症状时,多数临床兽医师会首选广谱抗生素进行治疗,在英国兽医临床被首先给予抗生素治疗的腹泻犬比例达71%[7],而抗生素对肠道菌群施加的选择压力会提高具有耐药特性的肠球菌成为肠道优势菌种的可能,且肠球菌对宿主体外高渗透压、高温环境以及部分医用酒精消毒剂具有较强的耐受性[2],因而随粪便排出的此类肠球菌可能引起动物机体其他部位感染,或向包括人在内的其他动物水平传播,具有公共卫生安全隐患。本文通过研究中国农业大学教学动物医院收集的45株腹泻犬粪便源粪肠球菌、32株健康犬粪便源粪肠球菌的耐药性,指导临床用药,同时采用多位点序列分型(Multiloucs sequence typing,MLST)方法对粪肠球菌进行分子分型,分析不同粪便来源优势序列型(Sequence type,ST)粪肠球粪毒力基因携带情况。
1 材料与方法
1.1 对象 本试验用于收集粪肠球菌的犬均来源于从北京各地区至中国农业大学教学动物医院就诊或者接受疫苗免疫的犬只。腹泻犬为有腹泻症状且至少15 d内未使用任何抗生素的犬只;健康犬为进行免疫注射且实验室常规检查结果为正常的犬只。采集腹泻犬、健康犬肛拭子粪便样本,通过分离培养共得到腹泻犬来源粪肠球菌45株,健康犬来源粪肠球菌32株,质控菌株为由实验室保存的ATCC25922和ATCC29213。
1.2 方法
1.2.1 药物敏感性检测 采用琼脂稀释法检测粪肠球菌对抗菌药物的最小抑菌浓度(Minimum inhibitory concentration,MIC),检测的抗生素包括万古霉素、青霉素、氨苄西林、阿莫西林克拉维酸、氯霉素、呋喃妥因、高浓度庆大霉素(500 μg/mL)、红霉素、米诺环素、多西环素、四环素、利福平,药敏结果判读根据美国国立临床标准实验室委员会(Clinical and Laboratory Standards Institute,CLSI)2018年M100手册要求。
1.2.2 DNA提取 将单菌落接种于1.5 mL LB肉汤培养基,37 ℃,2 500 r/min震荡4 h,然后使用商品化的核酸提取试剂盒(Tiangen®DNA Kit)提取DNA。
1.2.3 MLST分子分型 7个管家基因(gdh、gyd、pstS、gki、aroE、xpt、yqil)的引物序列参照粪肠球菌MLST在线数据库(http://efaecalis.mlst.net/misc/info.asp)由美吉生物(北京)公司合成,根据该数据库提供的反应体系、反应条件对管家基因进行PCR扩增,扩增产物交由美吉生物(北京)公司测序。测序结果上传至粪肠球菌MLST在线数据库比对分析,获取每株分离菌7个管家基因等位基因编号,根据等位基因编号得出ST,并使用eBURST软件进行聚类分析。
1.2.4 毒力基因检测 利用PCR检测优势ST粪肠球菌agg、gelE、cylB、esp、efaAfs共5种毒力基因携带情况。以1.2.2中提取的DNA为模板,引物序列见表1[8],PCR反应条件为94 ℃ 2 min;92 ℃ 15 s,55 ℃ 15 s,72 ℃ 15 s,循环30次;72 ℃ 10 min;4 ℃保存。
2 结果
2.1 粪肠球菌耐药性 腹泻犬源和健康犬源粪肠球菌对四环素、多西环素、米诺环素、红霉素、利福平耐药率较高。腹泻犬源分离株对氯霉素、氨苄西林、阿莫西林克拉维酸、呋喃妥因耐药率较低,集中于8.9%~17.8%,对万古霉素耐药率为0;健康犬源分离株对青霉素、呋喃妥因耐药率较低,分别为4.8%和14.3%,对氨苄西林、阿莫西林克拉维酸、万古霉素耐药率为0。所有菌株的具体耐药情况见表2和图1。

表1 毒力基因及其引物Table 1 Virulence genes and primers
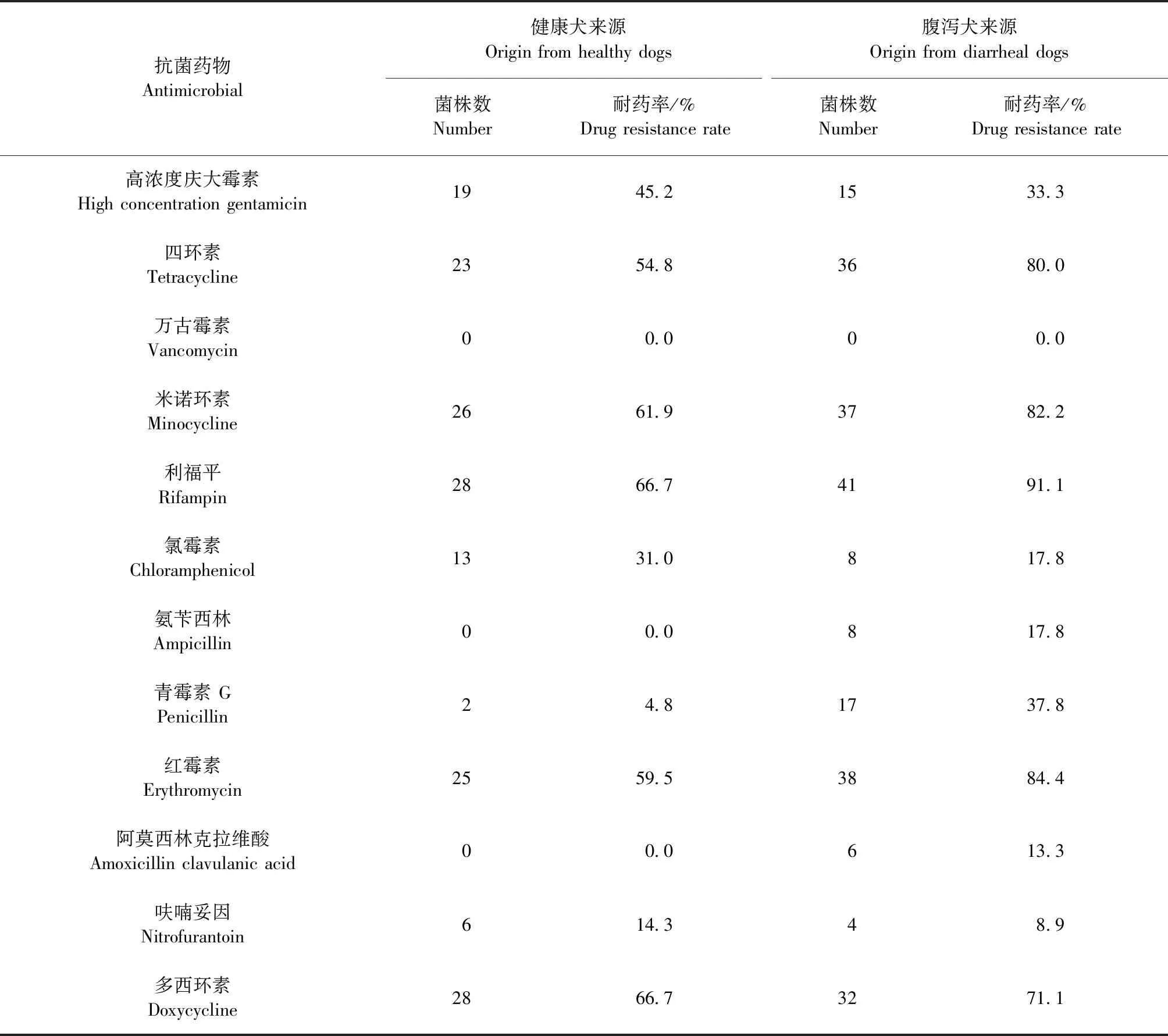
表2 不同来源粪肠球菌的耐药性Table 2 Drug resistance of E.faecalis isolated from different sources
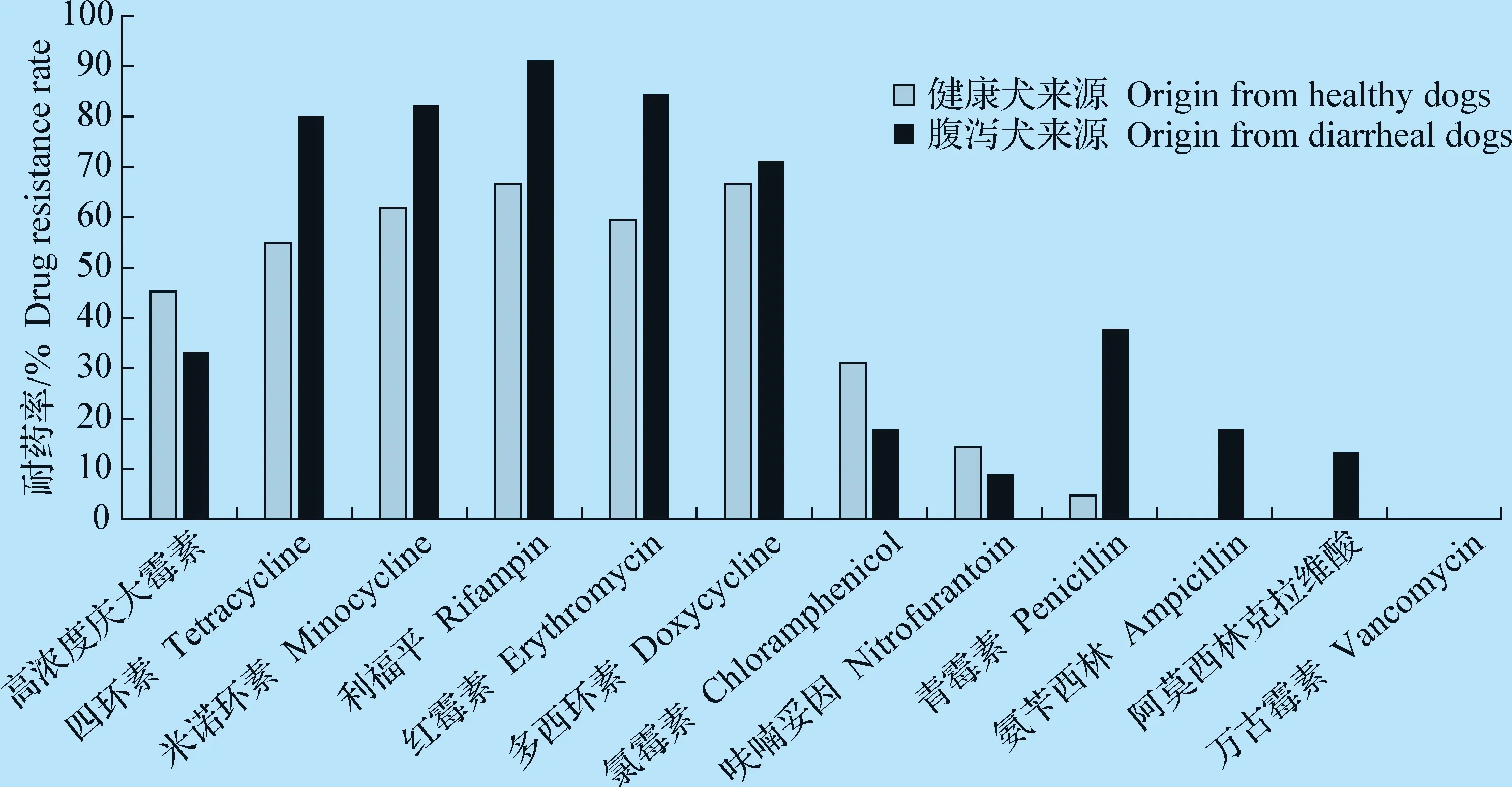
图1 不同来源粪肠球菌的耐药性Fig.1 Drug resistance of E.faecalis isolated from different sources
所有粪肠球菌无万古霉素耐药菌株,45株腹泻犬来源的粪肠球菌中有5株(11.1%)对5类抗菌药物均敏感,其余分离株耐药谱主要集中于3耐和4耐,多重耐药率为91.1%(41/45);32株健康犬来源粪肠球菌有8株(25.0%)对5类抗生素耐药,其余分离株耐药谱集中于2~4耐,多重耐药率为75.1%(24/32)。腹泻犬来源与健康犬来源粪肠球菌对本试验所选12种抗微生物药物耐药率差异不显著(P>0.05)。
2.2 粪肠球菌MLST分型 45株腹泻犬源粪肠球菌共发现15种ST,优势ST为ST116、ST16、ST179,32株健康犬源粪肠球菌发现18种ST,优势ST为ST16和ST27。ST型具体分布见中插彩版图2和图3。
通过查阅以往研究,粪肠球菌克隆复合群(Clone complex,CC)16是重要的人院内感染病原性粪肠球菌复合群[9],eBURST软件分析结果显示,腹泻犬来源优势ST粪肠球菌中ST16、ST179共13株(24.4%,11/45)属于CC16,健康犬来源优势ST粪肠球菌中ST16属于CC16,数量占腹泻犬来源分离株21.9%(7/32)。
2.3 优势ST粪肠球菌毒力基因检测 优势ST粪肠球菌毒力基因检测结果见表3。在2种来源的粪肠球菌中均检测到agg、gelE、cylB、esp、efaAfs共5种毒力基因,16株腹泻犬来源优势ST菌株中有2株不携带全部5种毒力基因,检出率为87.5%(14/16),健康犬来源优势ST粪肠球菌检出率为75%(9/12)。不同来源粪肠球菌5种毒力基因阳性率差异不显著(P>0.05)。
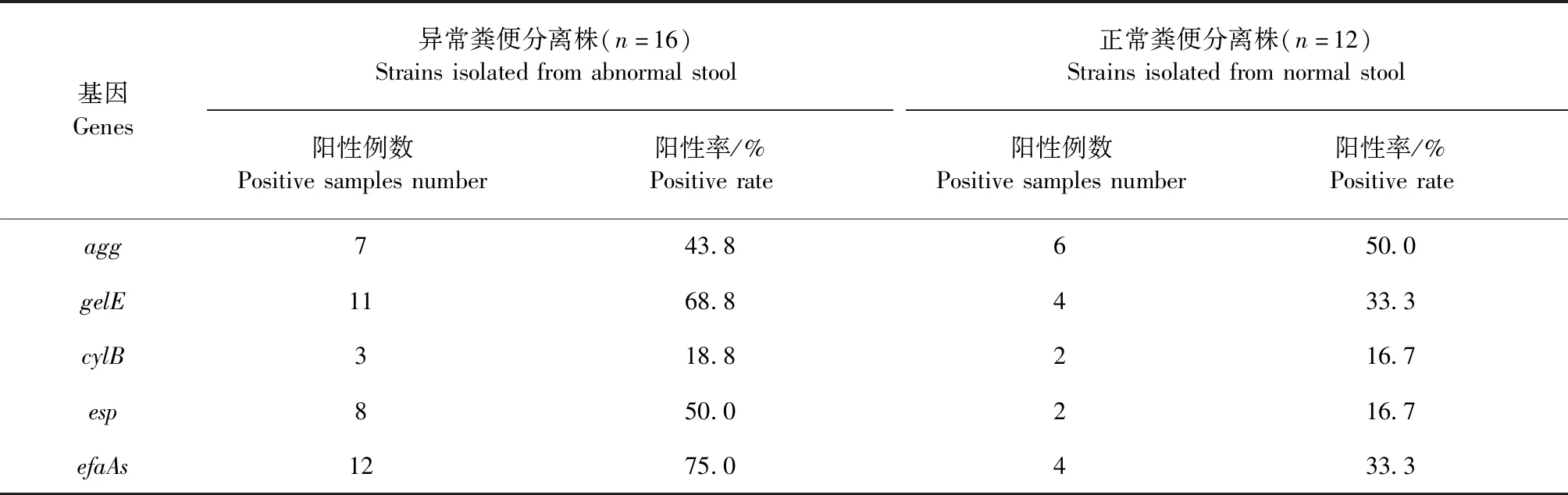
表3 不同来源优势ST型粪肠球菌毒力基因阳性率Table 3 Prevalence of virulence genes among E.faecalis with predominant ST isolated from different sources
3 讨论
目前国内外鲜有关于腹泻犬与健康犬肠球菌耐药情况对比的研究,Kwon K H等[10]在韩国进行的一项关于健康警犬粪便中粪肠球菌的研究显示,分离株对氨苄西林、氯霉素敏感,对红霉素耐药率为10%,对链霉素、奎奴普丁、链霉素耐药率均超过80%,多重耐药率为61.8%,氨苄西林耐药结果和本研究相似。Leener E D等[11]采集犬临床分离粪肠球菌,耐药检测结果显示,分离株对氯霉素、高浓度庆大霉素(500 μg/mL)耐药率分别为85%和79%,对四环素和链霉素耐药率为19%和10%,多重耐药率为34.3%,和本试验耐药率结果存在差异,表明不同地区抗生素的使用和管理策略可能会对粪肠球菌耐药率产生影响。
粪肠球菌克隆复合群(Clonal complex,CC)指由某一祖先ST粪肠球菌进化而来的所有ST粪肠球菌集合群,同一CC内粪肠球菌遗传进化亲缘性相近。粪肠球菌CC16以ST16粪肠球菌为祖先ST菌,是人医临床院内感染病原性粪肠球菌常见CC。Dai D等[12]采集的重症监护病人感染处样本粪肠球菌分离菌株中,CC16粪肠球菌分离率为41.7%,越南一项有关人医临床泌尿道感染病原筛查研究中,CC16粪肠球菌分离率达51.6%[13],丹麦研究人员在患心内膜炎人和猪的血液中均分离到CC16粪肠球菌[14],并通过对人和猪来源CC16粪肠球菌毒力基因和毒力表型的对比发现2种来源分离株在致病力特性上无显著差异,表明存在人医临床常见致病性粪肠球菌在动物与人之间水平传播的可能,本试验中腹泻犬、健康犬来源优势ST粪肠球菌CC16菌株分别占24.4%和21.9%,提示犬粪便中粪肠球菌可能是人粪肠球感染病原。
在2种来源的粪肠球菌中均检测到agg、gelE、cylB、esp、efaAfs共5种毒力基因,5种毒力基因对应的阳性率差异不显著(P>0.05)。朱娜等[15]对湖南患流行性腹泻、健康猪粪便中肠球菌毒力基因检测结果显示,除gelE基因在健康猪源肠球菌阳性率(9.4%)高于患流行性腹泻猪源分离株阳性率(2.6%),其余包括ace、agg、cylA、efaA在内的毒力基因PCR检测阳性率均表现为腹泻猪粪便中分离株更高,且差异显著(P<0.05)。吴敏[16]对人医临床来源和健康人来源粪肠球菌毒力基因PCR检测结果显示,efaAfs、cylA、esp、agg、ace、gelE共6种基因在临床源分离株中检测阳性率高于健康人源分离株,且esp、agg、ace、gelE阳性率在2种来源分离株差异极显著(P=0.00),吴敏的研究中以人临床感染部位分离粪肠球菌与健康人群分离粪肠球菌相对比,本试验中腹泻犬粪便分离粪肠球菌可能并非是引起腹泻的原发病原,这是腹泻犬与健康犬粪源粪肠球菌毒力基因携带情况差异不显著的可能原因。
