免疫亲和柱法测定生湿面制品中T-2毒素含量
2020-03-13杨勤况刚周浓阳文武
杨勤,况刚,周浓,阳文武
1. 重庆三峡医药高等专科学校(重庆 404120);2. 重庆第二师范学院生物与化学工程学院(重庆 400067);3. 重庆三峡学院生物与食品工程学院(重庆 404000);4. 重庆市万州食品药品检验所(重庆 404000)
T-2毒素属于单端孢霉烯族化合物,是镰孢菌属中的三线镰刀菌、拟枝孢镰刀菌和梨孢镰刀菌的代谢产物,主要污染玉米、大麦、大米、小麦等[1]。T-2毒素的毒性大,主要危害消化系统、神经系统和生殖系统,具有致畸性和致癌性[2-3]。T-2毒素经口、皮肤、注射等接触方式可引起造血、淋巴、胃肠组织及皮肤的损害。此外,有些地区的食管癌和大骨节病的高发病率与T-2毒素有关[4]。T-2毒素在室温条件下相当稳定,放置6~7年或加热至100~120 ℃ 1 h毒性不减,但用碱处理后水解成相应的醇,毒性降低[5]。对人体来说,T-2毒素的平均慢性膳食暴露数值最高的人群为学步儿童与婴儿,最大上限值分别为64.8和62.9 ng/(kg·bw·d)[6]。此外,以色列、俄罗斯、挪威等国均规定了谷物等食品中T-2毒素的限量(100 μg/kg),而我国GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》中目前暂无相关要求。鉴于生湿面制品在日常生活中的重要性,对生湿面制品中T-2毒素的含量水平进行监测对确保生湿面制品安全具有十分重要的意义。
目前,T-2毒素的分析检测方法研究主要集中在饲料、谷物、燕麦等[7-10]农产品中的检测。关于生湿面制品中T-2毒素的检测鲜有报道。T-2毒素的主要检测方法有HPLC-FLD法[11-12]、气相色谱(Gas chromatography,GC)法[13]、酶联免疫吸附(Enzyme-Linked Immuno Sorbent Assay,ELISA)法[14]及高效液相色谱-串联质谱(High performance liquid chromatographytandem mass spectrometry,HPLC-MS/MS)法等[15-16]。试验采用操作简便、重现性好的HPLC-FLD法测定生湿面制品中T-2毒素的含量。
1 材料与方法
1.1 材料与试剂
加碱湿面6批次、未加碱湿面6批次、饺子皮5批次、馄饨皮2批次、棒棒面1批次、刀削湿面1批次、手拉湿面1批次,样品购自重庆市东北片区(万州区、梁平区、忠县、开州区、云阳县、奉节县、巫山县、巫溪县、城口县等9个区县)不同摊位,具体见表5。
乙腈、甲醇、甲苯(色谱纯,北京迪马科技有限公司);T-2毒素标准溶液(100 μg/mL,北京曼哈格生物科技有限公司);1-氰酸蒽对照品(北京北纳创联生物技术研究院);T-2毒素免疫层析亲和柱(青岛普瑞邦生物工程有限公司);其它试剂均为分析纯。
1.2 仪器与设备
Agilengt 1260高效液相色谱仪(配备荧光检测器,美国安捷伦科技有限公司);摩尔基因型1850C超纯水机(上海摩勒科学仪器有限公司);IKA MS3涡旋振荡器(德国IKA公司);Waters固相萃取装置(美国Waters公司);Sartorius SQP分析天平(瑞士梅特勒-托利多公司);BiotageTurboVap2氮吹仪(瑞典Biotage公司):XMTD-4000电热恒温水浴锅(北京市永光明医疗仪器有限公司)。
1.3 方法
1.3.1 试剂配制
提取液:甲醇-水(8∶2,V/V)。
4-二甲基氨基吡啶溶液:准确称取12.35 mg 4-二甲基氨基吡啶于容量瓶中,精密加入38 mL甲苯溶解,即得。
1-氰酸蒽溶液:准确称取5.37 mg 1-氰酸蒽于容量瓶中,精密加入17.9 mL甲苯溶解,即得。
1.3.2 标准溶液的配制
T-2毒素标准中间液配制:准确移取0.5 mL T-2毒素标准溶液(质量浓度为100 μg/mL)于50 mL棕色容量瓶中,用乙腈定容,得质量浓度为1 μg/mL的标准中间液,于4 ℃保存,有效期为3个月。
T-2毒素标准工作液配制:分别准确移取0.1,0.2,0.5,1.0和2.0 mL T-2毒素标准中间液于10 mL棕色容量瓶中,用乙腈定容,配制成质量浓度分别为10,20,50,100和200 ng/mL的系列标准工作液。
T-2毒素标准工作液的衍生:取不同浓度的标准工作液各1.0 mL,在50 ℃下用氮气吹干,加入50 μL 4-二甲基氨基吡啶溶液和50 μL 1-氰酸蒽溶液,在涡旋混合器上混匀1 min,于50 ℃反应15 min,在冰水中冷却10 min后取出,在50 ℃下氮气吹干,用1.0 mL流动相溶解,待HPLC-FLD测定。
1.3.3 样品溶液制备
提取:称取10 g(精确到0.001 g)混合均匀的样品于离心管中,加入适量提取液,转移至50 mL容量瓶中,用提取液定容至刻度,混匀,涡旋振荡提取10 min,定量滤纸过滤。移取25.0 mL滤液加入25.0 mL水稀释混匀,经玻璃纤维滤纸过滤至滤液澄清,滤液备用。
净化和洗脱:将免疫亲和柱连接于玻璃注射器下,准确移取10.0 mL提取滤液,注入玻璃注射器中。调节压力使溶液以约1 d/s的流速缓慢通过免疫亲和柱,直至空气进入亲和柱中。用10 mL水淋洗亲和柱,流速为2 d/s,直至空气进入亲和柱中,弃去全部流出液,抽干小柱。准确加入1.0 mL甲醇洗脱,流速约为1 d/s,收集洗脱液。
衍生:洗脱液在50 ℃下用氮气吹干,按标准工作液的衍生步骤进行。
1.3.4 仪器条件
流动相:乙腈-水,对流动性比例进行优化。柱温:35 ℃。流速:1.0 mL/min。进样量:20 μL。检测波长:激发波长381 nm,发射波长470 nm。对色谱柱进行考察。
1.3.5 方法的线性范围、检出限及定量限测定
按照优化的色谱条件,对衍生的标准工作液进行测定,以待测T-2毒素的峰面积(y)为纵坐标,T-2毒素的质量浓度(x)为横坐标,绘制标准曲线。在空白基质中依次加入较低质量浓度的标准溶液,然后进行测定,以3倍信噪比(RS/N=3)和10倍信噪比(RS/N=10)确定方法的检出限和定量限。
1.3.6 方法的精密度
精密吸取20 μL“1.3.2”项下衍生后的标准溶液,注入液相色谱仪,连续进样6次,按照优化的色谱条件进行测定,记录峰面积并计算RSD。
1.3.7 方法的稳定性
精密吸取同一份空白加标供试品溶液(加标量30.0 μg/kg),按照优化的色谱条件,分别于0,2,4,6,8,10和12 h进行测定,记录峰面积并计算RSD。
1.3.8 方法的回收率和重复性
称取10 g(精确到0.001 g)空白试样,分别进行10.0,30.0和100.0 μg/kg 3个加标水平的基质加标回收试验,每个加标水平称取6份样品,按“1.3.3”项下方法制备供试品溶液,并进行HPLC-FLD分析,计算测得总量、平均回收率和相对标准偏差(Relative standard deviation,RSD)。
2 结果与分析
2.1 色谱柱的考察
色谱柱的选择对T-2毒素的分离效果影响很大。考察表1中四种色谱柱对T-2毒素分离效果的影响。结果表明,Agilent ZORBAX SB色谱柱对T-2毒素的分离效果最好(图1D),Diamonsil、Agilent 5 TC和Inertsil ODS-SP3种类型色谱柱没能将T-2毒素分离好(图1A,B和C)。

表1 色谱柱型号
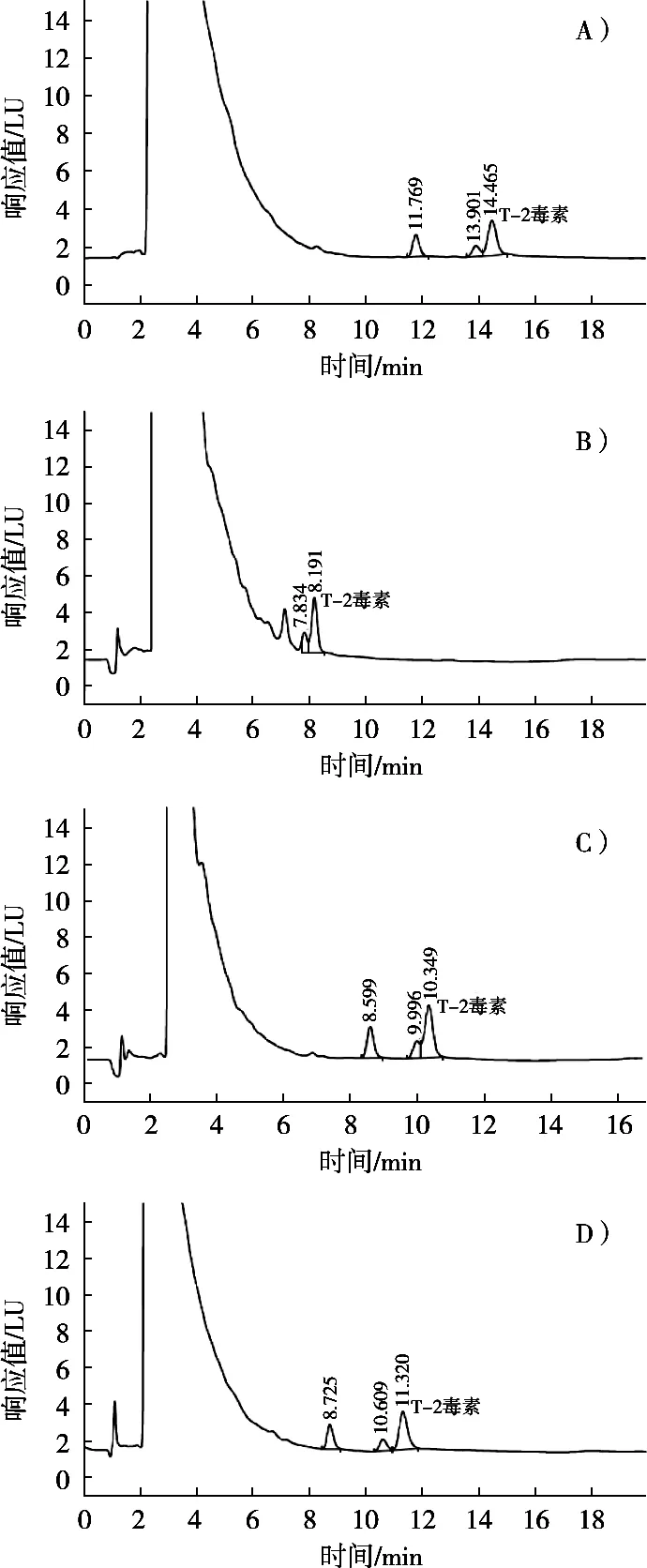
图1 不同色谱柱下标准溶液色谱图
2.2 色谱条件的优化
流动相的不同配比直接影响T-2毒素的出峰时间及分离效果。在选用Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μ m)的色谱柱条件下,考察表2中三组流动相对T-2毒素分离效果的影响。结果表明,在1组色谱条件下,T-2毒素峰分离效果理想,分离度>1.5(图2A),其余两组色谱条件下T-2毒素峰与杂质峰均分离不完全(分离度<1.5),且在1组色谱条件下空白加标样品也可以实现较好的分离(图2B)。

表2 流动相配比及分离效果

图2 不同色谱条件下标准溶液和空白加标样品色谱图
2.3 方法的线性范围、检出限及定量限
用HPLC-FLD法测定时,T-2毒素在10~200 ng/mL质量浓度线性范围内均呈良好的线性关系,r=0.999 9。当生湿面制品的称样量为10 g时,检测限为10 μg/kg,定量限为30 μg/kg。结果见表3。

表3 线性关系及检测限、定量限
2.4 方法的精密度
结果表明,T-2毒素峰面积的RSD为1.3%,说明仪器精密度良好。
2.5 方法的稳定性
结果表明,T-2毒素峰面积的RSD为2.5%,说明该供试品溶液在12 h内稳定性良好。
2.6 方法的回收率和重复性
HPLC-FLD法中,当生湿面制品的称样量为10 g时,T-2毒素在10.0,30.0和100.0 μg/kg 3个加标水平的平均回收率分别为73.4%,83.0%和94.6%,RSD分别为5.6%,4.0%和1.4%,表明该方法准确度和重复性均满足分析要求。结果见表4。

表4 方法回收率和RSD(n=6)
2.7 样品测定
取22批生湿面制品,按“1.3.3”项下方法制备供试品溶液,在优化所得色谱条件下进行测定,外标法定量。结果表明,22份样品中有5批次检出T-2毒素,但均低于检出限。检出T-2毒素的样品中,有4批次是没有加碱的样品,另外一批样品不确定是否加碱。结果见表5。

表5 样品T-2毒素含量测定结果 μ g/kg
3 结论与讨论
GB 5009.118—2016《食品安全国家标准 食品中T-2毒素的测定》中的色谱条件,只规定了色谱柱的长度,没有规定色谱柱的品牌、型号,试验通过不断摸索,最终选取Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm)的色谱柱。在此色谱柱条件下,T-2毒素峰形良好、分离效果好。此外,试验还对T-2毒素色谱峰的出峰时间进行了调整,结果发现,当乙腈-水为78∶22(V/V)时,样品分离效果理想(分离度>1.5),可用于生湿面制品中T-2毒素的检测。当生湿面制品的称样量为10 g时,检测限为10 μg/kg,定量限为30 μg/kg。该方法精密度、重复性良好,且空白加标供试品溶液在12 h内稳定。生湿面制品中的T-2毒素在10.0,30.0和100.0 μg/kg 3个加标水平的平均回收率分别为73.4%,83.0%和94.6%,RSD分别为5.6%,4.0%和1.4%。通过优化样品前处理过程和色谱条件,试验建立了生湿面制品中T-2毒素含量的免疫亲和柱-高效液相色谱荧光法的测定方法,该方法操作步骤简便、快速灵敏、重现性好,适用于大批量生湿面制品中 T-2毒素的快速检测。
T-2毒素性质稳定,不易分解,容易在人体内积蓄,长期食用含有T-2毒素的生湿面制品,很有可能引起身体不适,甚至会有患癌症的风险。生湿面制品是深受广大人民群众喜爱的食品,男女老少皆宜,每年的消耗量巨大,而《国家食品安全监督抽检实施细则 2019年版》中生湿面制品的检验项目未包含T-2毒素,为提高生湿面制品的质量,保证人民饮食安全,应尽快制定相应细则,加强对生湿面制品中T-2毒素的监控。
样品测定中发现:加碱湿面中均未检出T-2毒素,这是否与加碱后T-2毒素在碱性条件下分解有关,需要更进一步的研究。
