经直肠超声、CT及MRI在局部进展期直肠癌新辅助治疗后再分期中的应用价值
2019-03-19陆绍龙叶志华韦传毅唐卫中
凌 通 陆绍龙 叶志华 韦传毅 唐卫中
(广西医科大学附属肿瘤医院1 胃肠外科,2 肝胆外科,南宁市 530021,电子邮箱:249064675@qq.com;3 广西医科大学第一附属医院结直肠肛门外科,南宁市 530021)
直肠癌是常见的消化道恶性肿瘤之一,由于发病隐匿,大多患者就诊时影像学检查提示为局部进展期直肠癌[原发肿瘤侵出肠壁肌层直至周围有名结构(c/pT3~4b)或系膜内及真骨盆范围内出现淋巴结转移(c/pN+)][1],甚至有些肿瘤过大或者侵犯周围其他器官,无法行根治性切除。新辅助治疗不仅可以使直肠肿瘤缩小、肿瘤的局部T分期及N分期降期、减少肿瘤对周边组织器官的侵犯和粘连、增加完全切除率及保肛率[2-3],还可以降低患者术后的局部复发率、提高生存率[4]。研究表明,有15.6%的直肠癌患者接受新辅助治疗后,其术后病理结果提示肿瘤细胞完全消失,达到病理完全缓解(ypT0N0)状态[5]。有学者提出,对于新辅助治疗后完全缓解的患者采用非手术治疗的“等待观察”策略[6],或者对于新辅助治疗后降期明显的患者采用局部切除策略[7]也能达到较好的远期预后效果。直肠癌新辅助治疗后通过影像学检查可以重新评估肿瘤大小、局部分期、与周边组织的关系及是否发生远处转移情况,并可通过多学科讨论制定最佳的个体化治疗方案。但上述治疗决策都依赖于新辅助治疗后准确的分期评估。
临床上对直肠癌分期评估的方法主要有经直肠超声(endorectal ultrasonography,ERUS)、CT和MRI。ERUS对于T1、T2分期评估有较高的价值,而MRI对于T3、T4分期及N分期评估有较高的价值,CT可以评估是否有远处转移。但是放化疗引起的肿瘤坏死可导致肿瘤组织周围出现水肿、炎症反应,上述检查方法是否能鉴别残留的癌组织与替代的纤维瘢痕组织从而准确分期仍有待进一步研究分析。本研究旨在探讨ERUS、CT、MRI在局部进展期直肠癌新辅助治疗后局部再分期中的应用价值。
1 资料与方法
1.1 临床资料 回顾性分析2014年1月至2018年3月在广西医科大学第一附属医院结直肠肛门外科住院治疗的90例局部进展期直肠癌患者的临床资料。纳入标准:(1)病理及影像学检查诊断为局部进展期直肠癌;(2)在我院放疗科行新辅助治疗,包括放疗及口服卡培他滨同步化疗;(3)放化疗结束5~12周后返回结直肠肛门外科行手术治疗;(4)新辅助治疗后返院行手术,术前均行ERUS、CT、MRI 3种检查评估分期,均由两位有独立阅片资格的医师报告审核;(5)以术后病理提供准确结果作为金标准。排除标准:(1)既往有盆腔手术、放疗史者;(2)合并远处转移者。最终纳入48例直肠癌患者,其中男性33例,女性15例,年龄29~74岁,平均年龄54.4岁。
1.2 检查方法
1.2.1 ERUS检查:手术前采用飞利浦HD7直肠超声诊断仪进行扫描,频率7~10 MHz。观察的内容包括:肿瘤距肛缘的距离、肿瘤浸润的深度和宽度、肿瘤的血供、淋巴结的大小以及肿瘤和直肠周边组织的关系。超声的(tumor-node-metastasis,TNM)分期标准:(1)T1期:肿瘤仅局限于黏膜下层以内;T2期:肿瘤已超出黏膜下层达肠壁肌层,但肠壁外层边界完整;T3期:肿瘤突破了肠壁肌层,侵犯肠壁外周脂肪层或达浆膜层;T4期:肿瘤已经穿透浆膜层,侵犯直肠周围的器官;(2)淋巴结直径大于5 mm考虑淋巴结转移,N1期为有1~3枚肠旁脂肪间隙及肠系膜淋巴结转移,N2期为4枚及以上肠旁脂肪间隙及肠系膜淋巴结转移。
1.2.2 CT检查:手术前采用美国64排螺旋CT对病变进行扫描。扫描参数:1.25 mm/1.375/0.8 s,120 kV,240~300 mA。取仰卧位,扫描胸、全腹、盆腔,扫描时静脉注射碘海醇造影剂,注射剂量为100 ml。肠壁厚度超过5 mm者怀疑存在直肠肿瘤。由于对软组织层次区别能力有限,通常CT检查很难将T1和T2期区别开来,故在CT上将两者合并为一期。CT的TNM分期标准:(1)≤T2期:肠壁增厚>5 mm,肿瘤增强期强化的高密度影局限于肠壁,外侧肠壁光整边界清楚,外周脂肪无高密度模糊影;T3期:肿瘤穿透肠壁,与脂肪组织界限不清楚,凸凹不平或呈毛刺状向外周脂肪突出,未穿透浆膜层,与周围器官界限清晰;T4期:肿瘤突破浆膜层,肿瘤增强的高密度影与直肠周围器官的界限不清;(2)以肠旁脂肪间隙内或沿血管分布的孤立结节影或融合的团块影考虑为淋巴结阳性,其中N0期为无可见肿大淋巴结影,N1期为直肠系膜区域有3个或3个以内肿大淋巴结影,N2期为直肠系膜区域4个及以上可视肿大淋巴结影。
1.2.3 MRI检查:新辅助治疗前后均采用西门子3.0T磁共振仪进行扫描。采用快速自旋回波序列-T1加权成像/T2加权成像、快速自旋-T2加权成像序列,层厚6 mm,层距1 mm,薄层动态扫描采用三维快速扰相梯度回波序列,增强扫描时选择钆喷替酸葡甲胺为对比剂,剂量为15 ml。检查前行肠道准备,扫描范围为整个盆腔,上至两侧髂前上棘连线,下至肛门。MRI的TNM分期标准:(1)T1期:肿瘤的高信号未超出黏膜下层;T2期:肿瘤的高信号超出黏膜下层并侵犯肌层,肠壁肌层边缘光滑且与周围脂肪关系清楚;T3期:肿瘤高信号穿透肌层,肠壁边缘不整,呈结节样或毛刺样向外突出,脂肪的界面模糊;T4期:肿瘤的高信号侵及周围脏器,与周围器官间分界不清;(2)N0期:无可见肿大淋巴结影;N1期:直肠系膜区域有3个或3个以内肿大淋巴结影;N2期:直肠系膜区域有4个及以上可视肿大淋巴结影。由于肿瘤和正常肠壁的黏膜下层在MRI的T2加权成像序列上常表现为高信号影,因此不易分辨肿瘤的T1和T2分期,故将T1和T2分期合并为一期。
1.3 新辅助治疗方法 (1)采用常规分割放疗,使用美国瓦立安Clinac iX直线加速器,照射为五野照射,放射总剂量5 000 cGy,照射次数25次,每周放疗5 d,共5周;同时给予卡培他滨片(上海罗氏制药,H20073024)1 650 mg/(m2·d),分早晚两次口服;连续服用14 d后休息7 d为1个周期,共两个周期。
1.4 手术方法 放化疗结束5~12周后返回结直肠肛门外科行直肠癌根治术,其中38例行保留肛门的直肠癌根治术(Dixon术),7例行不保留肛门的经腹会阴联合直肠癌根治术(Miles术),3例行Hartmann手术。
1.5 病理分期 术后标本由经验丰富的病理科医师处理。直肠癌的病理分期参考美国癌症联合委员会制定的第7版癌症原发肿瘤-区域淋巴结-远处转移分期[8]:(1)T0期指无原发肿瘤证据;Tis期指黏膜内癌,侵犯固有层,未穿透黏膜肌层;T1期指肿瘤侵犯黏膜下层;T2期指肿瘤穿透黏膜下层并侵犯肠壁肌层;T3期指肿瘤穿透肠壁肌层达浆膜下层,但未穿透浆膜层或仅侵犯直肠旁脂肪组织,未侵犯直肠周围器官;T4期指肿瘤直接侵犯直肠周围器官。(2)N0期指无区域淋巴结转移;N+指病理提示有淋巴结转移,包括N1和N2期,其中N1期指有1~3枚区域淋巴结转移或浆膜下直肠系膜组织存在任何数量的肿瘤结节,N2期指有4枚及以上区域淋巴结转移。
1.6 错误分期的定义 (1)T分期错误分期:术前影像学T分期和术后病理T分期不一致则为T分期错误分期。(2)N分期错误分期:术前影像学N分期是否阳性与术后病理淋巴结有无转移的结果对比,不一致则为错误分期。
1.7 统计学分析 应用SPSS 22.0软件进行统计学分析。计数资料以例数(率)表示,比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 病理诊断结果 48例患者中,与新辅助治疗前MRI检查比较,术后病理T分期降期共30例,N分期降期共29例。术后病理提示完全缓解(ypT0N0)共4例(8.3%)。T分期:ypT0共6例(12.5%),ypT1~2为15例(31.3%),ypT3为22例(45.8%),ypT4为5例(10.4%)。N分期:淋巴检出数3~31枚,平均12.5枚,有27(56.3%)例淋巴结检出数目小于12枚,其中N0占14例,N+占13例;ypN0为31例(64.6%),ypN+为17例(35.4%)。
2.2 ERUS、CT及MRI对直肠癌病灶T分期的诊断结果比较 3种方法对T分期的诊断总准确率均较低,且差异无统计学意义(P>0.05)。3种方法对T0分期均未能准确诊断。3种方法对T3分期的诊断灵敏度比较,差异有统计学意义(P<0.05),其中MRI、CT对T3分期的诊断灵敏度均高于ERUS(均P<0.05)。见表1~4。
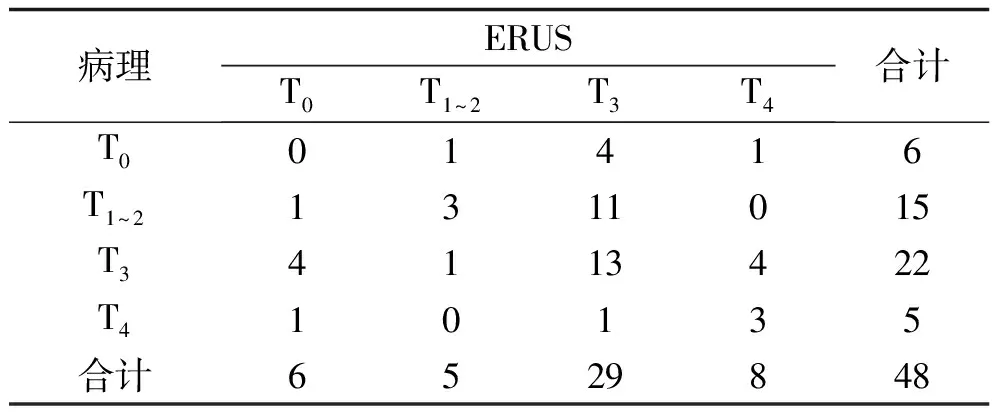
表1 术后病理与术前ERUS对病灶T分期的诊断结果比较(n)
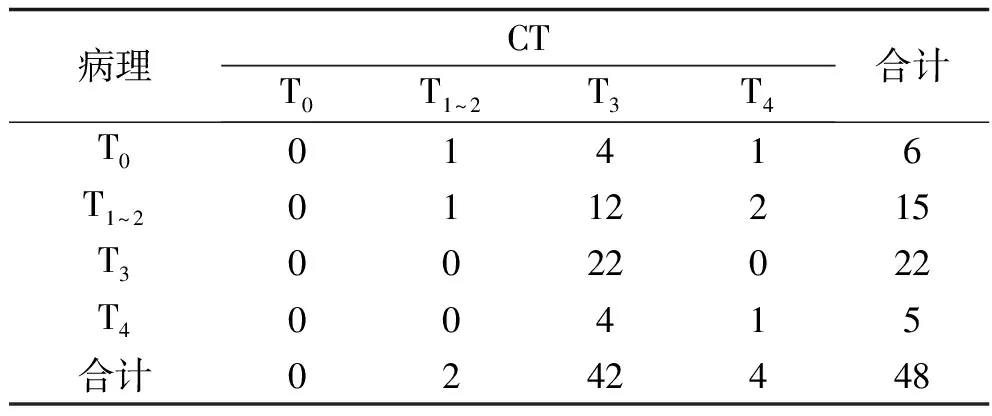
表2 术后病理与术前CT对病灶T分期的诊断结果比较(n)
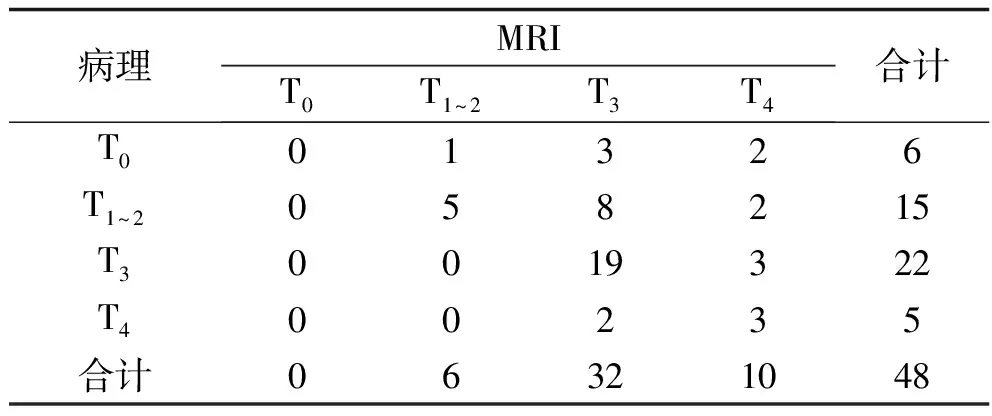
表3 术后病理与术前MRI对病灶T分期的诊断结果比较(n)

表4 ERUS、CT及MRI对直肠癌病灶T分期的诊断结果比较
注:与ERUS比较,*P<0.05。诊断总准确率=分期准确例数/总例数×100%。
2.3 ERUS、CT及MRI对直肠癌病灶N分期的诊断结果比较 3种方法对N分期的诊断特异度及灵敏度比较,差异均有统计学意义(均P<0.05),其中ERUS的特异度均高于CT及MRI,而CT及MRI的灵敏度均高于ERUS(均P<0.05)。3种方法的诊断符合率及阴性预测值比较,差异均无统计学意义(均P>0.05)。见表5~6。
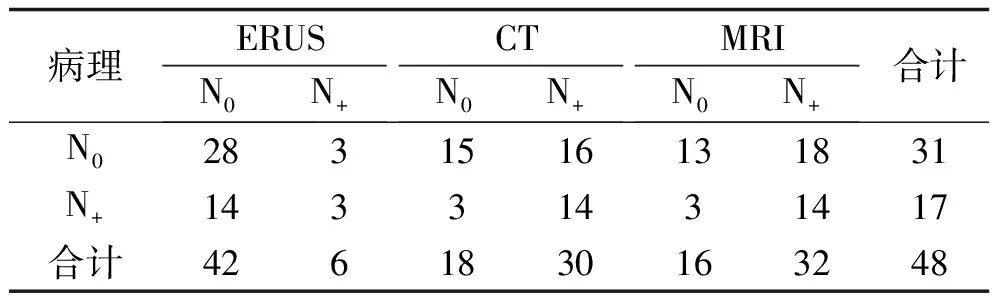
表5 术后病理与ERUS、CT、MRI对病灶N分期的诊断结果比较(n)

表6 ERUS、CT及MRI对直肠癌病灶N分期的诊断结果比较
注:与ERUS比较,*P<0.05。
2.4 错误分期的分析结果 对比术后病理T分期,ERUS、CT和MRI的错误分期均以过高分期为主,见表7;而过高分期中,ERUS、CT、MRI均以对T0~2的过高分期为主,见表8及图1~3。对比术后病理N分期,ERUS的错误分期以过低分期为主,而CT、MRI以过高分期为主,见表7。

表7 ERUS、CT、MRI在T和N分期表现[n(%)]

表8 ERUS、CT、MRI在T分期中过高分期错误类型[n(%)]

图1 ERUS在T0和T2中的过高分期表现注:图A、B的新辅助治疗后病理分期分别为ypT0、ypT2
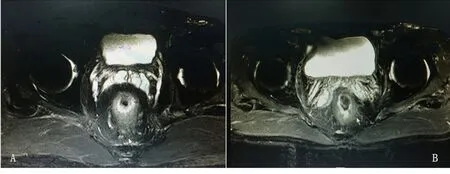
图2 MRI在T0和T2中的过高分期表现注:图A、B的新辅助治疗后病理分期分别为ypT0、ypT2

图3 CT在T0和T2中的过高分期表现注:图A、B的新辅助治疗后病理分期分别为ypT0、ypT2
3 讨 论
直肠癌是消化道常见的恶性肿瘤之一,其治疗的标准方案是以手术为主的综合治疗[9]。实行新辅助治疗可以提高肿瘤R0切除率、保肛率及降低复发率等,目前已成为局部进展期直肠癌术前的标准治疗方案[10]。在临床上MRI对于进展期直肠癌诊断价值较高,是判断是否需要新辅助治疗的标准,因此本研究参考新辅助治疗前MRI结果进行术后病理降期分析,结果显示部分病例的直肠病灶可有不同程度降期,甚至达到病理完全缓解。
有学者提出了新辅助治疗后的策略,即经肛门局部切除和等待观察的治疗策略[11],但这一策略仍具有争议,且需要准确的局部T、N分期作为依据。临床上直肠癌的TNM分期主要是通过影像学检查来判断,常用的检查有ERUS、CT、MRI。相关研究表明,在行新辅助治疗前,对于直肠癌T1~2、T3~4分期,ERUS的诊断准确率分别为73.5%、83.5%,MRI分别为52%、82.7%,CT分别为50%、72%[12]。然而放化疗可导致直肠肿瘤坏死退缩和肿瘤周围结缔组织发生纤维化、坏死等病理反应,使得上述检查难以区别肿瘤组织、纤维瘢痕组织及正常肠壁组织,导致T、N分期的准确率下降。在本研究中,ERUS、CT、MRI判断放化疗后直肠癌T分期的总体准确性均较低,且三者无明显差异,错误分期主要原因是T0~2分期过高分期。其中ERUS对于T分期的总体诊断准确率仅为39.6%,主要表现为T0~2过高分期,这可能是因为新辅助治疗后肿瘤坏死引起的纤维化瘢痕组织在ERUS上显影同样表现为与肿瘤相似的低回声信号影(见图1),导致T0~2期的肿瘤分期过高。MRI对T分期的总体诊断准确率为56.3%,错误分期主要表现为对T0~2的过高分期,这可能是因为对放化疗敏感的肿瘤组织大量坏死时产生的炎症及水肿在MRI影像T2加权成像序列上呈稍高信号影,而肿瘤周围脂肪组织呈轻微高信号的模糊状影(见图2),以上表现均被认为是穿透肌层并浸润到肠壁周围脂肪层的T3期,所以病理判断为T0~2期的肿瘤在MRI大多数被诊断为T3期。CT对于T分期的准确率为50%,错误分期主要表现为对T0~2的过高分期,可能原因是放化疗后的瘢痕组织在CT上显示呈凹凸不平,肠壁外缘不光滑,呈毛刺状(见图3)。目前,对T0分期的准确判断仍是新辅助治疗的一个难题,但在本研究中3种方法对T0分期均未能准确诊断。对于淋巴结分期,3种方法的符合率仅为56.3%~64.6%,其中ERUS的符合率最高,但与MRI和CT差异无统计学意义(P>0.05),且灵敏度仅为17.6%,明显低于MRI和CT(P<0.05);MRI和CT均有较高的阴性预测价值,但3种方法的差异不大,且MRI和CT的特异度低于ERUS。因此,上述3种检查方法均无法有效预测直肠癌病灶的病理完全缓解。
具有争议的新辅助治疗后策略非常依赖准确的局部T、N分期,但目前的影像学检查对于局部分期的准确性均不高,除非有一种新的影像学技术手段能够明显提高放化疗后手术的术前分期准确性,否则仍建议采取根治性切除术的治疗方案。值得注意的是,MRI对于T1~2分期有较高的阳性预测价值,如果将T0~2分期合并为一期,MRI对于T0~2分期的阳性预测价值可达100%(6/6),且其对于淋巴结分期的阴性预测价值为81.3%。因此,在遵循目前治疗规范的前提下,对于无法保肛而保肛意愿又非常强烈不愿行Miles术的患者,或基本情况较差无法耐受根治性手术患者,如MRI提示为T0~2N0分期,经肛门内镜下局部切除也不失为一种选择。
ERUS、CT、MRI对新辅助治疗后的直肠癌T分期准确性均较低,主要是对T0~2过高分期导致总体准确率下降;虽然ERUS对于N分期的诊断符合率相对较高,但是灵敏度极低,而CT和MRI的特异性差。因此,上述检查均无法有效预测新辅助治疗后直肠癌的病理完全缓解。目前,如何准确判断直肠癌新辅助治疗后再分期仍是一大挑战。因此,就目前的影像学技术水平来说,不管新辅助治疗后效果如何,都不应该改变治疗前制定的根治手术方案。
