阿帕替尼治疗小鼠人源化胃癌移植瘤模型的疗效观察及CD31的意义
2018-12-14陈祖华张朦琦李艳艳
陈祖华,张朦琦,高 静,章 程,李艳艳,沈 琳
(北京大学肿瘤医院暨北京市肿瘤防治研究所 消化肿瘤内科 恶性肿瘤发病机制及转化研究教育部重点实验室, 北京 100142)
肿瘤的发生需要新生血管的形成,抗肿瘤血管靶向治疗是肿瘤靶向治疗的重要研究方向[1]。阿帕替尼是中国首个自主研发的血管靶向药物,于2016年被国家食品药品监督管理局(CFDA)正式批准用于进展期胃癌的三线治疗,这也是中国唯一可用于胃癌的血管靶向药物。虽然阿帕替尼(apatinib)是靶向VEGFR2的小分子酪氨酸激酶抑制剂,但阿帕替尼的获益人群目前尚不清楚,且其与化疗联合的协同性也尚不明确。本研究旨在运用可高度还原患者肿瘤特征的人源化胃癌移植瘤(patients-derived xenograft,PDX)模型[2-3],探索阿帕替尼的可能疗效预测标志物及与化疗药物紫杉醇(paclitaxel, PTX)联合的可行性,为后续临床试验提供数据支持。
1 材料与方法
1.1 材料
6例胃癌小鼠PDX模型;甲磺酸阿帕替尼(纯度>99.9%,江苏恒瑞医药股份有限公司);紫杉醇注射液(北京协和药厂);DNA提取试剂盒(Qiagen公司);Trizol(Invitrogen公司);4%甲醛固定液和无水乙醇(国药集团化学试剂有限公司);30% H2O2溶液、羊血清、磷酸盐缓冲液和兔属通用型二抗工作液(北京中杉金桥有限公司);兔抗鼠CD31抗体(Cell Signaling Technology公司); SPF级5~6周龄的雌性非肥胖糖尿病/严重联合免疫缺陷(NOD/SCID)小鼠(北京华阜康生物科技股份有限公司)。
1.2 方法
1.2.1 小鼠胃癌PDX模型的建立与传代:本研究相关动物实验经北京大学肿瘤医院独立伦理委员会批准,并在实验动物管理与使用指南下进行。本实验所有程序均在无特定病原体设施的无菌条件下进行。人源化胃镜活检胃癌PDX模型的建立与传代如前期报道[3]。
1.2.2 实验分组与用药:当肿瘤体积达到100~150 mm3时,小鼠被随机分配至不同组(每组5只小鼠)。1)对照组:0.9%氯化钠溶液,灌胃,每天1次;腹腔注射,每周2次;2)阿帕替尼单药组:阿帕替尼150 mg/kg,灌胃,每天1次;3)紫杉醇单药组:紫杉醇5 mg/kg,腹腔注射,每周2次;4)阿帕替尼联合紫杉醇组:剂量及给药方式同单药。分组当日给药,每次给药前测量小鼠的质量。
1.2.3 肿瘤生长抑制率的计算:小鼠给药过程中,每隔2 d用精密游标卡尺测量小鼠肿瘤的长径(L, length)与宽径(W, width),按公式V(volume)=(W2×L)/2计算肿瘤体积,绘制肿瘤生长曲线。给药结束后,颈椎脱臼处死小鼠,肿瘤生长抑制率(tumor growth inhibition, TGI)= 1-ΔT/ΔC×100%(ΔT=治疗结束时药物治疗组的肿瘤体积变化,ΔC=治疗结束时对照组的肿瘤体积变化)。
1.2.4 靶向捕获测序及转录测序检测PDX肿瘤组织的分子变异及表达情况:用组织DNA提取试剂盒分别提取6例PDX模型肿瘤组织的基因组DNA,Trizol法提取PDX 1对照组和用药组肿瘤组织的总RNA,由北京诺禾致源生物信息科技有限公司进行DNA靶向测序、转录组测序及生物信息学分析。
1.2.5 免疫组织化学检测CD31的表达:用药结束后分离胃癌PDX肿瘤组织,免疫组织化学检测和分析CD31的表达如前期报道所述[4]。CD31的表达由Aperio ImageScope软件v8.2.5分析,定义为受检肿瘤组织内皮细胞中CD31阳性细胞的百分比。
1.3 统计学分析
2 结果
2.1 阿帕替尼单药及联合紫杉醇在晚期胃癌PDX模型中的疗效
与溶剂对照组相比,阿帕替尼单药在6例PDX模型中均显示出不同程度的抑瘤作用,抑瘤效果也优于紫杉醇单药,尤其在PDX 1-3模型中阿帕替尼抗肿瘤作用高于PDX 4~6模型。与阿帕替尼单药组相比,阿帕替尼联合紫杉醇仅在PDX 5模型中具有更显著的抗肿瘤作用(P<0.001)(图1,表1)。
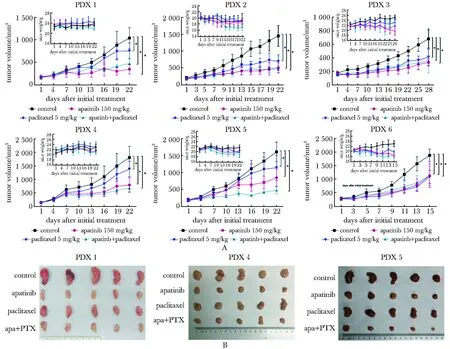
A.efficacy of apatinib, paclitaxel and combination group in six PDX models for gastric cancer, *P<0.05 compared with control group; B.tumor size of PDX models in each group
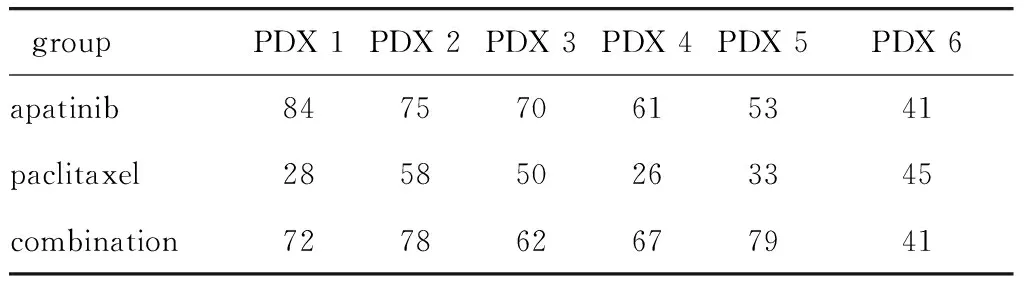
表1 阿帕替尼在6例胃癌PDX中的抑瘤作用
2.2 阿帕替尼处理前后血管生成相关基因的变异及表达情况
血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)以及血小板衍生生长因子(PDGF)及其受体是肿瘤血管生成的3类重要调节因子。在6例分子特征明确的PDX模型中,仅PDX 2模型携带FGFR2 A333V的单核苷酸变异,未检测到VEGF/VEGFR、FGF/FGFR和PDGF/PDGFR等血管生成相关基因的突变或拷贝数变异(图2A)。
阿帕替尼用药组与对照组肿瘤组织的相关系数R2=0.97,表明两组肿瘤组织相关性较高。与对照组肿瘤相比,阿帕替尼用药组检测到包括FGFR1/2在内的1 230个显著下调基因(图2B)。GO(gene ontology)分析显示差异基因主要富集在血管生成(vasculature development)、血液循环(blood circulation)、炎性反应(inflammatory response)和蛋白级联激活(protein activation cascade)等生物过程(图2C)。KEGG(kyoto encyclopedia of genes and genomes)分析显示差异基因显著富集于补体和凝血级联(complement and coagulation cascades)信号通路(图2D)。
2.3 阿帕替尼在胃癌PDX模型中的疗效与CD31的表达相关
与溶剂对照组相比,CD31表达较高的PDX肿瘤组织对阿帕替尼的敏感性高于CD31表达较低的组织,且阿帕替尼对新生血管生成有抑制作用(图3,表2)。这提示CD31的表达(微血管密度)或许是潜在的预测阿帕替尼疗效的标志物之一。
3 讨论
本课题组前期研究发现,阿帕替尼在CD31表达较高的胃癌PDX模型中更为敏感[4]。本研究进一步扩大模型样本,证实阿帕替尼在胃癌PDX模型中通过抑制血管生成发挥其抗肿瘤作用,且药物处理后肿瘤组织中的CD31表达水平明显降低, 这与既往文献报道[5]一致。抗VEGFR2酪氨酸激酶抑制剂处理可导致肿瘤微血管的显著减少,并进一步减少肿瘤组织的血供,从而导致肿瘤细胞的坏死或凋亡[5]。
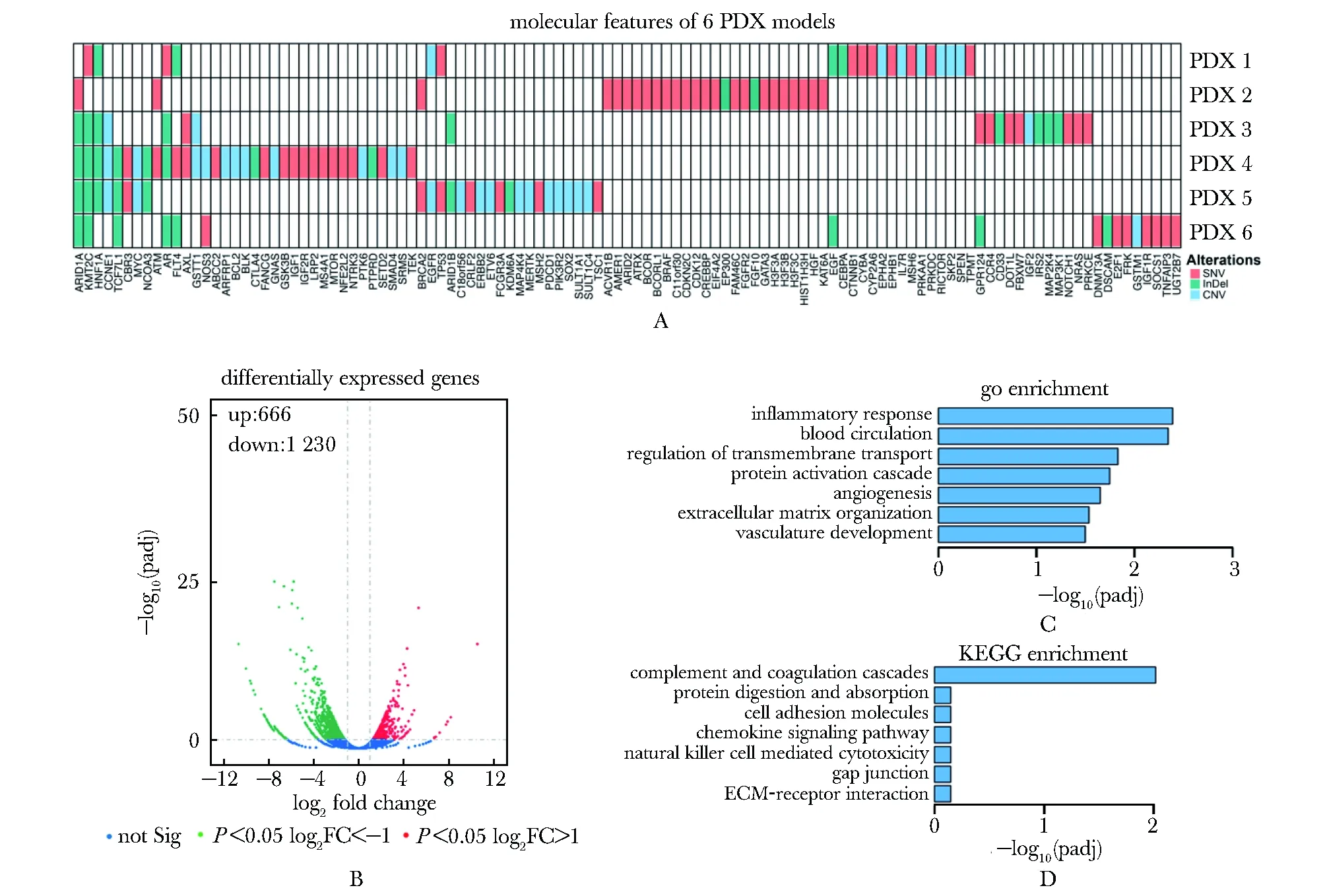
A: SNV.single nucleotide variation, InDel.insertion/deletion, CNV.copy number variation; B: red dots, significantly upregulated genes; green dots, significantly downregulated genes; C:go enrichment of differentially expressed genes; D:KEGG enrichment of differentially expressed genes
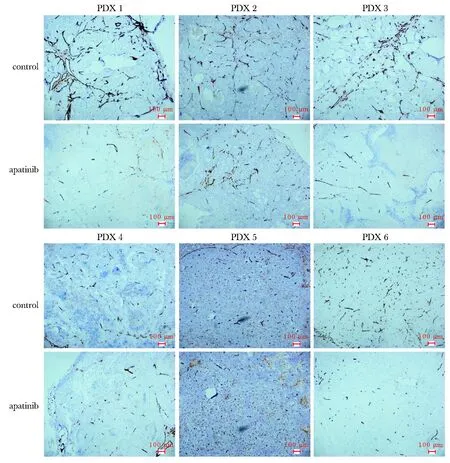
图3 阿帕替尼治疗前后胃癌PDX模型中CD31的表达Fig 3 CD31 expression of PDX models before and after apatinib treatment(×40 magnification; scale bars=100 μm)
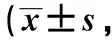
表2 阿帕替尼治疗前后CD31的表达情况Table 2 CD31 expression of six PDX models before and after apatinib treatment %,n=3)
阿帕替尼目前已被CFDA批准用于晚期胃癌三线及三线以上治疗。阿帕替尼跟常规化疗联用效果如何?如何筛选阿帕替尼获益群体?是目前研究的热点。在RAINBOW研究中,雷莫芦单抗联合紫杉醇在晚期胃癌二线治疗中显示出优于雷莫芦单抗单药的抗肿瘤作用[6],有学者提出阿帕替尼联合紫杉醇在临床实践中的可行性[7]。然而在本研究中,阿帕替尼联合紫杉醇在胃癌PDX模型中并无明显协同抗肿瘤作用,临床联合用药的可行性低,该结论尚需进一步验证。
既往报道了多项与抗血管生成治疗相关的疗效标志物[8]。神经纤毛蛋白-2 (neuropilin-2)的mRNA水平与贝伐珠单抗的PFS呈负相关[9],VEGFA的高表达与更长的OS相关,VEGFR2的高表达与更短的PFS相关[10]。然而,上述研究仅在非亚洲地区的患者中发现有统计学意义。近期,一项基于269例接受阿帕替尼治疗的转移性胃癌患者的回顾性队列研究表明,首次接受阿帕替尼治疗期间高血压、蛋白尿或手足综合征的出现是阿帕替尼的可行疗效预测标志物[11]。本研究首次利用前期建立的人源化胃镜活检移植瘤模型,发现阿帕替尼单药在胃癌PDX中的抑瘤作用具有选择性。与CD31低表达的PDX模型相比,CD31表达水平高的PDX模型对阿帕替尼更为敏感,有待后续进一步验证。除此之外,其他可能的疗效预测生物标志物尚需继续探索。
