miR-548p表达上调抑制卵巢癌细胞系SKOV-3的增殖和迁移
2018-12-14古力米热布然江热孜亚库尔班艾力克木阿不都玩克李小文古丽娜库尔班
古力米热·布然江,热孜亚·库尔班,艾力克木·阿不都玩克,李小文,古丽娜·库尔班*
(1.新疆医科大学第三临床医学院(附属肿瘤医院), 新疆 乌鲁木齐 830011; 2.新疆维吾尔自治区人民医院,新疆 乌鲁木齐 830001)
卵巢癌是常见妇科恶性肿瘤之一,其病死率居于妇科恶性肿瘤之首[1]。由于发病早期无显著症状,发现时多数已处于晚期,导致该病具有较高的致死率[2]。由于该肿瘤有较高的早期侵袭及转移能力,即使手术治疗后,患者的预后多不良[3]。因此,研究与卵巢癌进展相关的基因以及相关的机制是目前治疗卵巢癌的热点,同时对患者前期诊断也具有极其重要的意义。
近年来,越来越多的研究表明微小RNA(microRNAs,miRNAs)可通过与靶基因mRNA的非编码区相互结合,通过对靶基因转录后水平的调控实现对靶蛋白的翻译,最终影响肿瘤的发生发展,发挥类似于癌基因或者抑癌基因的功能[4]。miR-548p作为一个新发现的微小RNA,可通过下调乙型肝炎病毒X相关蛋白,进而抑制乙型肝炎病毒X蛋白相关的肝细胞癌的进展,也可抑制肝脏载脂蛋白B的分泌和脂质合成[5]。然而,有关miR-548p在卵巢癌细胞中的作用及机制的研究报道甚少,本文主要研究miR-548p对卵巢癌细胞的增殖和迁移能力的影响,并探讨其可能机制,为卵巢癌的治疗提供新的潜在靶点。
1 材料与方法
1.1 材料
组织样本:收集2016年9月到2017年6月30例新疆医科大学第三临床医学院附属肿瘤医院卵巢癌组织样本,立即加入Trizol试剂(TakaRa公司),并采用组织匀浆机粉碎后保存在-80 ℃,避免RNA的降解。所有患者均知情同意,并且本研究获得医院伦理委员会的批准。
人卵巢癌细胞系SKOV-3、HO-8910、OVCR3、A2780和人卵巢上皮细胞IOSE80(ATCC公司);PrimeScript Reverse Transcriptase、SYBR Green Real time-PCR试剂盒、Trizol(TakaRa公司);Lipofectamine 2000转染试剂盒(Thermo Fisher Scientific公司);RPMI-1640培养基、胎牛血清(FBS)(Gibco公司);Transwell小室(Corning公司);MTT试剂盒(R&D 公司);MMP-2、MMP-9、Bax、Bcl-2、p-p65、GAPDH抗体和兔抗鼠的二抗(CST公司);miR-548p mimics以及control质粒(Sigma-aldrich公司);miR-548引物(TaKaRa公司)。
1.2 方法
1.2.1 细胞培养及细胞转染:将SKOV-3细胞培养在含有10%FBS的RPMI-1640培养基中,37 ℃、5% CO2条件下恒温培养,当细胞汇合达80%~90%时,转染细胞。所有转染实验严格按说明书操作。
1.2.2 实时荧光定量PCR反应(RT-qPCR)检测mRNA:严按说明书进行临床组织样本以及卵巢癌细胞等总RNA的提取后,使用试剂盒进行反转录,并采用试剂盒进行RT-qPCR检测。
1.2.3 Transwell迁移实验:Transwell的上室加入500 μL 8×103个/mL SKOV-3细胞无血清悬液后,放置于含20% FBS培养基的24孔板中,37 ℃、5% CO2培养48 h。取出Transwell小室,棉签轻柔擦拭室内多余的细胞,然后采用100%甲醇固定15 min,PBS冲洗后,采用0.1%结晶紫溶液染色30 min,干燥后,在200倍镜下观察,分别选取上、下、左、右和中5个视野计数,取平均数作为侵袭细胞数。
1.2.4 Western blot检测蛋白:收集提取转染miR-548p mimics以及control质粒24 h后的SKOV-3细胞,用冷的PBS洗涤3遍后,加入蛋白裂解液,冰浴裂解60 min后,14 000×g离心10 min后获取上清并加入5×上样缓冲液,100 ℃煮沸10 min后保存于-20 ℃。采用12%的分离胶,5%的浓缩胶电泳分离20 μg蛋白并转移至PVDF膜,封闭1 h,以1∶1 000浓度的一抗4 ℃孵育过夜,PBST洗涤5次,每次5 min后,加入1∶3 000的二抗室温下孵育2 h,再次PBST洗涤后,进行显影及定影,并拍片。
1.2.5 MTT法检测增殖:用含10% FBS培养液重悬配成单细胞悬液,以每孔4 000个细胞接种到96孔板,体积200 μL,37 ℃、5% CO2条件下培养12、24、48和72 h后,加入MTT溶液(5 g/L)20 μL,继续培养4 h后,弃掉上层培养液,每孔加入150 μL DMSO,振荡10 min后,于490 nm处读数。
1.3 统计学分析
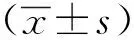
2 结果
2.1 miR-548p在卵巢癌组织及细胞内的表达情况
miR-548p在卵巢癌肿瘤组织的表达量显著低于相邻的非肿瘤组织(P<0.05)(图1A)。miR-548p在卵巢癌细胞中的表达量显著低于正常人卵巢上皮细胞(P<0.05)(图1B),其中以SKOV-3中的表达量最低,因此选取该细胞系进行后续的一系列试验。
2.2 miR-548p抑制卵巢癌细胞的增殖和迁移
miR-548p过表达后显著抑制SKOV-3细胞增殖(图2A,B);在48 h细胞的迁移细胞数量显著减少(P<0.01)(图2C,D)。
2.3 miR-548p对SKOV-3细胞的基质金属蛋白酶以及线粒体凋亡途径蛋白的影响
在SKOV-3细胞中, miR-548p mimics转染后,MMP-2和MMP-9的表达分别被抑制约69.8%和59.1%(图3A,B);Bcl-2的表达被抑制约60.3%,Bax的表达则上调117.8%(图3C,D)。
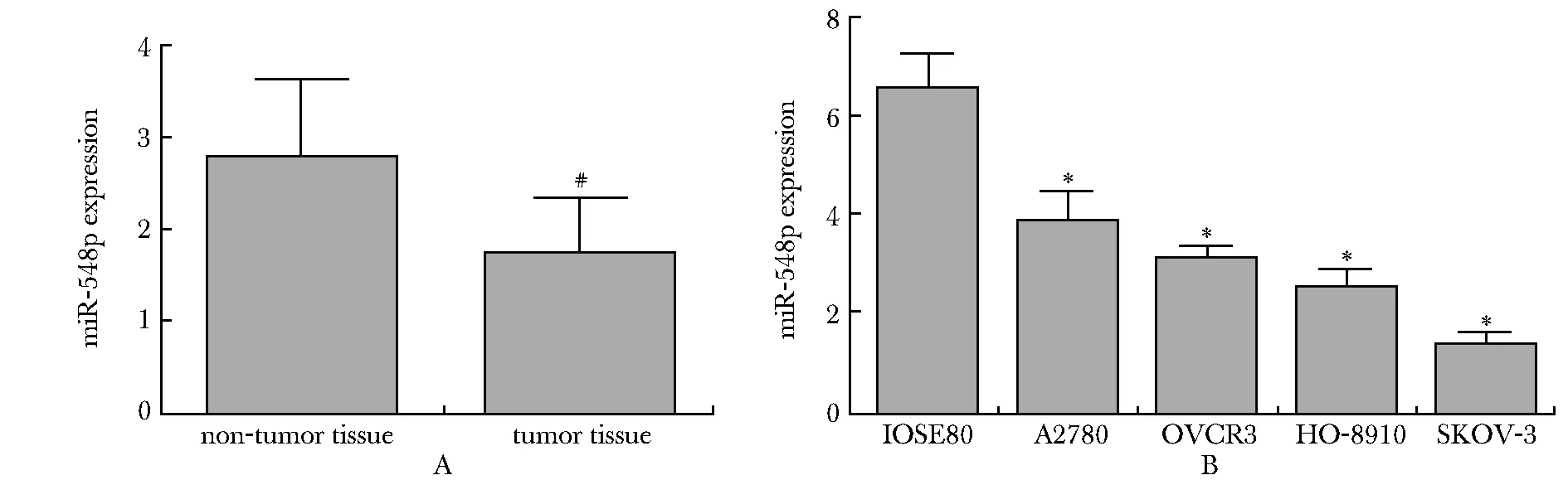
A.expression of miR-548p was detected by RT-qPCR in clinical ovarian cancer tissues and adjacent normal tissues(n=30), #P<0.01 compared with non-tumor tissue group;B.RT-qPCR was used to explore the miR-548p expression in normal ovarian epithelial cells IOSE80, ovarian cancer cell lines A2780, OVCR3, HO-8910 and SKOV-3; *P<0.01 compared with IOSE80
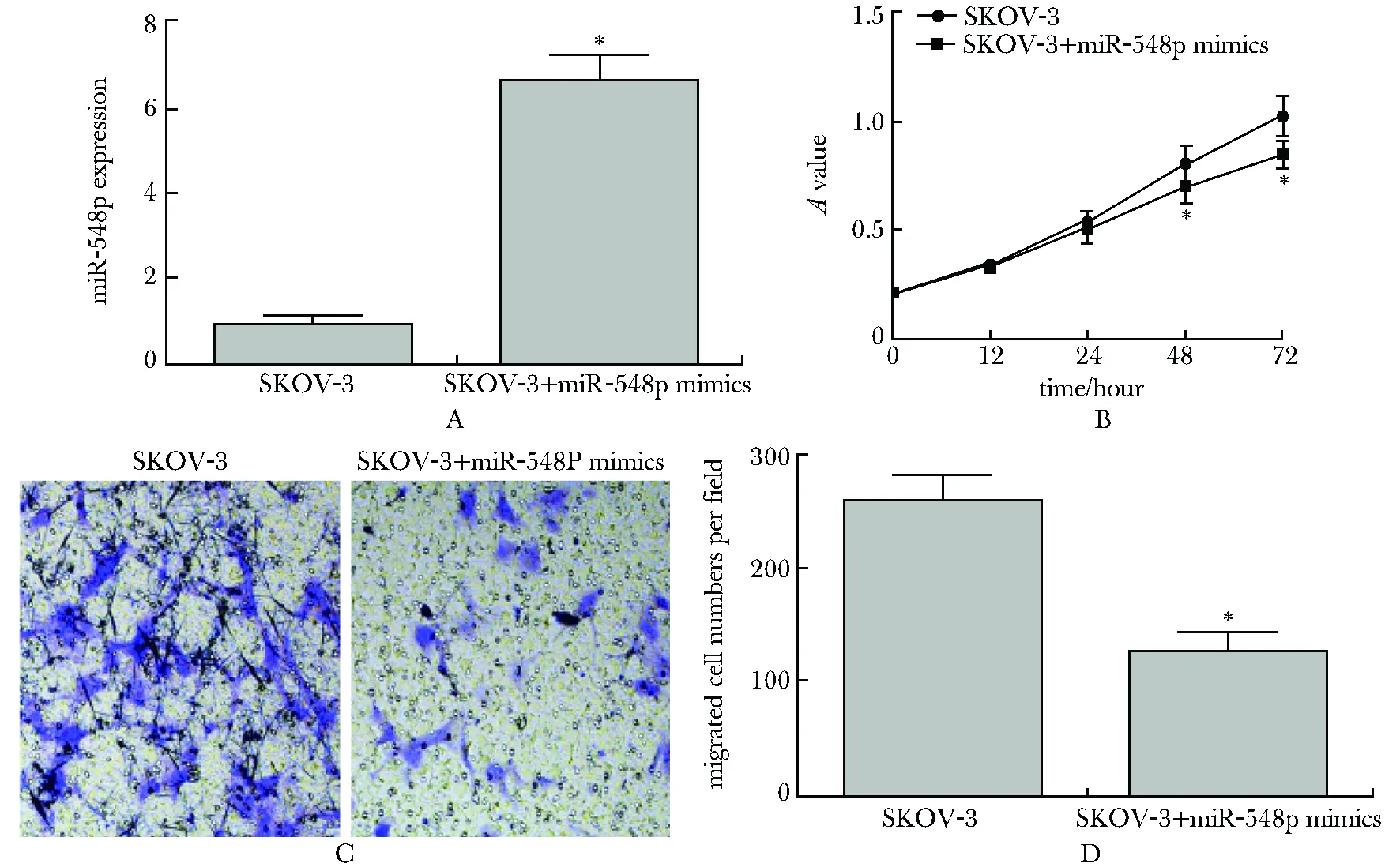
A.RT-qPCR assay was used to detect the expression of miR-548p after transfeected with control or miR-548p mimics for 24 hours; B.effect of miR-548p on SKOV-3 was detected using MTT assay, 1×104 cells were seeded into 96-well plates after transfected with control or miR-548p mimics, OD values were read at 490 nm at 12, 24, 48 and 72 hours respectively; C,D.Transwell assay was used to test the migratory abilities of SKOV3 by miR-548p treatment(×400); *P<0.01 compared with SKOV-3
2.4 miR-548p对NF-κB信号通路的影响
miR-548p过表达后可显著抑制SKOV-3细胞中p65磷酸化水平,减少了约68%(图4)。
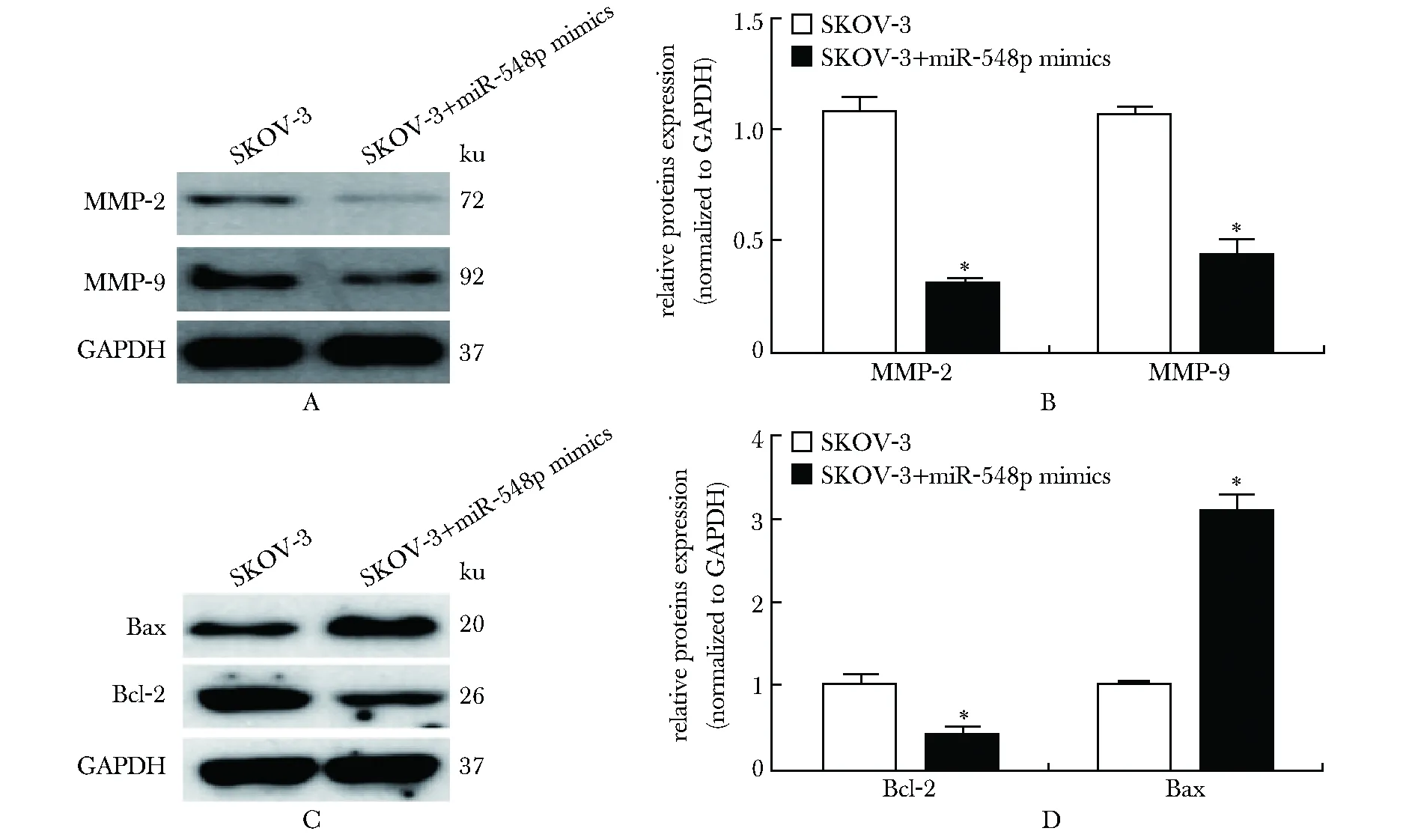
Western blot was used to explore the influence of miR-548p on the expression of MMP-2, MMP-9, Bcl-2 and Bax in SKOV-3 cells after transfected with miR-548p mimics for 24 hours; A,B.detection of MMP-2 and MMP-9 expression; C,D.changes of Bcl-2 and Bax in SKOV-3 cells; *P<0.01 compared with SKOV-3
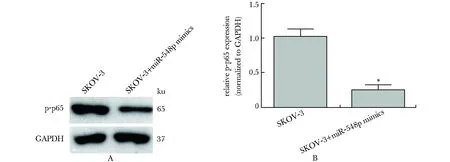
Western blot was used to explore the effect of miR-548p on the phosphorylation of p65 in SKOV-3 cells after transfected with miR-548p mimics for 24 hours; A.detection of p65 phosphorylation; B.relative expression of p65 phosphorylation; *P<0.01 compared with SKOV-3
3 讨论
近年来,尽管卵巢癌的相关临床治疗及技术手段已取得较大的进步和提高,但由于发病早期缺乏有效的诊断方法,病发时多数已有腹腔内大面积扩散,因此需要探寻针对卵巢癌临床治疗的靶点[1-3]。MicroRNAs是近年来发现的一类可通过调控靶基因参与信号通路进而影响肿瘤发生发展的非编码小分子RNA[4]。目前,microRNAs的表达谱已作为某些疾病的诊断,例如:胆汁的microRNA表达谱分析可以鉴别出胆管癌的早期阶段[6];miR-122在胆固醇代谢、肝细胞癌和丙肝病毒感染中起着重要作用[7]。在卵巢癌的诊断中,也发现许多不同的microRNAs具有重要的意义,例如:miR-150可作为晚期卵巢癌的一个预后指标[8]。然而,miR-548p作为最近新发现的微小RNA,其在卵巢癌中的作用目前没有相关报道。在本研究中,发现miR-548p在卵巢癌组织及相关的细胞系中处于低表达状态,这些均说明miR-548p可能参与到卵巢癌的发生发展过程中,有望成为卵巢癌治疗的一个靶点。
卵巢癌的高侵袭和转移性导致其具有较高的致病性及较差的预后。研究表明microRNAs可通过MMP-2和MMP-9调控卵巢癌的侵袭和转移过程,例如miR-340过表达可通过下调MMP-2和MMP-9的表达从而抑制卵巢癌细胞的侵袭和EMT过程[9]。MMP-2和MMP-9属于基质金属蛋白酶,为一类蛋白水解酶,可降解胞外的基质,参与肿瘤的侵袭转移。研究表明MMP-2和MMP-9在卵巢癌中处于高表达,与卵巢癌的侵袭转移以及卵巢癌的发展过程等相关[10]。本研究中,miR-548p过表达后可显著抑制MMP-2和MMP-9的表达,相应地卵巢癌细胞的迁移也被显著抑制,miR-548p可通过抑制MMP-2和MMP-9的表达从而抑制卵巢癌细胞的迁移能力,发挥抑癌基因的作用。
细胞凋亡与肿瘤的发生发展关系一直是近年来关注的热点问题之一,细胞凋亡程序的失控最终导致肿瘤细胞的无限繁殖,Bcl-2家族在该过程中发挥的作用备受关注。Bcl-2和Bax为Bcl-2家族的主要成员之一,可参与线粒体途径的细胞凋亡调控[11]。凋亡相关基因的表达异常通常导致肿瘤过程的进展,主要表现在促凋亡蛋白的表达下调,抗凋亡蛋白的表达上调[12]。本研究同样发现miR-548p过表达后可促进卵巢癌细胞SKOV-3中促凋亡蛋白Bax表达的上调,抑制抗凋亡蛋白Bcl-2,这些表明miR-548p在卵巢癌细胞凋亡中具有重要的作用。
NF-κB是一种重要的核转录因子,该信号通路可参与调控凋亡相关基因、原癌基因以及肿瘤转移相关的基因等,与肿瘤的发生发展以及转移等过程密切相关[13-14]。P65作为NF-κB信号通路一个重要的成员,同样在肿瘤的发生发展过程中发挥重要的作用。研究表明高磷酸化的p65参与了上皮性卵巢癌的淋巴转移过程,并促进卵巢癌细胞的转移[15]。本研究发现miR-548p过表达时可显著抑制p65的磷酸化,该结果表明了miR-548p可能通过抑制NF-κB信号通路,从而下调MMP-2、MMP-9和Bcl-2的表达,上调Bax的表达,最终实现对卵巢癌细胞的增殖和迁移的影响,再一次证明了miR-548p参与卵巢癌的发生发展过程,并发挥抑癌基因的作用。
然而,miR-548p是如何调控NF-κB信号通路,以及是否还有其他的信号通路参与这一过程,将是进一步需要探索的问题。
