利用CRISPR/Cas9构建R778L类型肝豆状核变性疾病小鼠模型
2018-12-14朱基彦瞿思遥张祝琴刘德培
朱基彦,瞿思遥,张祝琴,刘德培
(中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室 生物化学与分子生物学系, 北京 100005)
肝豆状核变性(hepatolenticular degeneration,HLD)也称Wilson’s disease(WD,威尔逊病),是一类罕见的常染色体隐性遗传的单基因疾病[1]。该病是由位于13号染色体上的ATP7B基因发生突变、插入或者缺失引起一类铜离子代谢障碍的疾病。ATP7B蛋白位于反式高尔基体(trans-Golgi network, TGN)膜上,具有将铜离子运进反式高尔基体中使其与铜蓝蛋白相结合和将多余的铜离子运入胆汁排泄出肝细胞的双重功能[2]。目前,针对肝豆状核变性的治疗手段主要有控制饮食减少铜离子的摄取,利用铜离子螯合剂将淤积的铜排出体外和肝移植三种方法。
CRISPR/Cas9系统广泛应用于基因敲除、疾病动物模型的构建和基因治疗等领域中[3-4]。利用CRISPR/Cas9在基因组特定位点造成DNA双链损伤断裂,再利用机体DNA双链损伤修复途径实现基因敲除或者基因敲入。
肝豆状核变性突变类型众多,在中国等亚洲地区,最普遍的突变类型是R778L[5-6]。目前,应用最广泛的是ATP7B敲除小鼠,但是肝豆状核变性具有高度异质性,针对R778L类型构建相应的点突变小鼠对于具体发病机制的研究十分必要。
1 材料与方法
1.1 材料
1.1.1 细胞系:饲养层细胞为小鼠胚胎成纤维细胞(由本课题组野生型C57BL/6小鼠或者DR4小鼠分离得到)。小鼠胚胎干细胞JM8A3(为本课题组保存)。
载体:CRISPR/Cas9的pX330载体[Addgene (Ad42230)]。
1.1.2 实验小鼠和饲料:C57BL/6小鼠(SPF级别雄鼠)和小鼠专用饲料(北京维通利华公司),单位合格证号:ACUC-A02-2016-013。
试剂和耗材:DMEM、Knock-DMEM、Opti-MEM、胎牛血清(Gibcobrl公司或者PAA公司);青链霉素、β-巯基乙醇、T7体外转录试剂盒(Cat.No: AM1344) 、NEAA、Glutamax-1(Invitrogen公司);LIF(ESG1107)(Millipore公司); DharmaFECT1(T-2001-03转染试剂)(Thermo Fisher公司);2i抑制剂(Selleck公司);限制性内切酶及T7E1(New England Biolabs公司);RNeasy mini Kit (Qiagen公司)。
1.2 方法
1.2.1 CRISPR/Cas9系统的设计:sgRNA利用CRISPR DESIGN(http://crispr.mit.edu/) 针对小鼠ATP7B的8号外显子突变位点附近设计6条sgRNA。同源重组模板设计见实验结果。
1.2.2 T7E Ⅰ酶切实验:使用高保真PCR体系对目标片段进行PCR,将得到的PCR产物纯化回收,取500 ng PCR产物加入2 μL 10×NEB缓冲液2并用ddH2O补至20 μL后95 ℃变性5 min后自然冷却至室温。向退火产物中加入0.5 μL T7E1(5 U/μL),37 ℃酶切30 min后,2%琼脂糖凝胶电泳检测分析酶切结果。
1.2.3 体外转录guide RNA和Cas9 mRNA:分别用DraⅠ和NotⅠ内切酶线性化DNA模板后进行酚氯仿抽提纯化。使用T7体外转录试剂盒进行体外转录。37℃转录2 h后加0.5 μL DNase 37 ℃消化DNA模板20 min。使用RNeasy mini Kit纯化回收mRNA。
1.2.4 鼠受精卵显微注射:供体鼠与正常雄鼠合笼,手术取出受精卵,加入M2中洗涤,置于M16培养基于5% CO2,37 ℃细胞培养箱中培养;挑选形态饱满、透明带清晰的受精卵进行显微注射,吸取注射后仍存活的受精卵,吹入假孕鼠输卵管。
1.2.5 H&E染色:将石蜡切片放到 65 ℃ 烤片机上,烤片2 h。二甲苯脱蜡,水化,用蒸馏水洗去乙醇后用苏木精染细胞核4 min。用自来水慢慢冲洗终止反应,直至颜色变得发蓝。将切片放到 0.1%盐酸乙醇中70 s,用自来水洗 3~4遍,去除残留的盐酸。放入1%伊红溶液中数分钟,脱水,用二甲苯透明切片约 30 min。取出切片,待其风干,使用中性树胶封片。显微镜下观察拍照。
1.2.6 干的肝脏铜离子检测:切取500 mg小鼠肝脏于1.5 mL离心管中,置于-20 ℃过夜冷冻。将样品放入冷冻干燥仪中-48 ℃干燥,得到干燥的肝脏。将干燥的肝脏称重并记录。把肝脏用研磨器研磨成粉末,并用70%浓硝酸溶解(每50 mg样品需加入500 μL 70%浓硝酸)。室温溶解组织1 h后65 ℃继续溶解4 h。用去离子水稀释至3 mL。室温,1 500 r/min离心5 min。取上清,利用原子吸收光谱法测铜离子浓度。
1.2.7 脱靶效应的检测和评估:针对on-target 位点和CRISPR design(http://crispr.mit.edu/)预测的top20 off-target位点设计引物进行PCR,得到的PCR产物于Illumina PE150平台进行深度测序。
2 结果
2.1 ATP7B在人和小鼠中是高度保守的
首先比对人和小鼠ATP7B序列的同源性,发现DNA序列和蛋白序列都是高度保守的。由于突变位点分别存在于人第778位氨基酸和小鼠第780位氨基酸,故用小鼠的R780L突变类型代表人R778L突变类型。据统计,目前针对肝豆状核变性建立的动物模型物种中小鼠的使用频率最高,应用最广泛(图1)。
2.2 利用CRISPR/Cas9介导的基因敲入获得R780L突变小鼠
采用CRISPR/Cas9联合单链DNA介导的基因敲入实现精确的点突变。在8号外显子突变位点附近设计了6条sgRNA,通过T7E I酶切实验在小鼠ES细胞中筛选高效的sgRNA。最后通过显微注射小鼠受精卵成功获得携带目的点突变的小鼠(图2)。
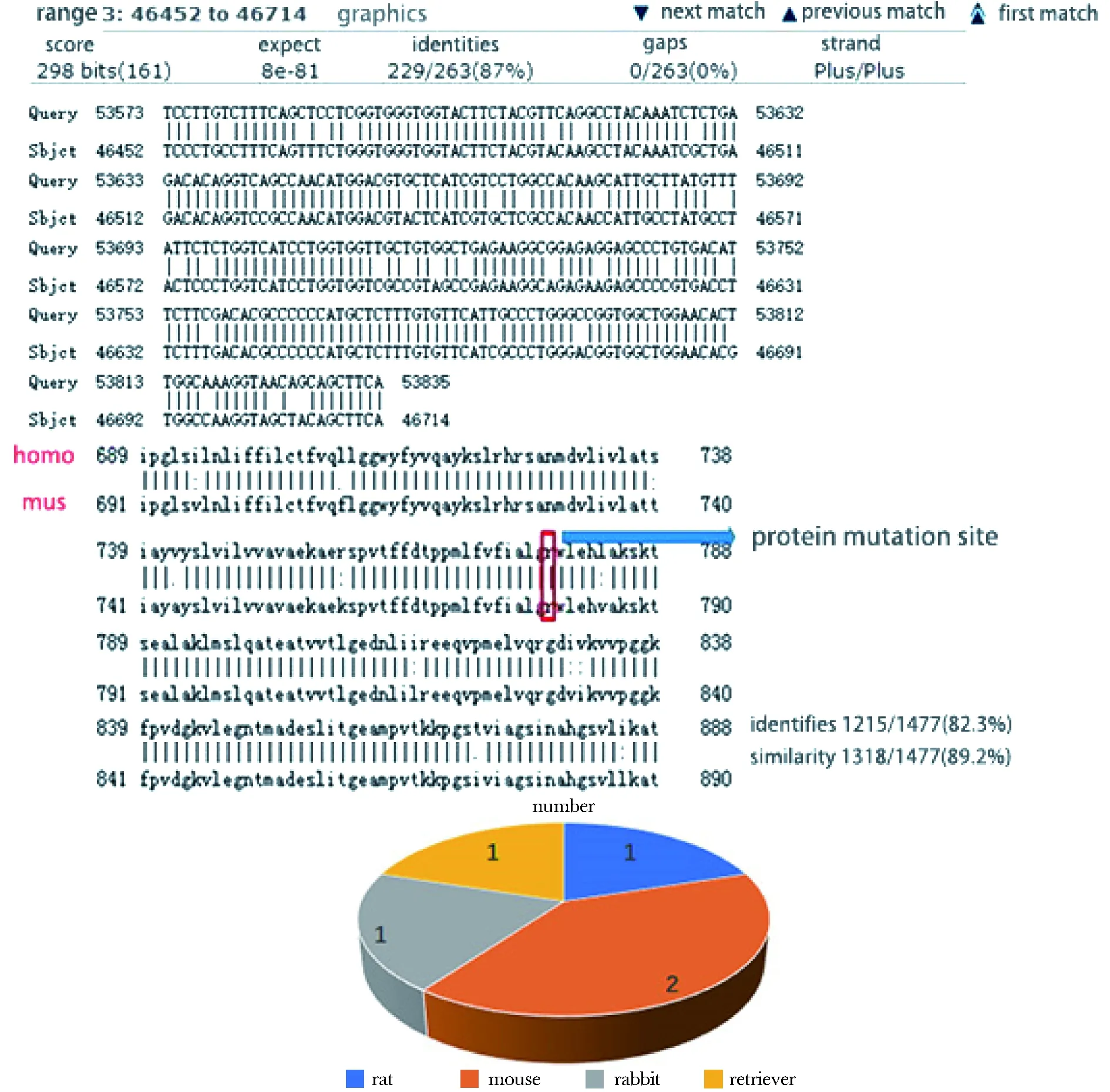
1,2.number of models图1 小鼠是合适的肝豆状核变性模型动物Fig 1 Mouse was suitable for establishing hepatolenticular degeneration model
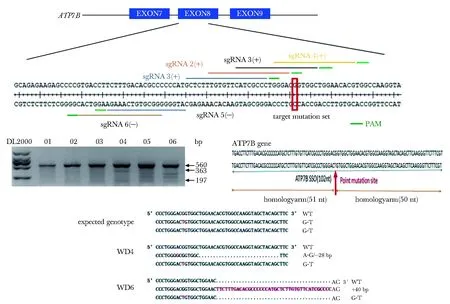
图2 利用CRISPR/Cas9介导的基因编辑获得R780L突变小鼠Fig 2 Using the CRISPR/Cas9-mediated gene editing to obtain R780L mutant mouse
2.3 R780L纯合小鼠肝脏有明显的病理改变
在没有铜离子刺激情况下,8周的野生雄鼠、R780L杂合雄鼠和R780L纯合雄鼠没有明显差异。当进行1 000 μmol/L CuSO4饮水从4周刺激到8周时,R780L纯合小鼠出现明显的肝脏组织结构性破坏,失去严密性,并伴随细胞核的增大。R780L杂合小鼠则无明显差异(图3)。
2.4 R780L纯合小鼠肝脏有明显的铜离子淤积且肝脏损伤明显
在没有铜离子诱导的情况下,R780L纯合小鼠有显著的铜淤积,杂合子则无此现象。加铜诱导后,R780L纯合小鼠铜离子依然比野生型显著升高,且加铜诱导组与未诱导组,铜离子含量相当。
加铜刺激组R780L纯合小鼠ALT和AST含量均显著升高。各组间的呼吸交换率没有发现显著差异(图4)。
2.5 R780L突变纯合模型鼠并未检测到脱靶情况
在R780L纯合小鼠中,并未检测到脱靶情形,证明构建的模型小鼠为R780L突变纯合模型鼠(表1)。
3 讨论
肝豆状核变性具有高度异质性,R778L类型的突变是包括中国在内的亚洲地区最为普遍的突变类型,但是其发病机制一直未被阐明。本研究利用CRISPR/Cas9系统首次建立了针对人R778L类型肝豆状核变性的R780L小鼠模型,并成功模拟出肝脏铜离子的淤积以及肝脏的病理病变,得出以下初步结论:小鼠是合适的肝豆状核变性模型物种;利用CRISPR/Cas9系统可以获得R780L特异点突变的小鼠;R780L点突变纯合小鼠有明显的铜离子淤积以及肝脏损伤;R780L点突变模型小鼠是一种特异性突变的小鼠,没有明显脱靶效应。所以R780L小鼠是研究R778L类型肝豆状核变性发病机制的理想模型。
目前肝豆状核变性疾病应用最广泛的模型是ATP7B knockout小鼠模型(以下简称KO模型)[7]。
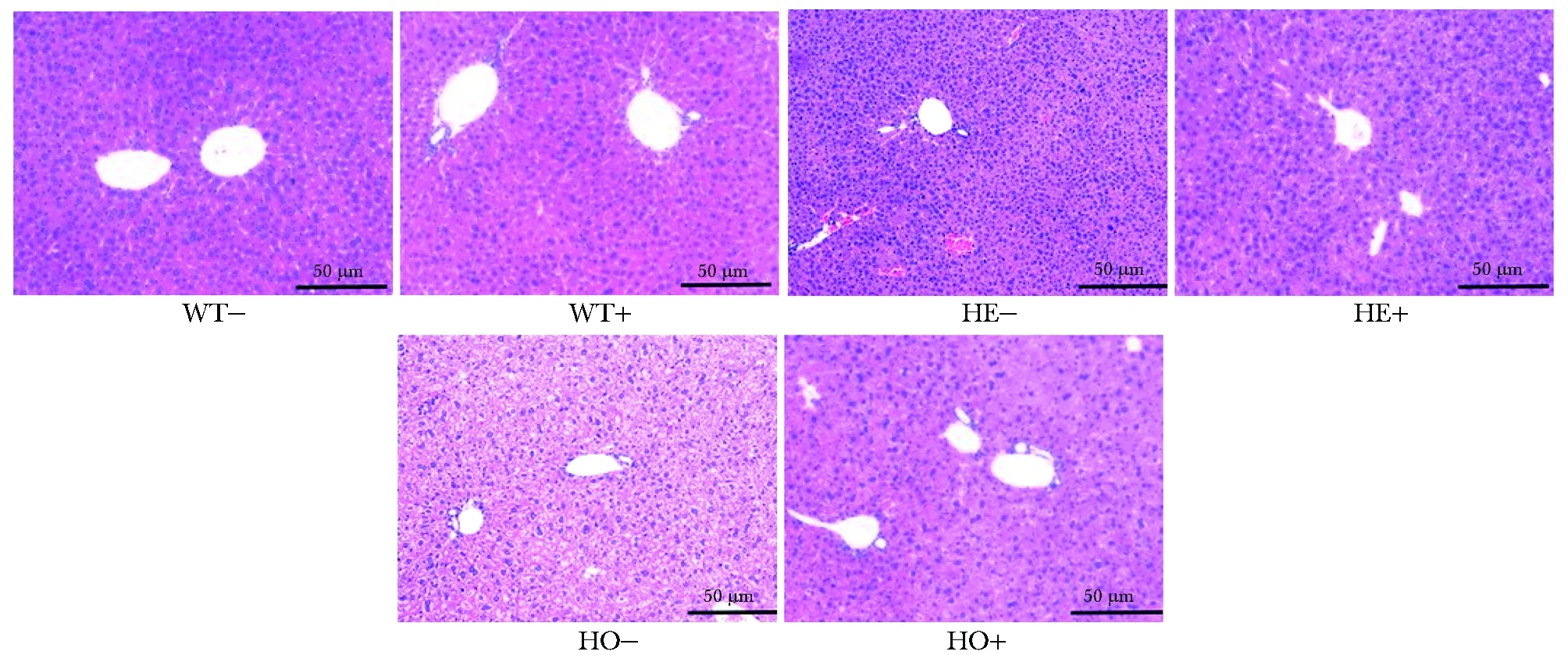
图3 R780L突变鼠的H&E染色结果Fig 3 H&E staining results of R780L mutant mouse
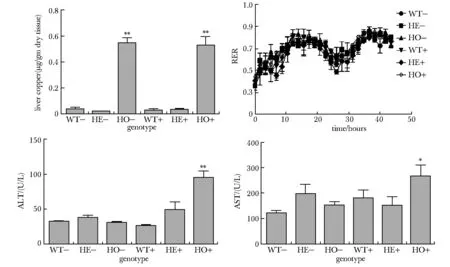
*P<0.05 compared with WT+ and WT-; **P<0.001 compared with WT+ and WT-图4 R780L纯合小鼠肝脏有明显的铜淤积并伴随严重的肝脏损伤Fig 4 R780L homozygous mouse liver had obvious copper deposition accompanied by severe liver damage
KO鼠的优点是能够研究肝豆状核变性发病的共性问题,能在最短的时间加深人们对肝豆状核变性的理解,但是不能精确阐述不同突变类型各自的特点[2,8-10],因此针对不同突变类型开发特定位点的动物模型是未来阐述肝豆状核变性更精细发病机制的方向。
随着CRISPR/Cas9为代表的高效基因编辑工具的出现,以及AAV病毒载体的发展,使得肝脏类单基因疾病有望通过基因治疗的手段实现[11-13]。因此, R780L突变小鼠有望成为未来肝豆状核变性基因治疗的理想载体。本研究也存在不足,目前只是在病理层面和分子层面模拟了R778L类肝豆状核变性的临床指标,对于其具体的分子机制尚未阐述,有待后续的实验证明。
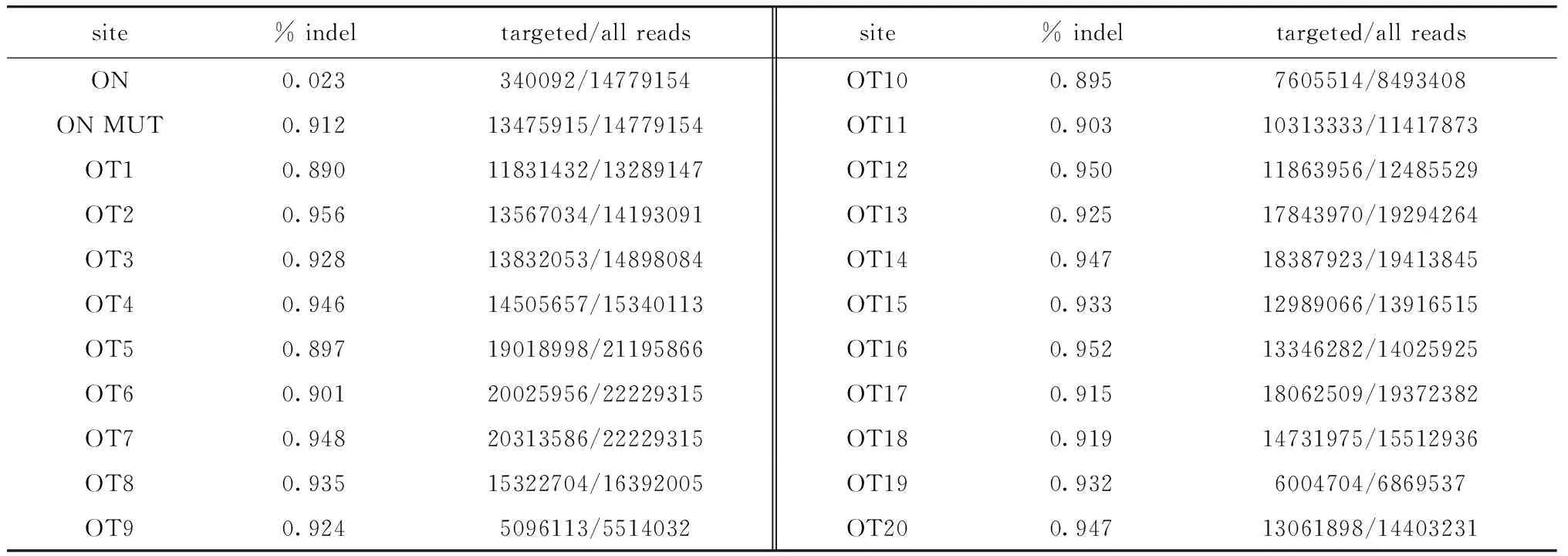
表1 R780L纯合突变小鼠脱靶效应的检测Table 1 Detection of off-target effects of R780L homozygous mutant mouse
