梗阻性和非梗阻性无精子症患者睾丸组织来源iPSCs系的建立
2018-12-14郭飞翔陈嘉欣马征来
郭飞翔,付 欣,陈嘉欣,马征来,张 文,安 庚*,范 勇*
(广州医科大学附属第三医院 1.广东省产科重大疾病重点实验室; 2.生殖医学中心,广东 广州 510150)
不育症在普通人群中的发病率约为10%,男、女方因素各占50%。在不育男性中,无精子症是最为严重的类型,发病率约为10%~15%,其主要分为两种类型:40%为梗阻性无精子症(obstructive azoospermia,OA),60%为非梗阻性无精子症(non-obstructive azoospermia,NOA)[1]。梗阻性无精子症是指射精通道中任何区域的梗阻导致的精子排出障碍,非梗阻性无精子症主要包括睾丸本身发育异常、药物及放疗等导致的精子生成障碍。近年来,随着辅助生殖技术的提高,特别是卵胞浆内单精子显微注射(intracytoplasmic sperm injection, ICSI)技术的广泛应用,梗阻性无精子症患者大都能如愿获得自己的小孩,但非梗阻性无精子症患者中仍有近半数的患者无法找到精子,只能选择供精[2]。诱导性多能干细胞(induced pluripotent stem cells,iPS)的出现为这部分没有获取精子的患者提供了新的希望,本研究旨在用无精子症患者自身的睾丸组织建立iPSCs系,并且对比OA患者和特发性NOA患者的建系过程有无区别。
1 材料与方法
1.1 材料
1.1.1 组织:收集广州医科大学附属第三医院生殖医学中心2017年10月3例OA患者和3例特发性NOA患者的睾丸组织,分别在睾丸组织活检术(testicular sperm extraction, TESE)和睾丸显微取精术(micro-TESE)中取5~6 mm3的曲细精管组织作原代培养。该研究获得广州医科大学附属第三医院科学研究伦理委员会的批准,所有患者均签署知情同意书。
1.1.2 试剂:DMEM/F12(1∶1)、penicillin-streptomycin(双抗)、kockout-DMEM、kockout-serum replacement(KSR)、glutamax(谷氨酰胺)、non-essential amino acids(非必需氨基酸)、bFGF(碱性成纤维细胞生长因子)、beta-mercaptoethanol(β-巯基乙醇)、0.05% trypsin/EDTA(胰蛋白酶)及EDTA(乙二胺四乙酸)(Gibco公司),FBS(胎牛血清)(HyClone公司),一抗:兔抗人SOX2单克隆抗体、兔抗人OCT4单克隆抗体、小鼠抗人TRA-1-60单克隆抗体、小鼠抗人SEEA-4单克隆抗体,二抗:FITC偶联的山羊抗兔IgG和FITC偶联的山羊抗小鼠IgM (Abcam公司);碱性磷酸酶(AP)染色液(武汉博士德生物工程有限公司);仙台病毒重编程试剂盒(Invitrogen 公司);mTeSRTM1和 Matrix胶(Stem Cell Technology公司)。6只无特定病原体(SPF)级6~8周龄雄性严重联合免疫缺陷(SCID)小鼠,体质量18~21 g[北京维通利华实验动物技术有限公司,SCXK(京)2016-0011]。
1.2 方法
1.2.1 睾丸组织原代培养:将TESE和micro-TESE术中取到的睾丸组织迅速转移至无菌实验室。超净台中准备3个6 cm的培养皿,分别加入4 mL 2% PS(双抗)的PBS缓冲液(磷酸缓冲盐溶液),将睾丸组织在3个培养皿中依次清洗;再转移至盛有基础培养基的(89% DMEM/F12+10% FBS+1% PS)3.5 cm培养皿中,用两把显微镊的尖端将曲细精管组织研磨至碎片状,再转移至15 mL离心管中,1 000 r/min离心3 min;轻轻吸弃上清,加入30 μL基础培养基重悬组织沉淀,再将组织碎片重悬液均匀铺种于4孔板中,使培养基正好盖过组织碎片又不至于漂浮;置于37 ℃、5% CO2培养箱中进行培养。每天换液,根据细胞增殖量适当添加培养基的用量。
1.2.2 iPSCs系的建立:睾丸组织原代细胞P2代细胞增殖满后,用胰蛋白酶消化细胞,计算细胞总量,取1.5×105个细胞量种于3.5 cm培养皿中,第2天观察细胞状态良好,进行病毒转染。病毒操作均在二级生物安全柜内进行,先将仙台病毒液置于冰上融化,准备15 mL离心管,加入2 mL基础培养基,再加入仙台病毒液,混匀,2 250 r/min离心30 min。吸弃旧培养基,各加入1 mL新鲜基础培养基,再将离心后的病毒和培养基混液各1 mL加入到培养皿中。24 h后观察细胞状态,每天换液。待转染后的细胞增殖满后再转移至种有feeder(饲养层细胞)的10 cm培养皿中。D0继续用基础培养基,D1开始换用iPSCs培养基(77% KO-DMEM +20% KSR+1% Glu+1% NEAA+1% PS+bFGF+β-巯基乙醇),每天换液。第21~22天挑取iPSCs克隆后,换用mTeSRTM1培养基继续进行培养,适时机械切割法去除分化克隆。
1.2.3 iPSCs系的多能性鉴定
1.2.3.1 AP染色:准备30%~40%密度的iPSCs细胞(3.5 cm培养皿),吸弃旧培养基,PBS清洗3次,加入1 mL 4%多聚甲醛固定1 min;吸弃固定液,PBS清洗3次,加入1 mL新鲜配制的AP染色工作液,室温避光放置30 min;吸弃染色液,PBS清洗1次,再加入PBS溶液,显微镜下观察染色结果。
1.2.3.2 免疫荧光:将iPSCs传至4孔板,待细胞增殖至3~4 d,吸弃培养基,用PBS将细胞清洗3次,4%多聚甲醛室温固定30 min;用PBS清洗3次,0.5%聚乙二醇辛基苯基醚(Triton X-100)室温透膜1 h;吸弃透膜液,用PBS清洗3次,用2%的牛血清白蛋白(BSA)室温封闭1 h;分别加一抗4 ℃孵育过夜;吸去一抗,用PBS清洗3次,分别加二抗37 ℃恒温箱内避光染色1 h;吸去二抗,用PBS清洗3遍,然后用DAPI复染细胞核10 min;吸弃DAPI,用PBS清洗1次,再加入PBS溶液,置于共聚焦显微镜下成像观察。
1.2.3.3 畸胎瘤实验: 选择第4~5天的iPSCs,用EDTA将细胞消化后,分别收集约1×107的单细胞悬液,注射到6周龄雄性SCID小鼠的腹股沟皮下,10~11周后取出瘤块,用4%多聚甲醛固定,常规石蜡包埋切片,HE染色后在光学显微镜下观察三胚层。具体步骤参照本团队之前的文献[3]。
2 结果
2.1 原代培养
组织培养第2天观察到组织碎片贴于4孔板底部,第3天组织边缘开始出现增殖的细胞,第9~10天达到增殖高峰,第13~14天增殖满(图1)。
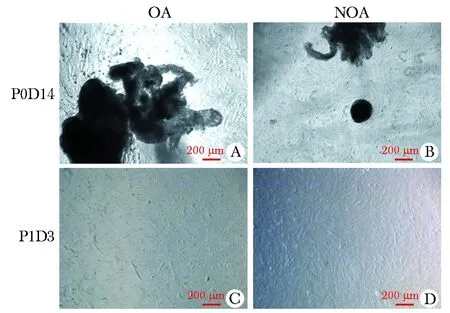
A and B show cells in day 14 of OA and NOA patients, respectively; C and d show cells in day 3 passage 1 of OA and NOA patients, respectively 图1 睾丸组织的原代培养Fig 1 Primary culture of tetis tissue(scale=200 μm)
2.2 iPSCs建系
转染仙台病毒后的睾丸组织细胞状态良好,3~4天后皿底增殖满细胞,胰蛋白酶消化传代,铺种于feeder上。第10天可见明显的iPS细胞克隆团,根据克隆的增殖状态在第21~22天采用机械切割法挑取克隆至4孔板(图2)。经过3~4次传代培养后,iPS克隆保持未分化的状态增殖,排列紧密,状态良好。
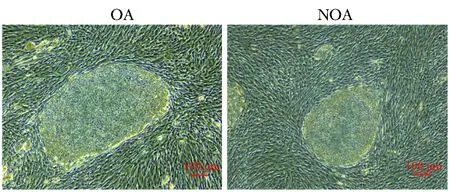
图2 OA患者和NOA患者feeder上的iPS克隆长至 第21天Fig 2 iPS clones on feeders in day 21 of OA and NOA patients, respectively(scale=100 μm)
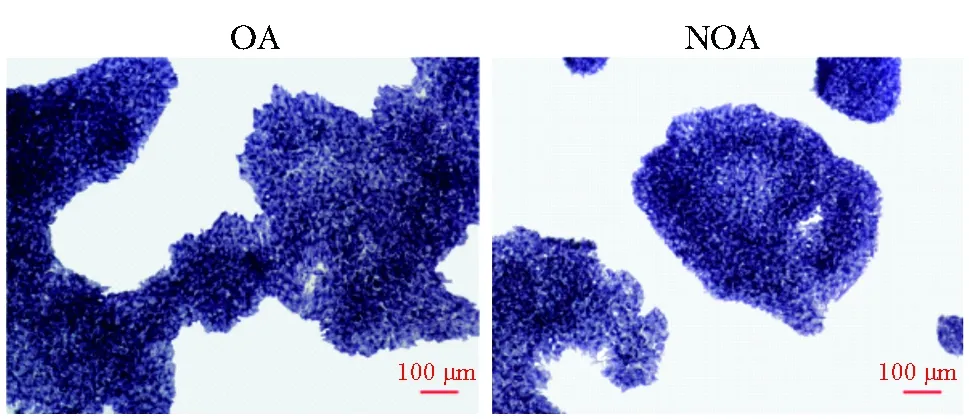
图3 OA患者和NOA患者iPSCs细胞AP染色阳性Fig 3 Positive AP staining in iPSCs cells of OA and NOA patients, respectively(scale=100 μm)
2.3 iPSCs系的多能性鉴定
iPSCs克隆传至第3代做AP染色和免疫荧光染色,分别鉴定所获得的iPSCs系的分化状态及其多能性。两株iPSCs系的AP染色均为阳性(图3);OCT4、SOX2、SSEA-4、TRA-1-60的免疫荧光染色均为阳性(图4)。
2.4 iPSCs系的体内分化能力鉴定
将iPSCs细胞悬液注射入裸鼠腹股沟皮下后,6~8周后可见畸胎瘤形成,10~11周畸胎瘤长至1 cm3左右,畸胎瘤取出后,切片做HE染色,镜下可见3个胚层(图5)。
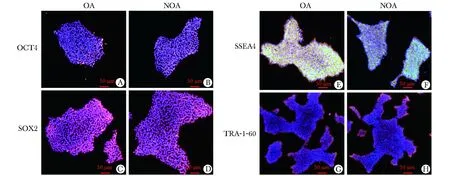
A and B show merge image with OCT4 and DAPI staining of testis-derived iPSCs in OA and NOA patients, respectively; C and D show merge image with SOX2 and DAPI staining; E and F show merge image with SSEA4 and DAPI staining; G and H show merge image with TRA-1-60 and DAPI staining
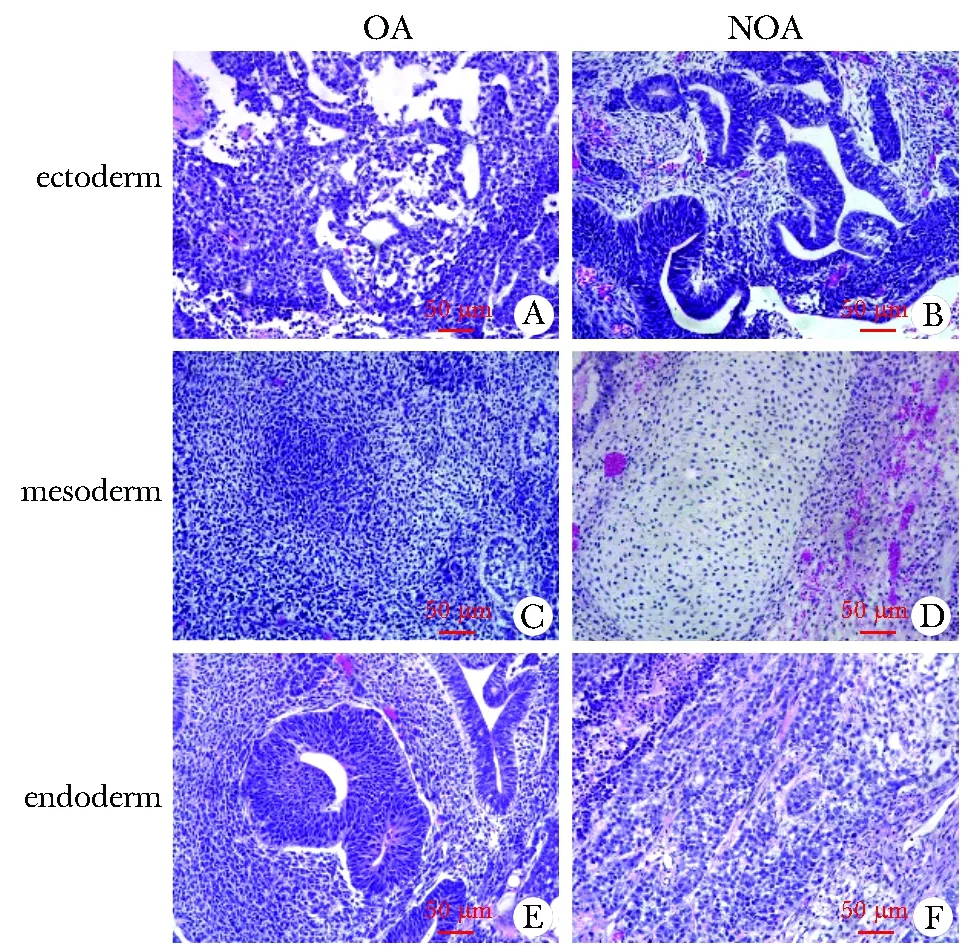
A and B show differentiatedectoderm of the testis-derived iPSCs in OA and NOA patients, respectively; C and D show differentiated mesoderm; E and F show differentiated endoderm图5 体内畸胎瘤形成实验Fig 5 Vivo teratoma formation(scale=50 μm)
3 讨论
男性不育症已经成为一个全球性的公共健康问题,越来越多的男性受到不育问题的困扰,其中治疗最困难的是NOA患者,主要临床表现为睾丸体积偏小,高卵泡刺激素水平(FSH),并伴有严重的生精功能障碍。目前这些患者最主要的治疗方法是睾丸显微取精术(micro-TESE)结合卵胞浆内单精子显微注射技术(ICSI)的治疗,其总体取精率约为60%,一次妊娠率约为45%,治疗结局依然不够理想[2]。为了更好的帮助这部分患者,临床上还需要制定更有效的治疗方案来帮助NOA患者,近年来,iPS细胞的出现及其在体外分化为精子的研究给NOA患者提供了新的希望。
近年来,有关小鼠生殖细胞系的诸多研究,为 iPSCs细胞体内和体外发育成雄性生殖细胞提供了理论基础[4-6]。胚胎干细胞(embryonic stem cell,ESC)是早期胚胎或原始性腺中分离出来的一类细胞,无论在体外还是体内环境,ESC都能被诱导分化为机体内几乎所有的细胞类型。鼠诱导性多能干细胞(miPSCs)类似于鼠胚胎干细胞(mESCs),也能获得原始生殖细胞样细胞(PGCLC),可以在体内分化为精子,并且通过ICSI技术产生健康的小鼠后代[7]。相比与miPSCs的naive状态,人诱导多能干细胞(hiPSCs)的primed状态诱导成男性生殖细胞的潜能相对要小,诱导分化成生殖细胞的难度也更大。目前,各个团队已经尝试了多种方法研究hiPSCs诱导成男性生殖细胞,包括自发分化、生殖细胞调节因子的过表达、细胞因子的添加、性腺细胞体外共培养及异种移植等[8-10]。
先前已有用皮肤成纤维细胞、角质细胞及外周血细胞建立诱导多能干细胞系的成功报道[11-13],本研究选择与精子发生直接相关的睾丸组织,取OA患者和特发性NOA患者的睾丸组织进行原代培养,结合仙台病毒非基因整合方法成功建立了两株无精子症iPSCs系。两株iPSCs系的AP染色均为阳性;表达人干细胞多能性标志蛋白OCT4、SOX2、SSEA-4、TRA-1-60;小鼠畸胎瘤实验也显示获得的iPSCs系能够形成含三胚层的细胞,证明了无精子症睾丸组织来源的iPSCs细胞具有多能性和高分化潜能。对OA患者和特发性NOA患者的睾丸组织基本建系过程进行了比较,从原代培养到iPSCs细胞的克隆形成及iPSCs细胞系的稳定性均没有明显差异,说明特发性NOA患者虽然生精障碍的原因暂不明确,但同OA患者一样,睾丸组织能够通过现有建系方法获得iPSCs系。随着精子发生机制和iPSCs细胞的研究进一步深入,hiPSCs在生殖领域和治疗男性不育方面的应用依然具有巨大的潜力,为临床工作提供了新的治疗策略,更为NOA患者产生健康后代提供了可能性。
