高效产锰氧化酶鞘细菌的分离鉴定及酶学特性
2017-11-17邓加聪王诗瑶蒋素素
邓加聪,王诗瑶,蒋素素,郑 虹*
(福建师范大学 福清分校海洋与生化工程学院,福建 福清 350300)
高效产锰氧化酶鞘细菌的分离鉴定及酶学特性
邓加聪,王诗瑶,蒋素素,郑 虹*
(福建师范大学 福清分校海洋与生化工程学院,福建 福清 350300)
从活性污泥中分离筛选锰氧化酶鞘细菌及研究酶学特性,利用尿素富集培养基、CGY平板及摇瓶复筛从水样中分离产锰氧化酶菌株,通过菌落形态观察、生理生化实验和16S rRNA基因序列对菌株进行鉴定,并对其发酵条件及所产锰氧化酶的酶学性质进行研究。结果表明,分离筛选到一株高产锰氧化酶的菌株FM-3,被鉴定为鞘细菌属纤发菌(Leptothrix)。该菌株的最适产酶条件为甘油添加量0.8%,蛋白胨添加量0.15 g/L,吐温-80添加量0.2%,30℃150 r/min振荡培养72 h,此时发酵液的锰氧化酶活性可达2 977.44 IU/mL。该菌株产锰氧化酶的最适温度和pH分别为40℃和7.0,添加一定量的Mg2+对锰氧化酶活性有增强作用,Ca2+、Cu2+对锰氧化酶影响不大,Pb2+、Zn2+、Ag+对锰氧化酶具有一定的抑制作用。
纤发菌;锰氧化酶;分离筛选;鉴定;酶学特性
锰是地球上广泛分布的元素之一,是仅次于铁的第二大过渡元素,我国很多地区的地下水中锰含量超过饮用水(0.1 mg/L)的标准[1],长期饮用锰超标的水,会给人体带来极大的危害[2]。因此对锰污染的水资源进行除锰处理时必须的。目前最常用的锰治理方法是生物除锰法,是利用锰氧化菌将水中二价锰离子氧化成不溶性的高价锰化合物,通过过滤达到除锰的目的[3-6]。
自然界中常见的锰氧化菌主要有链霉菌属(Streptomyces)、节杆菌属(Arthrobacter)、假单胞菌属(Pesudomonas)、芽孢杆菌属(Bacillus)和亚硝化单胞菌属(Nitrosomonas)[7-9]等。国内外对锰氧化菌的研究主要集中在锰氧化菌的分离筛选、水中锰离子去除的条件及应用、锰氧化机理的研究等[10-11]。RAJASABAPATHY R等[12]从亚速尔群岛海水浅水域、热泉喷口表面分离除了一株非运动性、需氧型的、呈杆或狭窄柠檬型的革兰氏阴性菌株VSW210T,该菌在温度30℃、pH 7、NaCl 2%~6%的条件下生长良好。基于16S rRNA基因序列以及邻接法系统发育树结果显示,菌株VSW210T鉴定为Citreicella marina。晏平等[13]从某水厂的生物除锰滤池中分离出1株新的高效锰氧化菌,命名为H1,通过生理生化试验及16S rDNA序列对比分析鉴定为氨基杆菌(Aminobactersp.),Aminobactersp.H1的锰耐受浓度高达50 mmol/L,可完全去除浓度低于10 mmol/L的Mn(Ⅱ),菌株H1对Mn(Ⅱ)的氧化主要是通过产生锰氧化活性因子和碱性代谢产物提高pH两个因素共同作用的结果。
本实验旨在研究锰氧化酶产生菌的分离筛选、产酶发酵条件优化及酶学特性研究,为后续锰污染的治理及锰氧化酶的分离研究提供奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
水样:福州祥坂污水处理厂的活性污泥混合液。
1.1.2 主要试剂
生工SK8255柱式细菌基因组DNA抽提试剂盒、Taq DNA聚合酶、琼脂糖、DNAMarker、正向引物16S-F:5′-CAGAGTTTGATCCTGGCT-3′、反向引物16S-R:5′-AGGAGGTGATCCAGCCGCA-3′:生工生物工程(上海)有限公司。
1.1.3 培养基
(1)尿素富集培养基:尿素0.5 g/L,葡萄糖1.0 g/L,MgSO4·7H2O 0.05 g/L,K2HPO40.1 g/L,pH 7.0。
(2)CGY斜面培养基:蛋白胨5.0 g/L,酵母膏1.0 g/L,甘油10.0 g/L,琼脂20 g/L,pH 7.0。
(3)Stoke平板培养基:葡萄糖1.0 g/L,蛋白胨1.0 g/L,MgSO4·H2O 0.2 g/L,CaCl20.05 g/L,FeCl30.01 g/L,pH 7.0。
(4)铁锰细菌选择性培养基(基础产酶培养基):蛋白胨0.25g/L,酵母膏0.25g/L,葡萄糖0.25g/L,柠檬酸铁铵10g/L,MgSO4·7H2O 0.5 g/L,K2HPO40.5 g/L,CaCl20.2 g/L,NaNO30.5 g/L,NH4NO30.5 g/L。
1.2 仪器与设备
BS97MyCycler聚合酶链反应(polymerase chain reac tion,PCR)仪:美国Bio-Rad公司;FA2204B型电子分析天平:上海越平科学仪器有限公司;LDZX-40B1型立式自动电热压力蒸汽灭菌器:上海申安医疗器械厂;TGL-M型台式冷冻离心机:上海湘仪离心机有限公司;SPX-15OB-Z型生化培养箱:上海博讯实业有限公司医疗设备厂;THZ-25大容量恒温振荡器:太仓市华美生化仪器厂;7200型分光光度计:尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 菌株的富集培养及分离筛选
取1 mL水样接种于尿素培养基,混匀,30℃静置培养,定期挑取培养液表面的絮状物移入新鲜尿素培养基中,反复富集3次,取富集液划线于Stoke平板培养基,30℃倒置培养24 h,挑取单菌落接种于CGY试管斜面。
1.3.2 锰氧化细菌的复筛
将上述筛选到的菌株,接种于CGY试管斜面,30℃活化24 h,用无菌水制成浓度为107个/mL的菌悬液,按2%接种量接入铁锰细菌选择性培养基中,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶的活性。
1.3.3 锰氧化细菌的菌落菌体形态及生理生化鉴定
将试管保存的菌株划线接种于平板培养基,30℃倒置培养2 d。根据《常见细菌系统鉴定手册》[14]和《伯杰氏细菌鉴定手册》[15]对菌株进行菌落细胞形态及生理生化鉴定。
1.3.4 锰氧化细菌16S rRNA基因序列的遗传分析
锰氧化细菌基因组的提取:按照试剂盒说明书提取菌株基因组DNA。16S rRNA基因的扩增与分析:采用细菌通用引物进行扩增,PCR反应条件为:98℃、3 min;98℃、25 s,55℃、25s,72℃、1min,循环30次;延伸10min。扩增产物用1%的琼脂糖凝胶电泳进行检测。16S rRNA基因测序委托上海生工公司完成。测序序列与美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站GenBank中的已知序列进行Blast。采用MAGE 4.0软件中Bootstrap Test of Phylogeny的邻接(neighbor-joining,N-J)法BootStrap的设定值为1 000)构建系统进化树,进行系统发育的分析[16-17]。
1.3.5 菌株产锰氧化酶发酵条件的优化
(1)不同碳源对菌株产锰氧化酶的影响
按3%接种量将种子液接种于添加有不同碳源(柠檬酸钠、蔗糖、葡萄糖、酵母膏、可溶性淀粉、甘油)的发酵培养基,每种碳源的添加量为0.5 g/L,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶活力。
(2)甘油添加量对菌株产锰氧化酶的影响
按3%接种量将种子液接种于添加有不同量甘油(0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L)的发酵培养基,30℃、150r/min振荡培养72h,测定发酵液中锰氧化酶活力。
(3)不同氮源对菌株产锰氧化酶的影响
按3%接种量将种子液接种于添加有不同氮源(硝酸钠、蛋白胨、尿素、硝酸铵、硫酸铵、氯化铵)的发酵培养基,各种氮源的添加量为0.25 g/L,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶活力。
(4)蛋白胨添加量对菌株产锰氧化酶的影响
按3%接种量将种子液接种于添加有不同量蛋白胨(0.05 g/L、0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L、0.30 g/L)的发酵培养基,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶活力。
(5)培养时间对菌株产锰氧化酶的影响
按3%接种量将种子液接种于发酵培养基,30℃、150 r/min振荡培养,每隔12 h(12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h)取样测定发酵液中锰氧化酶活力。
(6)吐温-80添加量对菌株产锰氧化酶的影响
按3%接种量将种子液接种于不同吐温-80添加量(0.1g/L、0.2g/L、0.3g/L、0.4g/L、0.5g/L、0.6g/L)的发酵培养基,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶活力。
(7)菌株产锰氧化酶的正交设计试验
为了进一步研究甘油、蛋白胨、吐温-80、培养时间对菌株发酵产锰氧化酶能力的影响,以甘油、蛋白胨、吐温-80、培养时间这4个因素进行正交试验,根据单因素试验结果,选择L9(34)进行试验设计。正交试验因素与水平见表1。
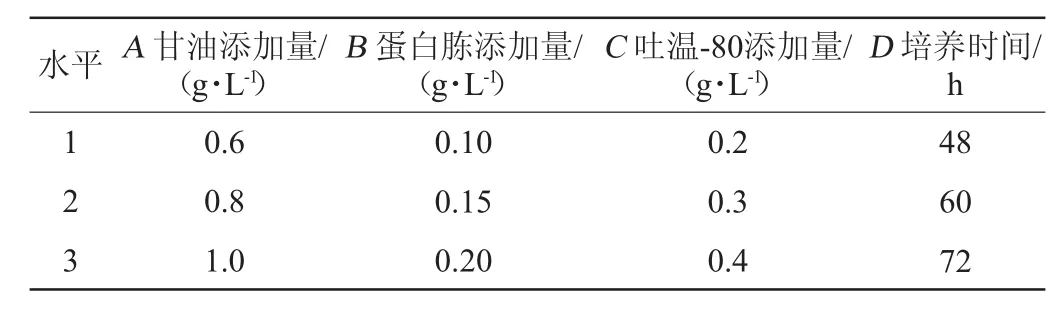
表1 发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for fermentation conditions optimization
1.3.6 菌株产锰氧化酶活力的测定
吸取粗酶液5 mL,加入质量浓度为400 mg/L的硫酸锰母液5mL,30℃静置反应30min,按甲醛肟分光光度法测定(测定吸光度值前离心去除沉淀物[18-21]。
锰氧化酶酶活力单位定义为每分钟单位体积酶液氧化1 μmol二价锰离子所相当的酶量(IU/mL)。


发酵液8 000 r/min、4℃离心5 min,收集上清液,备用。
锰氧化酶的酶学性质:取10mL上清液分别在不同温度(20℃、25℃、30℃、35℃、40℃、45℃、50℃),不同pH(6.0、6.5、7.0、7.5、8.0、8.5)的缓冲体系,以及不同金属离子溶液(Pb(NO3)2、MnCl2、CuCl2、MgCl2、AgNO3、ZnCl2)中保持30min使金属离子终浓度达到5 mmol/L,测定处理液的锰氧化酶活性,考察温度、pH及金属离子对锰氧化酶的影响。
2 结果与分析
2.1 锰氧化细菌的富集与分离筛选
通过尿素培养基富集培养、Stoke平板培养基稀释涂布及划线分离,从水样中分离出8株鞘细菌,编号为FM-1、FM-2、FM-3、FM-4、FM-5、FM-6、FM-7、FM-8。

图1 不同菌株锰氧化酶活性的比较Fig.1 Comparison of manganese oxidase activities of different strains
将筛选到的8株锰氧化细菌接种于铁锰细菌选择性培养基,30℃、150 r/min振荡培养3 d,测定发酵液的锰氧化酶活性,结果见图1。由图1可知,不同菌株产锰氧化酶的活力有一定的差别,菌株FM-3>FM-1>FM-8>FM-6>FM-5>FM-4>FM-2>FM-7,这8株菌的锰氧化酶活性均>1 500 IU/mL,其中菌株FM-3的锰氧化酶活性达到2 341.035 IU/mL。因此,确定以菌株FM-3进行进一步试验。
2.2 菌株FM-3的形态特征和生理生化特征
2.2.1 菌株FM-3的菌落、菌体形态

图2 菌株FM-3的菌落(A)与菌体(B)形态Fig.2 Colony(A)and cell(B)morphology of strain FM-3
由图2A可知,菌株FM-3的菌落呈白色,直径约1.5mm,边缘不规则伴有卷曲的丝状伸出,扁平,中央较厚。由图2B可知,菌株FM-3的菌体呈典型的丝状体结构,许多细胞共同生长在一个管状鞘内,且呈丝状排列,单个细胞为杆状,两端钝圆,革兰氏染色结果为阴性。
2.2.2 菌株FM-3的部分生理生化试验
将4℃冰箱保存菌株FM-3接种于CGY培养基,30℃活化2 d,新鲜菌株进行各项生理生化试验,结果见表2。

表2 菌株FM-3的生理生化鉴定Table 2 Physiological and biochemical identification of strain FM-3
由表2可知,菌株FM-3为葡萄糖发酵型,能分解糖、醇类产生有机酸不产气;能产硫化氢、过氧化氢酶及硝酸盐还原酶;能利用柠檬酸盐、酒石酸盐和丙二酸盐;具有水解淀粉及微弱的明胶液化能力;M-R反应为阳性,V-P测定和吲哚反应呈阴性。
综合菌株FM-3的菌株形态及生理生化试验结果,菌株FM-3能水解明胶,能产生过氧化氢酶、硝酸盐还原酶等,菌株多个细胞在同一管鞘内生长,与文献已报道的纤发菌的形态基本一致[14,22],因此初步鉴定该菌株为鞘细菌属的纤发菌(Leptothrix)。
2.3 菌株FM-3的16S rRNA基因序列分析
菌株FM-3的16S rRNA PCR扩增产物经过琼脂糖凝胶电泳分析,获得其序列大小约为1454bp。与NCBI的核酸数据库进行Blast比对,随机选取同源性相近的菌株序列,构建进化树,结果见图3。

图3 菌株FM-3基于16S rRNA基因序列的系统发育树Fig.3 Phylogenetic tree based on 16S rRNA gene sequences of strain FM-3
由图3可知,菌株FM-3与纤发菌属(Leptothrix)聚为一类,且与登录号NR026333.1、FM886893.1等菌株16S rRNA序列的同源性达到99%。因此,在细菌系统发育分类学上,将该菌株鉴定为纤发菌,命名为纤发菌(Leptothrix)FM-3。
2.4 菌株FM-3产锰氧化酶发酵条件的单因素试验
2.4.1 不同碳源对菌株FM-3产锰氧化酶的影响
在基础产酶培养基中,分别以不同的碳源(添加量为0.5g/L)替代酵母膏、葡萄糖,30℃、150r/min振荡培养72 h,测定发酵液中锰氧化酶的酶活,结果见图4。
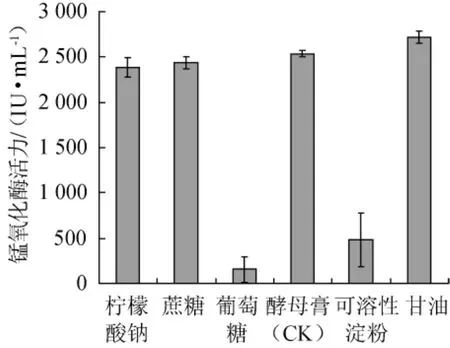
图4 碳源对菌株FM-3产锰氧化酶的影响Fig.4 Effect of carbon sources on the manganese oxidase produced by strain FM-3
由图4可知,菌株FM-3对不同的碳源利用程度不同,其利用情况如下:甘油>酵母膏(CK)>蔗糖>柠檬酸钠>可溶性淀粉>葡萄糖。结果表明,甘油为该菌的最适碳源,蔗糖及柠檬酸钠次之,以葡萄糖和可溶性淀粉为碳源时,菌株FM-3基本不产酶;当以甘油为最适碳源时,该菌株锰氧化酶的活力可达2 715.56 IU/mL。综上所述,菌株FM-3的最适产酶碳源为甘油。
2.4.2 甘油添加量对菌株FM-3产锰氧化酶的影响
在基础产酶培养基中添加不同含量的甘油,30℃、150 r/min振荡培养72 h,测定不同甘油添加量对菌株FM-3产酶的影响,结果见图5。

图5 甘油添加量对菌株FM-3产锰氧化酶的影响Fig.5 Effect of glycerin addition on the manganese oxidase produced by strain FM-3
由图5可知,不同的甘油添加量对菌株产锰氧化酶的影响差异明显,菌株产锰氧化酶的活力随着甘油添加量的增加呈先增后降的趋势;当甘油添加量<0.8 g/L时,随着甘油添加量的增加,产酶量也随之增高;当甘油添加量为0.8 g/L时,发酵液中锰氧化酶的产量最高,其酶活力可达2 069.741 IU/mL;当甘油添加量>0.8 g/L时,产酶量有所减少,说明过低或过高的甘油添加量使碳源浓度过小或过大,都不利于菌株的利用和锰氧化酶的产生。因此,菌株最适产酶的甘油添加量为0.8 g/L。
2.4.3 不同氮源对菌株FM-3产锰氧化酶的影响
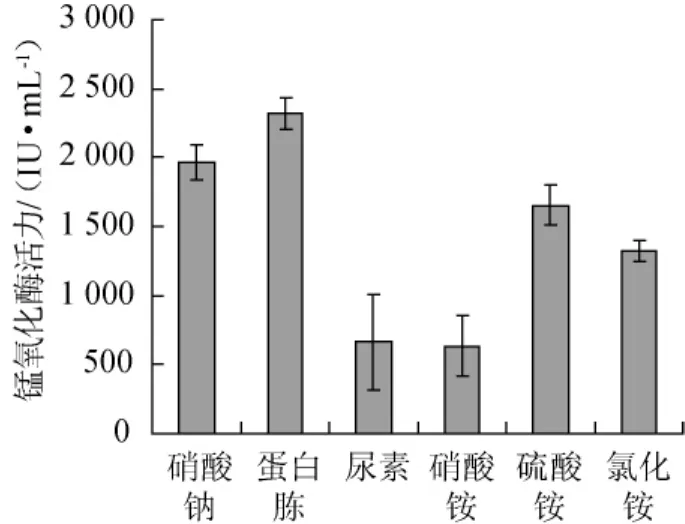
图6 氮源对菌株FM-3产锰氧化酶的影响Fig.6 Effect of nitrogen sources on the manganese oxidase produced by strain FM-3
在添加有甘油的基础产酶培养基中,分别以不同的氮源替代蛋白胨,添加量为0.25 g/L,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶的酶活,结果(图6)可知,菌株FM-3对不同氮源的利用率有一定的差别,菌株FM-3对有机氮的利用高于无机氮的利用,菌株FM-3对氮源的利用情况如下:蛋白胨>硝酸钠>硫酸铵>氯化铵>尿素>硝酸铵;当氮源为蛋白胨时,其产酶量最高,其锰氧化酶活力可达3 012.98 IU/mL。故以蛋白胨为最适氮源。
2.4.4 蛋白胨添加量对菌株FM-3产锰氧化酶的影响
在基础产酶培养基中加入不同量的蛋白胨,30℃、150 r/min振荡培养72 h,测定发酵液中锰氧化酶的酶活,结果见图7。
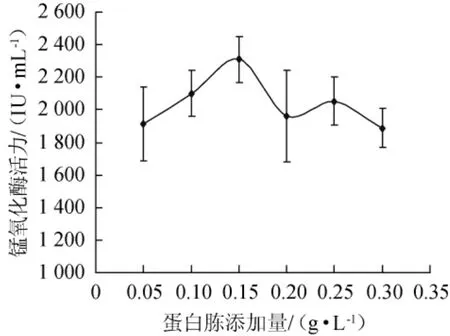
图7 蛋白胨添加量对菌株FM-3产锰氧化酶的影响Fig.7 Effect of peptone addition on the manganese oxidase produced by strain FM-3
由图7可知,菌株FM-3产锰氧化酶的活力随着蛋白胨添加量的增加呈先增后降低的趋势,当蛋白胨添加量为0.15 g/L时,锰浓度最低即产酶量最高,当蛋白胨添加量<0.15 g/L时,随着氮源添加量的增加,产酶量也随之增高;当蛋白胨添加量>0.15 g/L时,产酶量有所减少。因此,菌株FM-3产锰氧化酶的最适蛋白胨添加量为0.15 g/L。
2.4.5 不同培养时间对菌株FM-3产锰氧化酶的影响
在基础发酵培养基中,30℃、150r/min振荡培养一定时间,每隔12h取样测定发酵液中锰氧化酶酶活,结果见图8。

图8 培养时间对菌株产锰氧化酶的影响Fig.8 Effect of culture time on the manganese oxidase
由图8可知,菌株FM-3锰氧化酶的产量随培养时间的增长呈先增后降的趋势,当发酵培养时间为12~60 h时,锰氧化酶活力随时间的增长而提高;当发酵培养时间为60 h时,锰氧化酶活力最高,其锰氧化酶活力可达3451.68IU/mL;当发酵培养时间>60 h之后,随着培养时间的延长,锰氧化酶活力反而下降[11-13]。因此,菌株FM-3产锰氧化酶的最适发酵时间为60 h。
2.4.6 吐温-80添加量对菌株FM-3产锰氧化酶的影响
在最适产酶培养基中加入一定量的吐温-80,3%接种量接入种子液,30℃、150 r/min振荡培养72 h,取样测定酶活力,结果见图9。
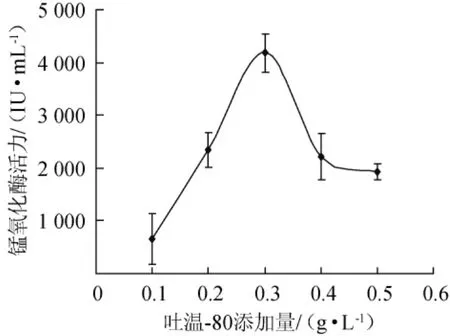
图9 吐温-80添加量对菌株产锰氧化酶的影响Fig.9 Effect of Tween-80 addition on the manganese oxidase
有文献报道[23],添加一定浓度的吐温-80可以促进菌株合成锰氧化酶。由图9可知,菌株FM-3产锰氧化酶的产量随着诱导物吐温-80的增加呈先增后降的趋势;当吐温-80的添加量为0.1~0.3g/L时,锰氧化酶活力随吐温-80的添加量增大而提高;当吐温-80的添加量为0.3 g/L时,菌株锰氧化酶的活力达到最大值,为4 179.58 IU/mL;当吐温-80的添加量>0.3 g/L之后,锰氧化酶活力随之下降。BAR-LEVS S等[24]研究表明吐温-80能提高细胞膜的渗透性,解除已合成的锰氧化酶在细胞内对酶基因的转录或mRNA翻译的阻碍,有利于酶的分泌。因此,最适的吐温-80添加量为0.3 g/L。
2.5 菌株FM-3产酶发酵条件优化正交试验结果
根据单因素试验结果,选择4因素3水平对菌株FM-3产锰氧化酶发酵条件进行优化,正交试验结果与分析见表3。
由表3可知,各因素对菌株产锰氧化酶的影响主次为:C>B>A>D,即吐温-80添加量>蛋白胨添加量>甘油添加量>培养时间。得到最佳的发酵工艺为A2B1C2D3,即甘油添加量为0.8 g/L,蛋白胨添加量为0.15 g/L,吐温-80添加量为0.2 g/L,3℃、150 r/min振荡培养72 h。此最佳发酵条件下,锰氧化酶活性可达2 977.44 IU/mL。

表3 发酵条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal tests for fermentation conditions optimization
2.6 菌株FM-3产锰氧化酶的酶学特性研究
2.6.1 温度对锰氧化酶活力的影响
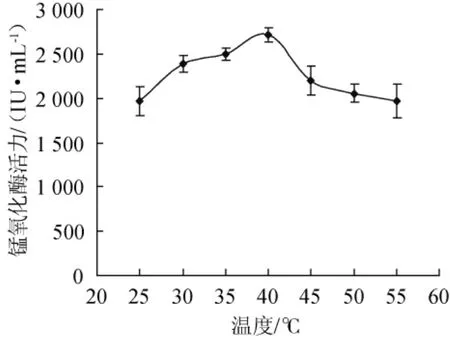
图10 温度对菌株FM-3产锰氧化酶的影响Fig.10 Effect of temperature on manganese oxidase produced by strain FM-3
由图10可知,菌株FM-3产锰氧化酶的酶活随着温度的升高呈先增后降的趋势,温度对锰氧化酶活性影响不大,在试验温度(25~55℃)条件下保温30 min,锰氧化酶的活性仍保持在1 950.00 IU/mL以上,其最适温度为40℃,当锰氧化酶在温度40℃条件下保温30 min后,其锰氧化酶活性可达2 710.08 IU/mL。
2.6.2 pH对锰氧化酶活力的影响
由图11可知,菌株FM-3的锰氧化酶活性随pH的升高呈先升后降的趋势,锰氧化酶的稳定pH范围为6.5~8.0,最适pH值为7.0,锰氧化酶在pH 7.0条件下放置30 min后,其锰氧化酶活性可达2 514.80 IU/mL。

图11 pH对菌株FM-3产锰氧化酶的影响Fig.11 Effect of pH on manganese oxidase produced by strain FM-3
2.6.3 金属离子对锰氧化酶活力的影响
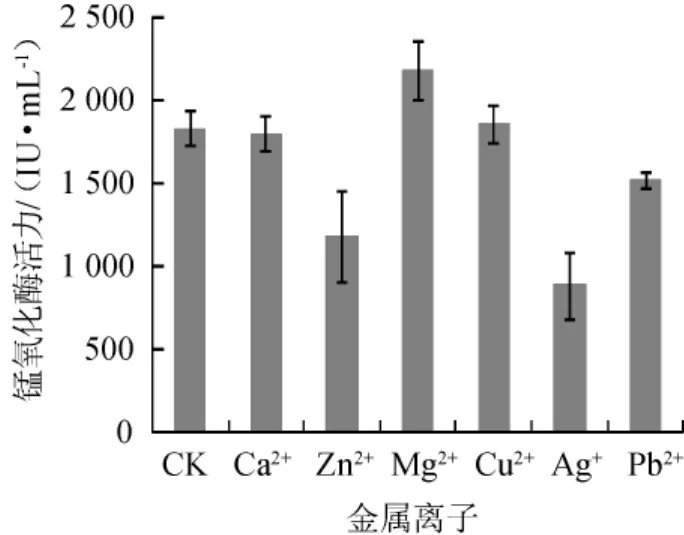
图12 金属离子对菌株FM-3产锰氧化酶的影响Fig.12 Effect of metal ions on manganese oxidase produced by strain FM-3
由图12可知,不同金属离子对菌株产锰氧化酶的活性影响各不相同,与未加金属离子的上清液(CK)相比,添加一定量的Mg2+对锰氧化酶活性有增强作用,Ca2+、Cu2+对锰氧化酶影响不大,Pb2+、Zn2+、Ag+对锰氧化酶具有一定的抑制作用。
3 结论
通过富集、平板稀释及摇瓶复筛从污水中筛选到一株具有较高锰氧化酶活性的菌株FM-3,对菌株进行了形态观察及16S rRNA序列遗传分析,将该菌株鉴定为鞘细菌属的纤发菌,命名为纤发菌(Leptothrix)FM-3;该菌株的最适产酶条件为甘油添加量0.8 g/L,蛋白胨添加量为0.15 g/L,吐温-80添加量为0.2 g/L,30 ℃、150 r/min振荡培养72 h,此时发酵液的锰氧化酶活性可达2 977.44 IU/mL。对菌株所产锰氧化酶酶学活性进行研究,发现该酶的最适温度和pH分别为40℃和7.0,添加一定量的Mg2+对锰氧化酶活性有增强作用,Ca2+、Cu2+对锰氧化酶影响不大,Pb2+、Zn2+、Ag+对锰氧化酶具有一定的抑制作用。对菌株FM-3的鉴定及研究菌株锰氧化酶的活性研究,对菌株今后在治理污水和给排水工程中的应用奠定了一定的基础,而对菌株产锰氧化酶的酶学特性研究为该酶的分离纯化及应用具有一定的指导意义。
[1]李圭白,刘 超.地下水除铁除锰[M].北京:中国建筑工业出版社,1989:40-44.
[2]张 杰,李 冬,陈立学,等.地下水除铁除锰机理与技术的变革[J].自然科学进展,2005,15(4):433-438.
[3]KÄMPFER P.Physiological and chemotaxonomic characterization of filamentousbacteriabelongingtothegenusHaliscomenobacter[J].Syst Appl Microbiol,1995,18(3):363-367.
[4]全桂静,吴财富.鞘细菌处理生活污水效果的研究[J].辽宁化工,2009,38(5):311-314.
[5]凌薇薇,吴晓芙,陈永华,等.除锰微生物的筛选及其除锰特性研究[J].中南林业科技大学学报,2011,31(6):152-156.
[6]马伟楼,尹春华,钟广蓉.生物法除锰技术研究综述[J].河北农业科学,2010,14(2):74-78.
[7]杨 宏,钟 洁,纪 娟,等.Mn(II)氧化细菌的微生物学研究进展[J].应用于环境生物学报,2008,14(1):143-146.
[8]刘颜军,周静晓,王革娇.锰氧化菌Bacillussp.MK3-1的Mn(Ⅱ)氧化特性和除锰能力研究[J].微生物学通报,2009,36(4):473-478.
[9]DUCKWORTH O W,SPOSITO G.Siderophore-manganese(III)in teractions II.manganite dissolution promoted by desferrioxamine B[J].Environ Sci Technol,2005,39(16):6045-6051.
[10]TEBO B M,JOHNSON H A,MCCARTHY J K,et al.Geomicrobi-ology of manganese(Ⅱ)oxidation[J].Trend Microbiol,2005,13(9):421-428.
[11]邱并生.锰氧化细菌[J].微生物学通报,2011,38(5):786.
[12]RAJASABAPATHYR,MOHANDASSC,DASTAGERSG,etal.Citreicella manganoxidanssp.nov.,a novel manganese manganese oxidizing bacteriumisolatedfromashallowwaterhydrothermalventinEspalamaca(Azores)[J].Anton Van Leeuw,2015,108(6):1433-1439.
[13]晏 平,姜理英,陈建孟,等.锰氧化菌Aminobactersp.H1的分离鉴定及其锰氧化机制研究[J].环境科学,2014,35(4):1428-1436.
[14]东秀株,蔡秒英.常见细菌系统鉴定手册[M].第一版.北京:科学出版社,2001:349-398.
[15]R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:157-167.
[16]董安国,高 琳,赵建邦,等.基于DNA序列的系统进化树构建[J].西北农林科技大学学报:自然科学版,2008,36(10):221-226.
[17]陈正福,徐丽华,姜成林,等.构建微生物分子分类系统进化树的快速运算法与数据结构[J].微生物学通报,1997,24(1):22-26.
[18]BEOLCHINI F,PAGNANELLI F,TORO L,et al.Ionic strength effect on copper biosorption bySpharrotilus natans:equilibrium study and dynamic modeling in membrane reactor[J].Water Res,2006,40(1):144-152.
[19]佘晨兴,许旭萍,李惠珍.鞘细菌生态学及其在环保上的应用[J].福建轻纺,2003,175(12):6-7.
[20]American Public Health Association.Ameican Water Works Association.The Water Pollution Control Federation.水和废水标准检验法[M].宋仁元,张亚杰,译.北京:中国建筑工业出版社,1985:193-196.
[21]国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,2002:368-370.
[22]翁酥颖,柯嘉康,戚蓓静,等.球衣细菌(Sphaerotilus)的研究——球衣细菌的纯种分离、鉴定和保存[J].上海师范大学学报:自然科学版,1980(3):77-85.
[23]余 梅,阮小文,谭丽泉,等.白腐真菌产锰过氧化物酶的研究[J].化学与生物工程,2014,31(11):40-45.
[24]BAR-LEV S S,KIRK T K.Effects of molecular oxygen on lignin degradation byP.chrysosportum[J].Biochem Bioph Res Commoun,1981,99:373-378.
Isolation and identification of manganese-oxidase-producing Sheath bacteria and the enzymatic characterization
DENG Jiacong,WANG Shiyao,JIANG Susu,ZHENG Hong*
(School of Ocean and Biochemical Engineering,Fuqing Branch of Fujian Normal University,Fuqing 350300,China)
A strain of Sheath bacterium which produces manganese oxidase,was isolated and screened from activated sludge and the enzymatic characteristics were studied.The manganese-oxidase-producing strains were isolated from soil by the enrichment culture medium,CGY plate and shake flask culture.One strain was identified according to morphological features,physiological and biochemical analysis as well as 16S rRNA gene sequence analysis.And the fermentation conditions for producing manganese-oxidase and enzymatic characteristics were studied.The results shown that a bacterium FM-3 with high activity of manganese-oxidase was isolated.The strain was identified asLeptothrixFM-3.The optimal fermentation conditions for manganese-oxidase production were glycerol 0.8%,peptone 0.15 g/L,Tween-80 0.2%,at 30℃150 r/min oscillation for 72 h.Under these conditions,the activity of manganese oxidase fermentation liquid up to 2 977.44 IU/ml.The optimum temperature and pH value of manganeseoxidase were 40℃and 7.0,respectively.Mg2+could activate the manganese-oxidase,but Ca2+,Cu2+had little impact.While Pb2+,Zn2+and Ag+had only modest inhibitory effect.
Leptothrix;manganese-oxidase;isolation and screening;identification;enzymatic characteristics
X172
0254-5071(2017)10-0097-07
10.11882/j.issn.0254-5071.2017.10.021
2017-07-07
福建省自然科学基金项目(2015J01132);福建省教育厅中青年教师项目(JA15569)
邓加聪(1981-),男,副教授,博士研究生,研究方向为微生物菌株筛选及发酵。
*通讯作者:郑 虹(1981-),女,高级实验师,硕士,研究方向为微生物菌株筛选及发酵。
