响应面法优化杏鲍菇曲制曲条件
2017-11-17李慧星王冬梅
许 彬,李慧星,李 斌,王冬梅
(南阳理工学院 生物与化学工程学院,河南 南阳 473004)
响应面法优化杏鲍菇曲制曲条件
许 彬,李慧星,李 斌,王冬梅
(南阳理工学院 生物与化学工程学院,河南 南阳 473004)
该研究以米曲霉为菌种制备杏鲍菇曲,以蛋白酶活力、CMC酶活力、β-葡萄糖苷酶活力为指标,通过单因素和响应面试验优化杏鲍菇制曲工艺条件,并比较了杏鲍菇是否制曲对杏鲍菇黄豆酱的氨基酸态氮含量和·OH清除率的影响。结果表明,杏鲍菇曲的最佳制曲条件为杏鲍菇含水量60%,拌入干燥杏鲍菇质量分数10%的面粉,接种后铺成单层,在温度30℃的恒温培养箱中培养5 d。在该条件下杏鲍菇曲的平均蛋白酶活力为698.7 U/g、CMC酶活力为98.4 U/g、β-葡萄糖苷酶活力为1 791.4 U/g。所得杏鲍菇曲曲层呈棕绿色、孢子分布均匀。杏鲍菇经米曲霉制曲后与黄豆曲共同发酵成杏鲍菇黄豆酱,可以显著提高酱的氨基酸态氮含量和·OH清除率,使其分别达到6.84 mg/g和75.4%。
杏鲍菇曲;制曲条件;酶活力
杏鲍菇属于草腐食用菌,其菇肉肥厚、脆嫩可口,具有杏仁的香味,又兼有鲍鱼的风味和口感,深受消费者欢迎[1-3]。其子实体营养丰富,每100 g鲜菇中含蛋白质1.3 g,占其干物质的12.5%;含碳水化合物8.3 g,占其干物质的79.8%;还含有多种维生素和矿物质元素[4]。杏鲍菇是一种具有药用保健功能的真菌,有降低胆固醇、抗氧化、抗动脉粥样硬化的功能[5-7]。杏鲍菇加工制品形式多样,将杏鲍菇接种米曲霉后制曲,所得杏鲍菇曲可用来酿制酱油[8]。菇曲中米曲霉分泌的纤维素酶、β-葡萄糖苷酶、蛋白酶可以分解杏鲍菇的细胞组织结构,促进胞内活性成分在发酵过程中的释放,促进糖苷分解释放活性苷元,促进蛋白质分解为游离氨基酸[9-12]。
杏鲍菇曲也可以单独或与黄豆曲共同发酵,酿制杏鲍菇黄豆酱。杏鲍菇曲的酶活力决定了酿造酱的发酵进程以及产品的营养价值和保健价值。本研究考察制曲条件对杏鲍菇曲蛋白酶活力、羧甲基纤维素(carboxymethyl cellulose,CMC)酶活力、β-葡萄糖苷酶活力的影响,采用响应曲面法优化制曲工艺,以期为开发发酵型杏鲍菇黄豆酱提供帮助。
1 材料与方法
1.1 材料与试剂
黄豆曲:南阳市淅川县香花镇振翼调味品有限公司;杏鲍菇、食盐、面粉:市售;米曲霉(沪酿3.042)曲精:山东长态生物科技有限公司。
葡萄糖、磷酸氢二钠、无水碳酸钠、三氯乙酸,氢氧化钠、磷酸氢二钠、磷酸二氢钠、盐酸、酒石酸钾钠、羧甲基纤维素钠、硫酸亚铁、水杨酸、过氧化氢(均为分析纯):天津市德恩化学试剂有限公司。福林酚、L-酪氨酸、酪蛋白、水杨苷:合肥博美生物科技有限公司。
1.2 仪器与设备
721可见光分光光度计:上海箐华科技仪器有限公司;FA1004型电子天平:上海良平仪器仪表有限公司;CQ50电热恒温水浴锅:巩义市予华仪器有限责任公司;PHS-3C pH计:上海安亭雷磁仪器厂;101-2A型电热鼓风干燥箱:天津市泰斯特仪器有限公司;95-2双向恒温磁力搅拌器:西安明克斯检测设备有限公司;TDL-40B台式离心机:上海安亭科学仪器厂制造;LDZX-50FB立式压力蒸汽灭菌器:上海申安医疗器械厂;MJ-300—II霉菌培养箱:上海跃进医疗器械有限公司。
1.3 方法
1.3.1 制曲方法
将杏鲍菇切成5mm左右的颗粒,干燥至质量恒定后调节含水量,装于封闭容器(组培瓶)中,在115℃条件下灭菌10 min,按杏鲍菇干质量的0.4%接种米曲霉曲精,搅拌均匀,使物料在组培瓶底均匀分布。将组培瓶放置在相对湿度80%、一定温度的恒温霉菌培养箱中培养一定时间。
1.3.2 单因素试验
以菇曲的蛋白酶活力、CMC酶活力和β-纤维素酶活力为指标,分别研究料层厚度(单层、双层)、是否添加面粉(0,10%)、杏鲍菇含水量(50%、55%、60%、65%)、培养温度(25℃、28℃、31℃和34℃)、培养时间(3 d、4 d、5 d和6 d)对菇曲酶活力的影响。
1.3.3 响应面试验
在单因素试验的基础上,采用Box-Benhnken设计安排制曲条件优化试验,选择菇含水量(X1)、培养温度(X2)、培养时间(X3)3个因素为自变量,蛋白酶(Y1)、CMC酶(Y2)、β-葡萄糖苷酶(Y3)酶活力为响应值。设计3因素3水平共15个试验点的响应面试验。
1.3.4 杏鲍菇黄豆酱的制作
将黄豆成曲与杏鲍菇曲或杏鲍菇按100∶30(W/W)混合,添加复合基质质量90%的16%的盐水,置于46℃的恒温水浴锅中发酵,每3 d翻酱一次,发酵10 d[13]。另外按上述发酵工艺制备不添加杏鲍菇的纯黄豆酱。每种处理重复3次试验,测定酱的氨基酸态氮和羟自由基(·OH)清除率。
1.3.5 测定方法
采用Folin-酚法测定杏鲍菇曲的蛋白酶活力[14],在40℃条件下水解酪蛋白,每1g菇曲每1 min水解酪蛋白产生1 μg酪氨酸定义为1个蛋白酶活力单位(U/g)。
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法以羧甲基纤维素钠(carboxymethylcellulosesodium,CMC-Na)为底物测定CMC酶活力[14],在50℃条件下水解,每1g菇曲每1min水解CMC-Na产生1 μg葡萄糖定义为1个CMC酶活力单位(U/g)。
采用3,5-二硝基水杨酸(DNS)比色法以水杨苷为底物β-葡萄糖苷酶活力[15],在50℃条件下水解,每1 g菇曲每1 min水解水杨苷产生1 μg葡萄糖定义为1个β-葡萄糖苷酶活力单位(U/g)。
采用甲醛滴定法测定酱的氨基酸态氮[14],利用Fenton反应测定·OH清除率[16]。
2 结果与分析
2.1 杏鲍菇曲制曲的单因素试验
2.1.1 料层厚度的影响
不同料层厚度的杏鲍菇基质制曲后,菇曲的蛋白酶活力、CMC酶活力和β-葡萄糖苷酶活力变化如图1所示。

图1 料层厚度对酶活力的影响Fig.1 Effect of material layer thickness on enzyme activity
由图1可知,单层基质所培养的杏鲍菇曲的蛋白酶酶活力和β-葡萄糖苷酶活力分别为555 U/g、1 148 U/g,远高于双层基质的蛋白酶酶活力(249 U/g)和β-葡萄糖苷酶活力(481U/g);单层基质的CMC酶活力为96.3U/g,略高于双层基质(79.5 U/g)。这是由于米曲霉是一种好氧型微生物,当氧气不足时,生长受到抑制。单层培养时,基料与空气接触面积大,氧气分布均匀,易于利用曲层中菌丝的生长,并利于孢子形成;料层厚度过厚会使空气流通不畅,从而引起散热不良[13],曲层中心和下层的菌丝生长受限,且不利于孢子生长。另外,本试验中杏鲍菇颗粒较小,经过蒸煮处理的杏鲍菇硬度降低,所以堆积成料层孔隙率小,自然状态下通风较差。因此杏鲍菇制曲的适宜选用单料层。
2.1.2 面粉的影响
按杏鲍菇干质量的10%添加面粉,接种制曲,并与未添加面粉的杏鲍菇曲进行比较。菇曲的蛋白酶活力、CMC酶活力和β-葡萄糖苷酶活力变化如图2所示。
由图2可知,加面粉时杏鲍菇成曲中蛋白酶活力和β-葡萄糖苷酶酶活力明显比不加面粉时酶活力大,CMC酶活力略有增加。其中,面粉对菇曲蛋白酶活力的影响与刘云珍等[17]报道一致。米曲霉能分泌淀粉酶,面粉中淀粉相对于杏鲍菇中的碳水化合物更易被米曲霉分解利用,更易为菌丝生长和产酶提供营养[18]。因此,添加面粉后杏鲍菇制曲更致密,孢子在曲层分布均匀,菇曲具有较高的酶活力。

图2 添加面粉对酶活力的影响Fig.2 Effect of wheat flour addition on enzyme activity
2.1.3 杏鲍菇含水量的影响
不同含水量的杏鲍菇基质制曲后,曲料的蛋白酶、CMC酶和β-葡萄糖苷酶活力变化如图3所示。

图3 杏鲍菇含水量对酶活力的影响Fig.3 Effect ofPleurotus eryngiimoisture content on enzyme activity
由图3可知,随着杏鲍菇基料含水量的增加,杏鲍菇曲的各种酶活力不断增加,当杏鲍菇基料含水量达到60%时,酶活力达到最大值;基料含水量继续增加会导致酶活力下降。基料含有适当的水分,是加速米曲霉萌发、生长的主要条件之一。在适当的水分含量下,细胞内物质为水所溶解,为米曲霉生长提供了供给养料的条件。但水分过高时,空气不易向料层中渗透,菌丝淹没在培养基中,因厌氧而不利于米曲霉的生长和酶的分泌,且容易导致培养基质上杂菌繁殖消耗基料营养,从而使曲料酶活力降低。真菌的细胞壁对水分具有可渗透性,水分过低时细胞容易发生失水死亡[19]。因此选择杏鲍菇含水量为55%、60%、65%进行后续试验。
2.1.4 培养温度的影响
在不同培养温度下制曲,菇曲的蛋白酶活力、CMC酶活力和β-葡萄糖苷酶活力变化如图4所示。
由图4可知,培养温度在28℃以下时,随着发酵温度的增加,蛋白酶活力和β-葡萄糖苷酶活力都有一定增加,但培养温度超过30℃时,酶活力会显著下降,这与刘云珍等[17]的报道相一致。CMC酶活力随温度升高而略有增加,最大为97.2 U/g(31℃),温度升高至34℃时,酶活力降低至72.6 U/g,相对于其他两种酶,CMC酶活力变化趋势不明显。温度在适当范围内升高时,可以促进培养基质内小分子物质的扩散运动,有利于加速生化反应,促进米曲霉的生长;但当温度过高时,参与米曲霉代谢培养基质的酶的活性受到抑制,从而使米曲霉的生长受到限制,菌丝稀疏,酶的分泌受到影响,导致菇曲的蛋白酶活力和β-葡萄糖苷酶活力显著下降。由于米曲霉在杏鲍菇基质上所产CMC酶的活力相对较低,在试验所考察温度范围内,CMC酶活力变化并不明显。因此选择培养温度为28℃、31℃、34℃进行后续试验。

图4 培养温度对酶活力的影响Fig.4 Effect of culture temperature on enzyme activity
2.1.5 培养时间的影响
在不同培养时间下制曲,菇曲的蛋白酶活力、CMC酶活力和β-葡萄糖苷酶活力变化如图5所示。
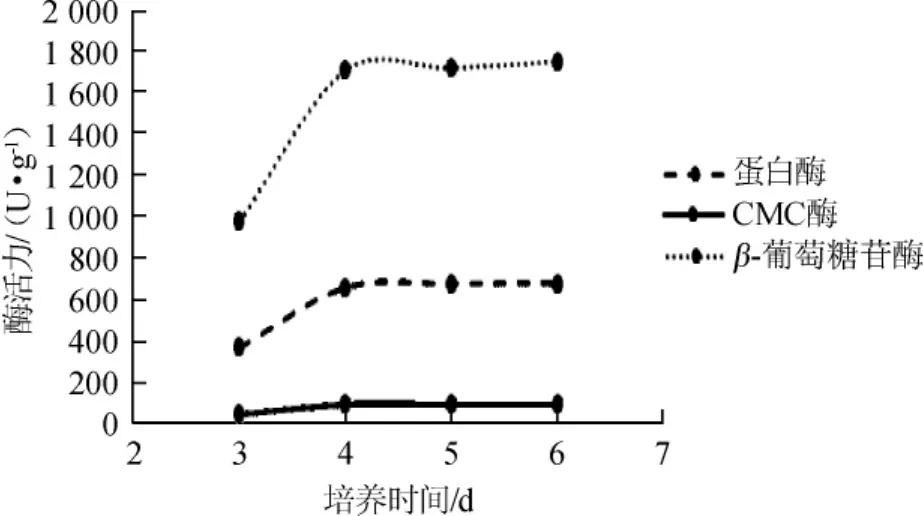
图5 培养时间对酶活力的影响Fig.5 Effect of culture time on enzyme activity
由图5可知,在试验考察范围内随着培养时间的延长,菇曲的酶活力是呈先增加后趋平缓的变化趋势。杏鲍菇的成分与黄豆有很大区别,杏鲍菇的蛋白质含量远远低于黄豆,且所含碳水化合物以纤维素、几丁质等非淀粉成分为主[3],在一定的培养条件下,米曲霉在杏鲍菇基质上的生长及产孢子速度比较缓慢,因此菇曲酶活力需要培养4 d才能达到最大值。随着培养时间的延长,到培养6 d时酶活力没有显著降低。因此选择培养时间为4 d、5 d、6 d进行后续试验。
2.2 响应面试验
Box-Benhnken试验水平编码及结果如表1所示。

表1 Box-Benhnken试验设计及结果Table 1 Design and results of Box-Benhnken experiments
利用minitab软件对表1数据进行二次多项回归拟合,获得杏鲍菇曲蛋白酶活力(Y1)、CMC酶活力(Y2)、β-葡萄糖苷酶活力(Y3)对菇含水量、培养温度及培养时间的二次多项回归方程:对各回归模型进行方差分析,各模型中变异来源项的显著性如表2所示。

Y1模型极显著(P=0.005<0.01),失拟项不显著(P=0.100>0.05),模型的调整决定系数R2=89.03%,表明此模型能解释89.03%的蛋白酶活力(Y1)响应值变化;Y2模型极显著(P=0.009<0.01),失拟项不显著(P=0.183>0.05),模型的调整决定系数R2=86.10%,表明此模型能解释86.10%的CMC酶活力(Y2)响应值变化;Y3模型极显著(P=0.001<0.01),失拟项不显著(P=0.217>0.05),模型的调整决定系数R2=94.97%,表明此模型能解释94.97%的β-葡萄糖苷酶活力(Y3)响应值变化。
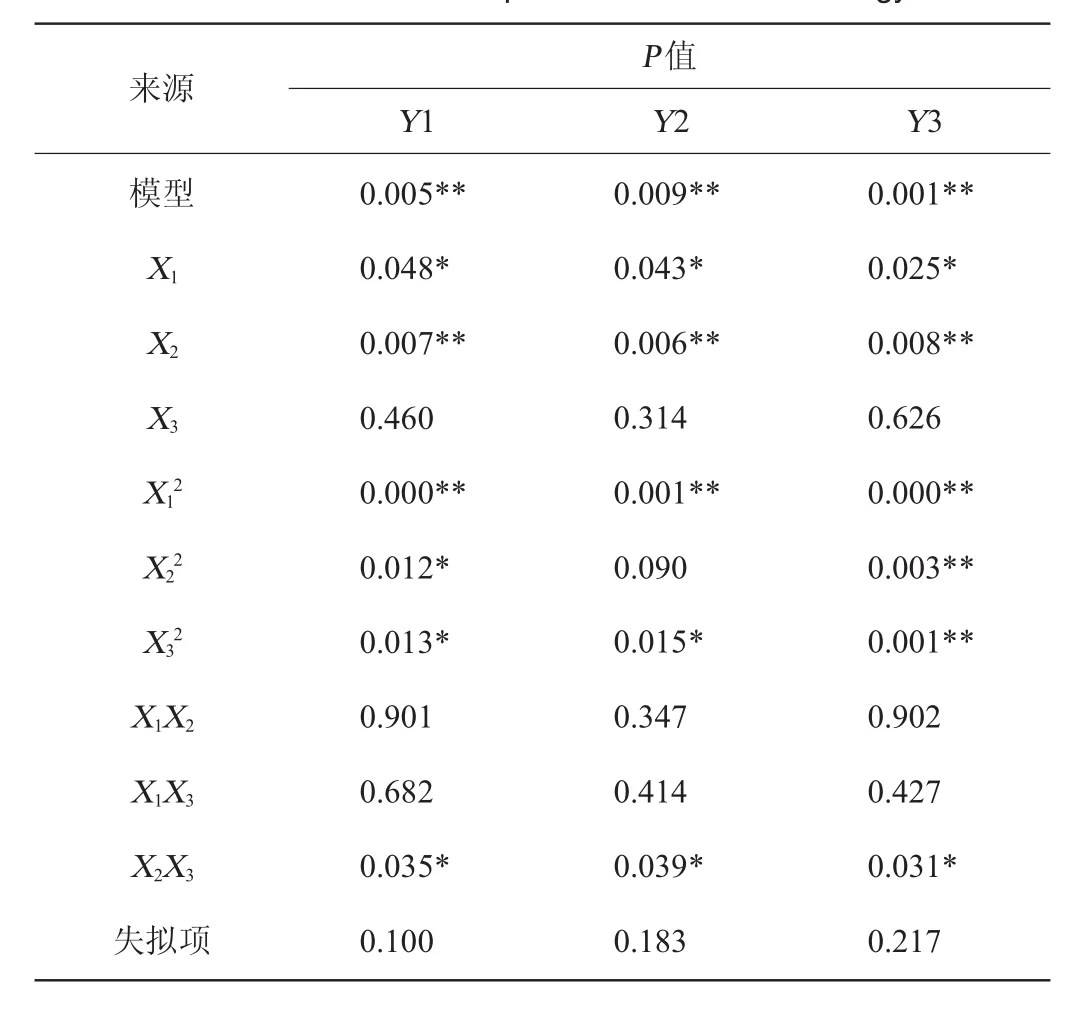
表2 响应面试验方差分析Table 2 ANOVA of response surface methodology
由表2可知,菇含水量和培养温度的交互作用(X1X2)以及菇含水量和培养时间的交互作用(X1X3)对3个模型的影响均不显著,剔除后重新回归得到方程如下:

培养温度和培养时间的交互作用(X2X3)对蛋白酶活力、CMC酶活力和β-葡萄糖苷酶活力的响应曲面图(X1=0)如图6所示。
由图6可知,培养温度和培养时间的交互作用对菇曲的3种酶活力影响相近。在试验范围内,响应曲面存在最高点,培养时间一定时,培养温度增加会引起菇曲酶活力的先增加后降低;培养温度一定时,培养时间变化也会导致菇曲酶活力发生同样趋势的变化。培养温度和培养时间都接近试验范围中心点时,才能获得最大的菇曲酶活力。
采用minitab的响应优化器对三个模型进行寻优分析,得到最优制曲条件为X1=-0.090 9,X2=-0.494 9,X3=0.090 9,即菇含水量60%、培养温度30℃、培养时间的5 d。在该条件下菇曲的预测蛋白酶活力可达696.6 U/g、CMC酶活力可达98.5 U/g、β-葡萄糖苷酶活力可达1 786.4 U/g。经3次试验验证,该条件下杏鲍菇的实际平均蛋白酶活力为698.7 U/g、CMC酶活力为98.4 U/g、β-葡萄糖苷酶活力为1 791.4 U/g。
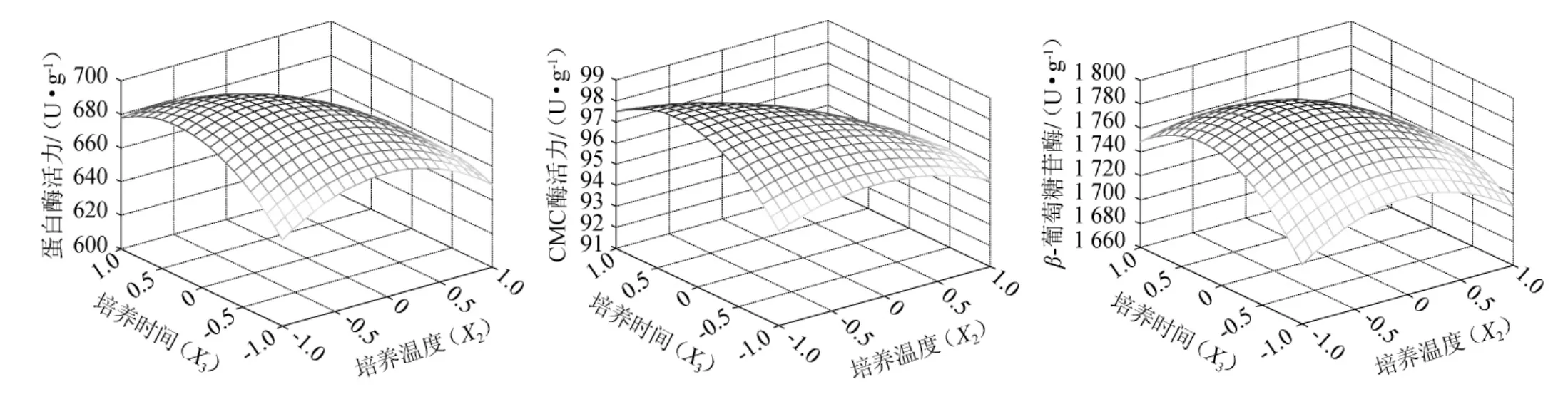
图6 培养温度和培养时间交互作用对蛋白酶活力、CMC酶活力和β-葡萄糖苷酶活力影响的响应曲面Fig.6 Response surface plots and contour line of effects of interaction between culture temperature and time on protease carboxymethyl cellulase and β-glucosaccharase activity
2.3 不同杏鲍菇黄豆酱的对比
将未制曲杏鲍菇和杏鲍菇曲分别与黄豆曲共同发酵,得到两种杏鲍菇黄豆酱,同时制备不添加杏鲍菇的纯黄豆酱,测定3种酱的氨基酸态氮含量和·OH清除率,结果如表3所示。

表3 不同黄豆酱指标的对比Table 3 Indexes comparison of different soybean paste
由表3可知,添加杏鲍菇的两种黄豆酱与纯黄豆酱相比较,在氨基酸态氮和·OH清除率两个指标上差异均达到极显著(P<0.01)。相对于纯黄豆酱,添加未制曲杏鲍菇发酵的黄豆酱,其氨基酸态氮含量有所降低,但·OH清除率显著提高。这可能是由于在发酵过程中,豆曲酶类和发酵体系中的微生物对杏鲍菇成分有一定的分解作用,能促进抗氧化活性成分的产生和释放。但由于杏鲍菇中氨基酸含量本身低于黄豆的氨基酸含量,且蛋白质分解有限,所以添加未制曲杏鲍菇的黄豆酱的氨基酸态氮含量较低。而添加杏鲍菇曲发酵的黄豆酱,由于制曲时菇曲酶的分解作用,杏鲍菇细胞内蛋白质更易被释放、蛋白酶分解产生的游离氨基酸更多,加上发酵过程中菇曲蛋白酶对黄豆蛋白质的分解作用,大大提高了酱中游离氨基酸的含量,达到6.84 mg/g。另外在制曲时,由于米曲霉中纤维素酶对杏鲍菇细胞壁的分解作用,促进了细胞内抗氧化活性成分的释放,所以添加杏鲍菇曲发酵的黄豆酱的·OH清除率也显著增加,达到75.4%。
3 结论
以杏鲍菇为基质,接种米曲霉制成杏鲍菇曲,菇曲的蛋白酶活力、CMC酶活力、β-葡萄糖苷酶活力受到制曲条件的影响。制曲时宜采用单层曲层,添加面粉有利于提高菇曲酶活力。杏鲍菇干燥至质量恒定后调节含水量至60%,经灭菌、接种后在温度30℃的恒温培养箱中制曲5d。该最佳条件下所得杏鲍菇曲的实际平均蛋白酶活力为698.7 U/g、CMC酶活力为98.4 U/g、β-葡萄糖苷酶活力为1 791.4 U/g。所得杏鲍菇曲曲层呈绿色、孢子分布均匀。
杏鲍菇经米曲霉制曲后与黄豆曲共同发酵制备发酵型杏鲍菇黄豆酱,借助米曲霉在菇基质上代谢产生的多种分解酶,可以显著提高酱的氨基酸态氮含量和·OH清除率,使其分别达到6.84 mg/g和75.4%。
[1]古晓珍,程 宇.南阳发展草腐菌产业的几点思考[J].农村·农业·农民,2013(3):42-43.
[2]李晓贝,杨 焱,周 峰,等.杏鲍菇子实体及其下脚料的营养成分和呈味物质研究[J].现代食品科技,2015,31(6):272-278.
[3]巩晋龙.杏鲍菇(Pleurotus eryngii)冷藏保鲜技术及自溶机理研究[D].福州:福建农林大学,2013.
[4]胡清秀,吉叶梅,侯桂森,等.杏鲍菇栽培[M].北京:中国农业科学技术出版社,2006:3.
[5]史亚丽,杨立红,蔡德华,等.杏鲍菇多糖对力竭小鼠抗氧化、抗损伤的作用[J].体育学刊,2005,12(1):56-58.
[6]DUHOST N J,OU B,BEELMAN R B.Quantification of polyphenols and ergothioneine in cultivated mushrooms and correlation to total antioxidant capacity[J].Food Chem,2007,105(2):727-735.
[7]MORI K,KOBAYASHI C,TOMITA T,et al.Autiatherosclerotic effect of the edible mushroomsPleurotus eryragii(Eringi),Grif olafrondosa(Maitake),andHypsizygus marmoreus(Bunashimeji)in apolipoproteiu E-deficient mice[J].Nutr Res,2008,28(5):335-342.
[8]邴芳玲.食用菌中鲜味物质味感相互作用的研究[D].上海:上海应用技术大学,2016.
[9]潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-807.
[10]武金霞,常淑英,孙 鹏,等.米曲霉(Aspergillus oryzae)沪酿3.042内切型纤维素酶的分离纯化与鉴定[J].河北大学学报:自然科学版,2012,32(1):68-74.
[11]张建华.曲霉型豆豉发酵机理及其功能性的研究[D].北京:中国农业大学,2003.
[12]冷云伟.酱油曲中米曲霉及制曲工艺的研究[D].无锡:江南大学,2004.
[13]葛向阳,田焕章,梁运祥.酿造学[M].北京:高等教育出版社,2005:14-18.
[14]潘平平.曲霉型豆豉多菌种制曲及豉曲酶活性调控的研究[D].广州:仲恺农业工程学院,2015.
[15]朱凤妹,杜 彬,李 军,等.响应面法优化米曲霉3.481产β-葡萄糖苷酶发酵工艺的研究[J].中国食品学报,2009,9(5):35-42.
[16]赵晓娟,吴 均,陈佳昕,等.苦荞纳豆酱的抗氧化活性[J].食品科学,2014,35(13):122-126.
[17]刘云珍,许喜林,刘永琪,等.豆瓣酱制曲工艺条件优化[J].中国酿造,2016,35(11):108-111.
[18]李志江,戴凌燕,王 欣,等.米曲霉和黑曲霉双菌种制曲对豆酱酶系影响的研究[J].农产品加工·创新版,2010(10):51-54.
[19]叶海梅,郑 毅,石 磊,等.米曲霉FZ58固体发酵β-葡萄糖苷酶条件优化及酶学特性研究[J].福建轻纺,2008(1):1-6.
Optimization of koji-making conditions ofPleurotus eryngiiusing response suface methodology
XU Bin,LI Huixing,LI Bin,WANG Dongmei
(College of Biology and Chemical Engineering,Nanyang Institute of Technology,Nanyang 473004,China)
ThePleurotus eryngiikoji-making conditions withAspergillus oryzaewas studied.Using protease,carboxymethyl cellulase and β-glucosidase activity as the indicator,the koji-making condition was optimized through single factor experiments and response surface methodology.Then the effect of with or withoutP.eryngiikoji-making process on the content of amino acid nitrogen and hydroxyl radical scavenging ability ofP.eryngiisoybean paste was tested.The results showed that the optimal conditions forP.eryngiikoji-making wereP.eryngiimoisture content 60%,wheat flour 10%of dryP.eryngii,monolayer in culture flask after inoculum,culture temperature 30℃,time 5 d.In these conditions,the protease,carboxymethyl cellulase and β-glucosidase activity were 698.7 U/g,98.4 U/g and 1 791.4 U/g,respectively.TheP.eryngiikoji was brownish-green with balance spore-distributing.AfterP.eryngiikoji-making byA.oryzae,P.eryngiisoybean paste was prepared,and results showed that the content of amino acid nitrogen and hydroxyl radical scavenging ability ofP.eryngii-soybean paste was enhanced,which was 6.84 mg/g and 75.4%,respectively.
Pleurotus eryngiikoji;koji-making conditions;enzyme activity
TS264.2
0254-5071(2017)10-0114-06
10.11882/j.issn.0254-5071.2017.10.024
2017-07-17
河南省高等学校重点科研项目(16A550017)
许 彬(1980-),女,讲师,硕士,研究方向为食品发酵技术。
