仿刺参成参体腔细胞酚氧化酶的生化与酶学特性研究
2021-07-21蒋经伟李石磊周遵春
肖 瑶,蒋经伟,李石磊,董 颖,周遵春
( 辽宁省海洋水产科学研究院,辽宁 大连 116023 )
酚氧化酶(PO)作为无脊椎动物先天性免疫系统中关键的免疫组分之一,其自身通常不具有杀菌或抑菌活性,但可以催化酚类底物生成醌类,醌类再经过一系列的非酶促反应最终生成黑色素[1]。醌类物质被报道具有杀菌和抑菌等作用,而黑色素也被发现具有凝集病原菌、修复损伤和介导吞噬等作用[2]。
酚氧化酶免疫功能的发挥与其自身的生化和酶学特性密切相关[3]。前期研究发现,用纯化后的酚氧化酶进行的生化及酶学特性研究,对了解酚氧化酶的免疫特性具有重要意义,酚氧化酶的分离纯化及生化特性研究在昆虫和甲壳类动物中已有广泛报道[4],在无脊椎动物体内,除血淋巴外,其他组织在常态下酚氧化酶不表达,而在应激状态下可迅速启动潜在的酚氧化酶表达和释放能力,从而增强机体的免疫和抵抗水平[5]。因此,了解酚氧化酶的生化和酶学特性对解析酚氧化酶的免疫功能具有重要意义。目前在悉尼岩牡蛎(Saccostreaglomerata)[2]、光棘球海胆(Strongylocentrotusnudus)[6]、阿根廷滑柔鱼(Illexargentinus)[7]、菲律宾蛤仔(Ruditapesphilippinarum)[8]、栉孔扇贝(Chlamysfarreri)[9]等海洋无脊椎动物中,相继开展了酚氧化酶的生化与酶学特性分析。在光棘球海胆和栉孔扇贝中,各发现了3种酚氧化酶,在悉尼岩牡蛎中发现了2种酚氧化酶[2,6-9]。
仿刺参(Apostichopusjaponicus)是棘皮动物门的典型代表生物,具有较高的经济价值,是我国海水增养殖的重要品种之一[5,10]。近年来,随着养殖规模的不断扩大,病害时有发生[11]。研究仿刺参的免疫和生理特性,对其病害防控具有重要意义。
已有的研究发现,仿刺参幼参体腔液中含有3种酚氧化酶[12],分别为AjPO1、AjPO2和AjPO3。这3种酚氧化酶的分子质量均小于21 ku,具有不同的生理、生化特性,并且承担不同的免疫功能。之后在仿刺参成参的体腔上清液和体腔细胞中发现了与幼参相同的AjPO2和AjPO3,同时在成参体腔细胞中又发现了3种新酚氧化酶,这3种酚氧化酶在仿刺参雌、雄个体间的分布存在差异,其中雌性个体的体腔细胞中3种酚氧化酶同时存在,而雄性个体的体腔细胞中仅有2种酚氧化酶存在[13]。目前仿刺参成参体腔细胞中酚氧化酶系统的具体生化特性和功能的相关研究尚未见报道。
笔者自仿刺参成参体腔细胞中分离纯化出4种酚氧化酶,对4种酚氧化酶的耐热性、最适pH、底物特异性、反应动力学参数、二价金属离子和抑制剂对酶活性的影响方面进行研究,为进一步查明仿刺参成参酚氧化酶系统的特性和功能机制、探索酚氧化酶系统在仿刺参中的免疫和生理功能提供基础支持。
1 材料与方法
1.1 试验动物
体质量(236±5) g仿刺参雌、雄各30头,在仿刺参产卵时,根据排精排卵来判断雌雄,并将雌、雄仿刺参分别于试验室暂养(水温15~18 ℃,pH 8.1~8.3,盐度31)7 d。样品均取自辽宁省海洋水产科学研究院海水养殖引育种中心。
1.2 体腔细胞破碎液的制备
用剪刀分别将雌、雄仿刺参从腹部划开,收集仿刺参体腔液,分别进行离心(4 ℃,6000 r/min,10 min),弃上清液,将雌、雄仿刺参的体腔细胞分别充分混匀后,加入磷酸缓冲液,经超声波破碎后再次进行离心(4 ℃,14 000 r/min,25 min),取体腔细胞破碎上清液,冻存于-80 ℃备用。
1.3 仿刺参酚氧化酶的分离纯化
采用邻苯二酚发色法结合线性连续梯度非变性电泳的方法来分离雌、雄仿刺参体腔细胞破碎液中的酚氧化酶[11]。在含量为6%~18%的线性连续梯度聚丙烯酰胺凝胶中电泳17 h(4 ℃,恒功率2 W),使用分子质量为480~1236 ku的非变性电泳Marker作为标准蛋白参考;电泳结束后,参考文献[6]分离光棘球海胆酚氧化酶的操作方法进行雌、雄仿刺参酚氧化酶的分离纯化。将纯化后的雌、雄仿刺参的酚氧化酶溶液,冻存于-80 ℃备用。
采用多巴络合物生成法[14]测定酚氧化酶活性,在490 nm波长下连续测定吸光度值(D490),D490每分钟增加0.001定义为1个酶活性单位(U)。将时间和测得吸光度值的线性规律绘制标准曲线得到公式(1),将不同条件下的吸光度值分别代入公式(1)即可得到不同条件下的酶活性。
y=kx+b
(1)
式中,x为时间,y为吸光度值,斜率k的绝对值即酶活性,b为截距。
1.4 pH和高温对酶活性的影响
用浓度15 mmol/L的左旋多巴溶于pH分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的缓冲液中,通过向1.5 mol/L的Tris溶液中滴加浓盐酸的方法来调节缓冲液的pH,100 μL纯化后的酚氧化酶溶液与2.0 mL不同pH的左旋多巴溶液混匀后,采用分光光度法在490 nm波长下测定吸光度值,分别代入标准曲线计算各组酚氧化酶活性。
将4种酚氧化酶分别在沸水中加热5、10、20、30 min,以20 mmol/L多巴胺为底物与加热后4种酚氧化酶混合,采用分光光度法在490 nm波长下测定吸光度值,分别代入标准曲线计算各组酚氧化酶活性。
开孔钢板连接件(perfobond strip connector,也称为PBL连接件)是1987年,德国学者Leonhardt在解决委内瑞拉的卡罗尼第三大桥组合结构剪力连接件的疲劳问题时提出的一种新型剪力连接件[2].PBL连接件是通过开孔钢板在混凝土板中形成的一系列混凝土榫、开孔钢板和贯穿钢筋共同承担剪力.
1.5 二价金属离子对酶活性的影响
选用Ca2+、Mg2+、Cu2+、Mn2+、Pb2+、Cd2+、Fe2+、Zn2+进行二价金属离子对酚氧化酶活性影响的试验,分别使用CaCl2、MgSO4、CuSO4、MnSO4、Pb(CH3COO)2、CdCl2、FeSO4、ZnSO4作为金属离子的来源,采用超纯水作为空白对照,参照文献[6]的方法操作。得到的混合物用分光光度法在490 nm波长下测定吸光度值,分别代入标准曲线计算各组酚氧化酶活性。
1.6 抑制剂对酶活性的影响
选取抗坏血酸、亚硫酸钠、柠檬酸、乙二胺四乙酸二钠、二乙基二硫代氨基甲酸钠作为酚氧化酶的抑制剂,超纯水作为空白对照,并参照文献[6]的试验方法操作。得到的混合物采用分光光度法,在490 nm波长下测定吸光度值, 分别代入标准曲线计算各组酚氧化酶活性。
1.7 底物特异性
选用邻苯二酚、左旋多巴、多巴胺、对苯二酚作为不同底物,对照组用等体积的Tris-HCl缓冲液(pH 7),参照文献[6]的试验方法操作,得到的混合物用分光光度法在490 nm波长下测定吸光度值,使用Lineweaver-Burk双倒数作图法计算各组酚氧化酶活性。
1.8 数据分析
试验数据使用SPSS 16.0软件进行单因素方差分析及Duncan多重比较,获得不同抑制剂对酶活性作用的差异性,P<0.05视为显著抑制,P<0.01视为极显著抑制,用Origin 7.5软件制图。
2 结 果
2.1 仿刺参酚氧化酶的分离纯化
非变性电泳后,经邻苯二酚发色,共发现4条酚氧化酶条带,均呈现褐色(图1a)。为区别于仿刺参幼参体内的3种酚氧化酶,将这4种酚氧化酶按分子质量由高到低分别命名为AjPO4、AjPO5、AjPO6、AjPO7,与右侧(图1b)Jiang等[13]的试验结果进行对比,可知AjPO5为本次试验发现的新酚氧化酶,这4种酚氧化酶的分子质量均大于Marker中标准蛋白分子质量为720 ku的条带,其中分子质量越小的条带迁移速率越快。

图1 雌雄仿刺参体腔细胞破碎液非变性电泳图Fig.1 Native-PAGE of coelomocyte lysate supernatant (CLS) in male and female sea cucumber A. japonicusa:1.非变性电泳标准蛋白; 2~4.雄性仿刺参电泳条带; 5~7.雌性仿刺参电泳条带; b:1.雄性仿刺参电泳条带; 2.雌性仿刺参电泳条带[12].a:1.protein marker for native-PAGE; 2—4.CLS stained with catechol in male sea cucumber A.japonicus; 5—7.CLS stained with catechol in female sea cucumber A. japonicus; b:1.CLS stained with catechol in sea cucumber male A. japonicus; 2.CLS stained with catechol in female sea cucumber A. japonicus[12].
2.2 pH和温度对酚氧化酶活性的影响
测定的pH为2.0~10.0,使用多巴胺作为底物,仿刺参中AjPO4和AjPO6在pH为9.0时具有最高活性,AjPO5和AjPO7在pH为8.0时具有最高活性;当pH高于9.0时,4种酚氧化酶的活性随pH的升高而降低(图2)。
仿刺参酚氧化酶的耐热性试验显示,AjPO4、AjPO5、AjPO6在沸水中的时长对酶活性基本无太大的影响,耐热性较好;AjPO7在沸水中的时长超过20 min时酶活性急剧下降,耐热能力较其他3种弱一些(图3)。
2.3 二价金属离子对酚氧化酶活性的影响
Mn2+和Fe2+对仿刺参4种酚氧化酶活性均有很强的激活作用,激活程度随金属离子浓度的增加而变化。当Mn2+浓度超过25 mmol/L时,AjPO4酶活性开始降低,Ca2+浓度达到20 mmol/L时,AjPO4酶活性开始降低并逐渐失活。在Mn2+和Fe2+的作用下,AjPO5酶活性随着金属离子浓度的增加而增加,Pb2+、Cu2+、Zn2+对AjPO5酶活性有小幅度的激活。除了Mn2+和Fe2+外,其他金属离子对AjPO6刺激作用并不明显。在Fe2+的作用下,AjPO7酶活性增强明显,当Fe2+浓度超过25 mmol/L时,AjPO7的酶活性开始下降,当Cd2+浓度超过15 mmol/L时,该酚氧化酶活性有小幅度增强(图4)。

图2 pH对仿刺参酚氧化酶活性的影响Fig.2 The effects of pH on the proteins with PO-like activities in sea cucumber A. japonicus
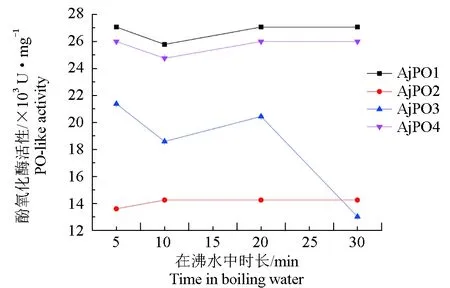
图3 仿刺参酚氧化酶的耐热性Fig.3 The effects of temperature on the proteins with PO-like activities in sea cucumber A. japonicus
2.4 抑制剂对酚氧化酶活性的影响
在仿刺参中,亚硫酸钠、抗坏血酸、二乙基二硫代氨基甲酸钠、柠檬酸对酚氧化酶均有一定的抑制作用,乙二胺四乙酸二钠对AjPO6和AjPO7有轻微抑制作用,对AjPO4、AjPO5无抑制作用。其中AjPO4、AjPO6和AjPO7受柠檬酸抑制最显著,AjPO7受二乙基二硫代氨基甲酸钠抑制较明显(图5)。亚硫酸钠对4种酚氧化酶活性均有一定的抑制作用。
2.5 酚氧化酶的底物特异性和动力学参数
使用Lineweaver-Burk双倒数作图法计算得出(图6),AjPO4对邻苯二酚、左旋多巴、多巴胺、对苯二酚的米氏常数Km分别为0.25、5.76、50.00、33.33 mmol/L;AjPO5对邻苯二酚、左旋多巴、多巴胺、对苯二酚的米氏常数Km分别为4.89、6.61、14.29、8.77 mmol/L;AjPO6对邻苯二酚、左旋多巴、多巴胺、对苯二酚的米氏常数Km分别为1.51、2.65、8.85、14.29 mmol/L;AjPO7对邻苯二酚、左旋多巴、多巴胺、对苯二酚的米氏常数Km分别为1.63、3.95、13.51、83.33 mmol/L。4种酚氧化酶的最适底物均为邻苯二酚。

图4 不同金属离子对AjPO4、AjPO5、AjPO6和AjPO7的影响Fig.4 The effects of different metal ions on the proteins with PO-like activities in sea cucumber A. japonicus

图5 不同抑制剂对仿刺参酚氧化酶活性的影响Fig.5 The effects of different inhibitors on the proteins with PO-like activities in sea cucumber A. japonicus*表示显著抑制(P<0.05),**表示极显著抑制(P<0.01).* represents significant inhibition(P<0.05); ** represents very significant inhibition(P<0.01).
3 讨 论
3.1 仿刺参体酚氧化酶的分离纯化
已有的研究发现,在仿刺参成参体腔细胞内存在3种不同于仿刺参幼参的酚氧化酶,其中雌性3种,雄性2种[12-13]。笔者在已有基础上又发现了1种新的酚氧化酶,这种酚氧化酶为雌、雄仿刺参共有,分子质量为1048~1236 ku,与仿刺参幼参体内酚氧化酶不同。发现的这4种成参特有的酚氧化酶的分子质量均在720~1236 ku,分别承担不同的生化特性和免疫反应特性。为确保试验结果准确性,经过多次的反复验证,80%情况下均可得到此酚氧化酶,由于这4种酚氧化酶在常温下极易失活,所以存在没有成功分离纯化的情况,且这4种酚氧化酶的含量较低,通过非变性电泳的方法分离可能会出现失败情况。
3.2 酚氧化酶的底物特异性
这4种酚氧化酶的分子质量在其他物种中已发现的酚氧化酶中属于分子质量较大的。自亚洲玉米螟(Ostriniafurnacalis)血淋巴中分离纯化出酚氧化酶,该酶在非变性电泳中显示其分子质量为158 ku[14];在大螯虾(Panulirusargus)[15]中,采用非变性电泳的方法从血淋巴中分离得到了酚氧化酶,该酶在非变性电泳中显示分子质量为300 ku;在海洋无脊椎动物中线性连续梯度非变性电泳中酚氧化酶的分子质量一般大于100 ku[16-17]。但在光棘球海胆的酚氧化酶系统中,酚氧化酶的分子质量是远小于标准蛋白marker的最小值[6],这说明两种生物即使在进化上相似,但也存在着酚氧化酶分子质量差异较大的现象。动力学分析表明,4种酚氧化酶最适底物为邻苯二酚,米氏常数Km值分别为0.25、4.89、1.51、1.63。以左旋多巴为底物,仿刺参4种酚氧化酶的最适pH分别为9.0、8.0、9.0、8.0,这意味着,仿刺参酚氧化酶系统在弱碱性环境下活性更强。此外,这4种酚氧化酶在pH为5.0~7.0时活力较低,表明pH偏低的酸性条件对仿刺参酚氧化酶系统的功能可能产生抑制。
3.3 酚氧化酶的耐热性
通过分析仿刺参酚氧化酶耐热性的试验结果,发现AjPO4、AjPO5、AjPO6 3种酚氧化酶在沸水中的时长对酶活性无明显影响,可以看出仿刺参酚氧化酶具有很好的耐热性,这与大多数海洋无脊椎动物酚氧化酶特征相同;而AjPO7在沸水中超过20 min活性开始急剧下降,AjPO7是雌性仿刺参特有的一种酚氧化酶,其他3种酚氧化酶是雌、雄仿刺参共有。关于AjPO7与其他3种酚氧化酶的耐热性差异能否对雌、雄仿刺参的耐热性产生影响,还需进一步研究。
3.4 二价金属离子对酚氧化酶活性的影响
近年,有关在某些水产养殖动物人工配合饲料中添加金属离子的报道较多。李荷芳等[18]研究表明,在中国明对虾(Fenneropenaeuschinensis)饲料中添加Mn2+,虽对增长、增质量无明显影响,但却能激活肝胰脏中的羧肽酶A;在皱纹盘鲍(Haliotisdiscushannai)[19-20]人工饲料中添加Ca2+、Fe3+、Mg2+等也有促生长作用。本试验中以多巴胺为底物,与Fe2+和Mn2+孵育后的4种酚氧化酶活性均有显著增强,表明这2种金属离子有助于仿刺参酚氧化酶的催化和酚氧化酶反应速率的提高,由此推测,在仿刺参饲料中添加一定量的Fe2+和Mn2+可能有助于增强仿刺参自身免疫活力。当Fe2+浓度高于25 mmol/L时,其他3种酚氧化酶活性上升,而AjPO7的活性出现明显的下降,相比与其他3种酚氧化酶,AjPO7受二价铁离子的影响机制可能存在特殊性。除Fe2+和Mn2+外的二价金属离子对仿刺参4种酚氧化酶活性的影响均不显著,这与光棘球海胆酚氧化酶活性受二价金属离子催化的结果相近[6],这意味着仿刺参酚氧化酶与光棘球海胆酚氧化酶受二价金属离子影响的机制可能相似。
3.5 抑制剂对酚氧化酶活性的影响
二乙基二硫代氨基甲酸钠、抗坏血酸、柠檬酸和亚硫酸钠均有较明显的抑制雌、雄仿刺参4种酚氧化酶活性的作用。其中,二乙基二硫代氨基甲酸钠是特异性的铜离子螯合剂,表明本试验中的雌、雄仿刺参4种酚氧化酶含铜[5],这与其他无脊椎动物酚氧化酶特性相似。然而,柠檬酸对仿刺参酚氧化酶活性的影响与其他海洋脊椎动物如海湾扇贝(Argopectehsirradians)[16]、菲律宾蛤仔[8]、虾夷马粪海胆(Strongylocentrotusintermedius)[21]显著不同,柠檬酸对雌、雄仿刺参4种酚氧化酶的抑制作用很明显,要强于大多数海洋无脊椎动物,这意味着酚氧化酶的催化机制在不同物种间并不相同,具体原因和规律还有待进一步研究。
3.6 AjPO7的特异性
AjPO7作为雌性仿刺参特有的1种酚氧化酶,与其他3种酚氧化酶相比,在耐热性以及受二价金属离子影响方面均有其特殊性,AjPO7的这种生化特性可为仿刺参雌雄鉴别技术研究提供基础数据支持。仿刺参这4种酚氧化酶生化与酶学特性的研究,有助于进一步了解仿刺参酚氧化酶系统的特性和功能,并为刺参免疫增强剂的开发提供科学指导。
4 结 论
本试验在仿刺参成参体腔细胞中分离纯化出4种酚氧化酶,其中雄性3种,雌性4种,分子质量为720~1236 ku,且具有很好的耐热性,与大多数海洋无脊椎动物酚氧化酶的特征相同。4种酚氧化酶均属于漆酶型酚氧化酶,并对邻苯二酚的亲和力最高。4种酚氧化酶最适pH的研究表明,仿刺参酚氧化酶系统在弱碱性环境下活性更强。与Fe2+和Mn2+孵育后的4种酚氧化酶活性均有显著增强。二乙基二硫代氨基甲酸钠、抗坏血酸、柠檬酸和亚硫酸钠均有较明显的抑制雌雄仿刺参4种酚氧化酶活性的作用,表明本试验中的雌、雄仿刺参4种酚氧化酶含铜,与其他无脊椎动物酚氧化酶特性相似。
