QuEChERS-UPLC-MRM-IDA Criteria-EPI测定红曲米中洛伐他汀
2016-11-17汪元符
汪元符
(南昌市食品药品检验所,江西 南昌330038)
QuEChERS-UPLC-MRM-IDA Criteria-EPI测定红曲米中洛伐他汀
汪元符
(南昌市食品药品检验所,江西 南昌330038)
目的:针对红曲米,建立其中所含洛伐他汀化学成分的QuEChERS-超高效液相色谱-MRM扫描(多重反应监测)-IDA Criteria-增强子离子扫描(EPI)的检测方法。方法:色谱柱为Phenomenex Luna C18(2)100A(150 mm× 2.00 mm,3 μm);柱温为35℃;流动相为10 mmol/L乙酸铵以乙酸调节pH值至3.0及乙腈,梯度洗脱;流速为0.2 mL/min;以优化后的质谱参数采集信号。结果:检出限浓度为0.5 ng/mL;定量限浓度为1.0 ng/mL;线性范围为定量限浓度~500 ng/mL;在线性范围内相关系数在0.99以上;加样回收率为99.0%~99.9%。结论:本方法准确,灵敏度高,专属性好;能用于红曲米中洛伐他汀化学成分的同时定性及定量检测。
QuEChERS-超高效液相色谱-MRM扫描(多重反应监测)-IDA Criteria-增强子离子扫描(EPI)检测法;红曲米;洛伐他汀
红曲米的使用至今已有 1 000多年的历史,李时珍在《本草纲目》中提到:“此乃人窥造化之巧者也”,“奇药也”,作为中药,它具有活血和健脾等功效。红曲霉属于真菌门、子囊菌亚门、不整子囊菌纲、散囊菌目、红曲科、红曲属[1]。红曲系通过现代生物工程技术分离出优质的红曲霉菌,经固体深层发酵精制而成一种纯天然绿色产品。本品性状为淡红色粉末,色调纯正,光热稳定性好,纯天然,安全无副作用,具有降血脂、血压、胆固醇,调节人体心脑血管健康、提高人体免疫力的医疗保健功效[2]。红曲菌能产生多种次级代谢产物,例如红曲色素、莫纳可林K(Monacolin K,MK)、γ-氨基丁酸(GABA)、抗氧化物质、降血压物质等[3],1979年由日本学者远藤章从红曲霉发酵液中分离得到,称为 Monacolin K。由于其疗效显著、毒副作用小、耐受性好而日渐受到重视,是目前在保健食品中唯一应用的他汀类物质[4]。近年来,随着生产菌种和工艺的不断改进,红曲米中洛伐他汀的含量越来越高[5],但并不是含量越高就越好。本法针对红曲米,建立其中所含洛伐他汀化学成分的QuEChERS-超高效液相色谱-MRM扫描(多重反应监测)-IDA Criteria-增强子离子扫描(EPI)的检测方法(QuEchERS-UPLC-MRM-IDA Criteria-EPI),能同时定性与定量对红曲米中的洛伐他汀进行测定,为红曲米的质量控制提供参考。
1 仪器、试剂与材料
AB Sciex 4000 Qtrap质谱,ekspert ultraLC100超高效液相色谱仪,METTLER TOLEDO ME204E电子分析天平,METTLER TOLEDO XS105电子分析天平,Hettich Rotina 380R 1706型医用低速离心机,昆山 KQ-300DB型数控超声波清洗器,Millipore超纯水系统。
试剂:乙腈(色谱纯,Merck),乙酸铵(优级纯,Macklin),甲酸(优级纯,Macklin),无水硫酸镁(优级纯),无水醋酸钠(优级纯),C18(粒度100 μm),PSA,石墨化碳。
对照品:洛伐他汀(批号:100600-200502),为中国食品药品检定研究院提供。
样品:购自市场和流通企业,产地分别为福建、湖北、山西、广东,共10个批次,批号:140107,140110,140201,140204,140206,140209,140310,140402,141046,141017,对应编号为① ~ ⑩。
2 方法与结果
2.1 高效液相色谱分析条件
分析柱:Phenomenex Luna C18(2)100A(150 mm×2.00 mm,3 μm)。柱温:35℃。流速:0.2 mL/min。进样量:5 μL。流动相:A为10 mmol/L乙酸铵以乙酸调节pH值至3.0,B为乙腈。按表1进行梯度洗脱。
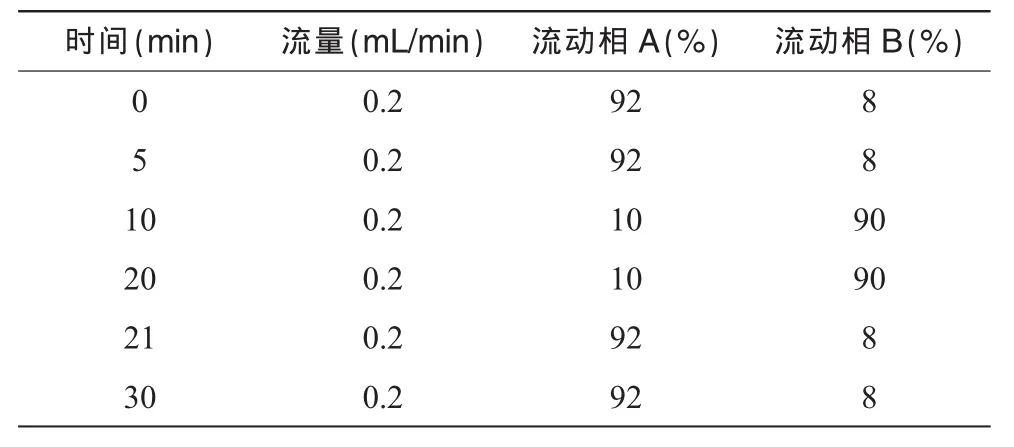
表1 梯度洗脱程序
2.2 质谱分析条件
电喷雾离子源(ESI):正离子模式(ESI+)。扫描模式:MRM扫描(多重反应监测)-IDA Criteria-EPI。扫描范围:50~650 Da。气帘气压力:25 Pa。碰撞气密度:中。电离喷雾电压:5 500 V。离子源温度:500℃。雾化气压力:55 Pa。辅助气压力:50 Pa。界面加热状态:开启。离子对选择见表2。

表2 质谱分析
2.3 对照品溶液的配制
取洛伐他汀对照品约10 mg,精密称定,以乙腈制成每1 mL中含1 mg的溶液作为对照品储备液。取对照品储备溶液以乙腈按一定比例稀释,可 得 到 各 含 0.5,1,2.5,5,10,25,50,100,250,500 ng/mL的标准系列工作液。
2.4 供试品溶液的配制
样品前处理:以四分法采样,取适量,研匀,称取0.5 g(精确到0.000 1 g),置50 mL量瓶中,加入乙腈约30 mL,超声萃取30 min,取出,冷却至室温后定容,以5 000 r/min离心,取上清液。
采用 QuEChERS法处理:取上述上清液约15 mL,加入适量的无水硫酸镁,无水醋酸钠,C18,PSA及石墨化碳,充分混合约5 min,以5 000 r/min离心,取上清液,经 0.2 μm微孔滤膜过滤后,取续滤液适当稀释后测定。
2.5 洛伐他汀离子对提取质谱图
见图1至图6。
综上所述,不仅东道国基础设施的完善有利于双边经济增长,而且东道国制度对于改善东道国基础设施的中国OFDI的双边经济增长效应也有着重要影响。以往关于“一带一路”的研究多将直接投资的经济增长效应与制度因素割裂开来,或者多研究东道国制度因素对中国OFDI整体的影响。本文着重从东道国各项制度出发,考察在“一带一路”背景下,东道国各项制度对中国直接投资,尤其是用于改善东道国基础设施的中国OFDI双边经济增长效应的影响。东道国制度不仅直接影响中国直接投资进入“一带一路”国家的风险和成本,更进一步影响中国直接投资的区域、类型和经济效果。[15]具体影响机理见图1。

图1 对照品浓度为100 ng/mL时总离子流质谱图

图2 对照品定量离子对(405.7/199.1)提取质谱图

图3 对照品定性离子对(405.7/285.3)提取质谱图

图4 样品总离子流质谱图
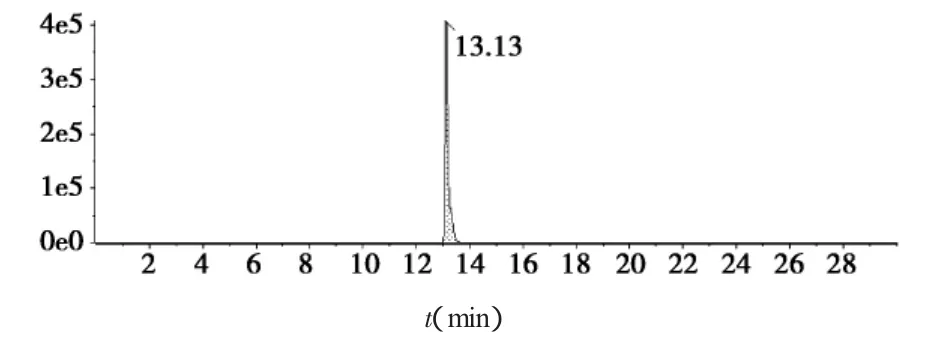
图5 样品定量离子对(405.7/199.1)提取质谱图

图6 样品定性离子对(405.7/285.3)提取质谱图
2.6 定性确认
采用保留时间与对照品相一致,且提取的二级质谱图与对照品相一致,判为检出。见图7~图8。

图7 对照品二级质谱图

图8 样品二级质谱图b(与对照品一致)
2.7 线性关系及检出限、定量限考察
采用“2.1”项下的色谱条件,“2.2”项下的质谱条件,以“2.3”项下的标准系列溶液进样检测。以检测所得峰面积为纵坐标,以标准系列溶液浓度(ng/mL)为横坐标,进行线性拟合。以定性离子对和定量离子对提取的质谱图信噪比均大于3时的浓度(ng/mL)为检出限。以定性离子对提取的质谱图信噪比大于3,定量离子对提取的质谱图信噪比大于10时的浓度(ng/mL)为定量限。以在一定浓度范围内,相关系数大于 0.99,为线性范围。结果见表3。
2.8 精密度试验
选用标准系列溶液中浓度为100 ng/mL的标准溶液,连续进样6针,以提取的定量离子对质谱图峰面积计算。结果见表4。
选用标准系列溶液中浓度为100 ng/mL的标准溶液,在0,1,2,4,8,12,24小时分别进样,以提取的定量离子对质谱图峰面积计算。结果见表5。
2.10 重复性试验
选用批号:140206的红曲米,按“2.4”项下的方法制备6份平行样品,按本法检测洛伐他汀的含量。结果见表6。
2.11 回收率试验
以同一批次样品试验,准确称取 0.50 g,按“2.4”项的方法制备供试液(稀释1 000倍),洛伐他汀的理论浓度为98.3 ng/mL,准确加入1.000,2.500,5.000 mL各含1 mg/mL的对照品储备液,再按 “2.4”项的方法制备成供试液 (稀释1 000倍),进行检测,以3次平行结果的均值计,结果见表8,高、中、低三个浓度的回收率均在99.5% ~100.1%之间。
2.12 样品测定结果
检测10批次样品,结果见表8。

表3 线性关系及检出限、定量限考察结果

表4 精密度试验结果

表5 稳定性试验结果

表6 重复性试验结果
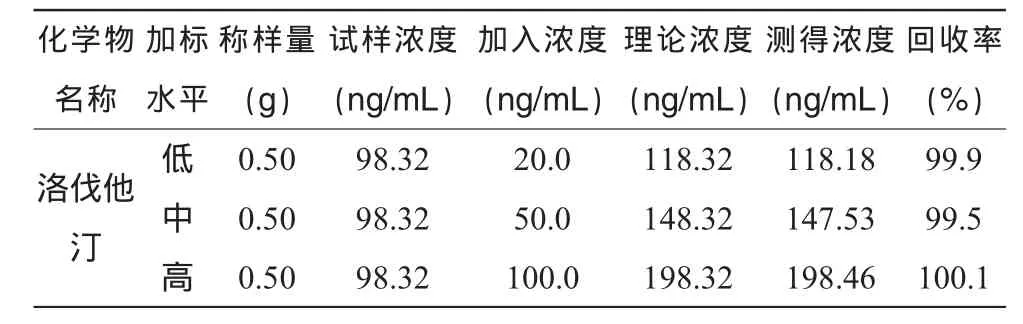
表7 加标回收试验结果

表8 红曲米中洛伐他汀测定结果
3 讨论
3.1 供试品提取溶剂选择
据文献[6],洛伐他汀易溶于乙酸乙酯而不溶于酸与水,红曲米中洛伐他汀含量测定中多用甲醇或乙醇超声提取,本法对此做了改变,采用乙腈为提取液,经比较同样能较好地提取红曲米中的洛伐他汀。
3.2 供试品前处理
据文献[7],红曲米中洛伐他汀的前处理方法有直接超声法,超声提取后再经氧化铝层析柱纯化法,本法基于简单、便利、快捷的原则,采用QuEChERS法对供试品提取液进行进一步处理净化,排除了多余杂质及色素的干扰,能满足液质进样需要。
[1] 逯慎杰,刘秀河.功能性红曲中功能成分的研究进展[J].江苏调味副食品,2011,28(1):17-20.
[2] 杜珊.高效液相色谱法测定红曲中洛伐他汀的含量[J].天津化工,2010,24(3):54-60.
[3] 黄志兵,许杨,张泓,等.红曲菌几种主要次级代谢产物及其生物活性的研究进展[J].食品与发酵工程,2010,36(4):143-148.
[4] 姜楠,马壮飞,刘思洁,等.红曲类保健食品中洛伐他汀检测的方法研究[J].中国卫生检验杂志,2013,23(1):73-74.
[5]罗仁才,孙开奇,谢申猛,等.红曲中洛伐他汀总量的测定方法[J].卫生研究,2003,32(2):157-158.
[6] 张艳红.高效液相色谱法测定红曲米中洛伐他汀的含量[J].食品科学,2001,22(7):67-69.
[7] 范雯.高效液相色谱法测定红曲药材中洛伐他汀的含量[J].现代医药卫生,2013,29(16):2417-2419.
Determination of Lovastatin in Red Yeast Rice by QuEChERS-UPLC-MRM-IDA Criteria-EPI
Wang Yuanfu(Nanchang Institute for Food and Drug Control,Jiangxi Nanchang 330038,China)
Objective:To develop a QuEChERS-UPLC-MRM-IDA Criteria-EPI method for determination of lovastatin in red yeast rice.Methods:Phenomenex Luna C18(2)100A column(150 mm×2.00 mm,3 μm)was used at a column temperature of 35℃,serving 10 mmol/L ammonium acetate (pH 3.0)-acetonitrile as a mobile phase by gradient elution at a flow rate of 0.2 mL/min.Signals were collected under the optimized condition.Results:The detection limit of this method was 0.5 ng/mL,while the limit of quantitation was 1.0 ng/mL,and the linear range was the limit of quantitation~500 ng/mL.Within the linear range,the correlation coefficient was more than 0.99,while the sample recovery rate was 99.0%~99.9%.Conclusion:This method is accurate,sensitive and specific,which may be used for the qualitative and quantitative determinations of lovastatin in red yeast rice.
QuEChERS-UPLC-MRM-IDA Criteria-EPI;Red Yeast Rice;Lovastatin
10.3969/j.issn.1672-5433.2016.10.006
2016-05-22)
汪元符,男,主管医师。研究方向:中药理论、药物检测及食品安全。E-mail:wanngel@126.com
